枸杞多糖缓解新生大鼠缺血缺氧性脑损伤的作用机制研究
朱利威,张树暾,焦 震
缺氧缺血性脑病(hypoxia-ischemia brain damage,HIBD)是由于各种围生期因素引起的脑缺氧或缺血而形成的常见脑损伤,主要表现为意识状态及肌张力变化。根据病情变化可分为轻度、中度、重度。轻度、中度表现为兴奋或迟钝,肌张力正常或减低,重度可表现为昏迷、肌张力松软、惊厥频繁等。多伴有严重的后遗症,如脑瘫、癫痫、学习困难等[1-3]。枸杞多糖(Lycium barbarum polysaccharide,LBP)是一种生物活性物质,从传统中药枸杞子中提取的一种水溶性多糖,具有生殖系统保护、抗氧化及抗衰老、免疫调节、抗肿瘤、调节血脂和降血糖、抗辐射、神经保护、抗癌等作用[4-5]。本实验主要探讨LBP通过Toll样受体4(TLR4)/信号转导和转录激活因子3(STAT3)通路缓解新生大鼠HIBD的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
选取100只SD新生大鼠,体质量18~22 g,由北京维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2017-0022。
1.1.2 药物与试剂
枸杞多糖购自青海康普生物科技股份有限公司,质量分数为55%,生产批号:KPGQZ-TQW-13-02;脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)细胞凋亡检测试剂盒购自杭州四季青生物工程材料有限公司;丙二醛(MDA)、超氧化物歧化酶(SOD)和乳酸脱氢酶(LDH)试剂盒购自北京中杉金桥生物技术有限公司;酶联免疫吸附试验(ELISA)试剂盒购自北京索莱宝科技有限公司;RIPA裂解液、二喹啉甲酸(BCA)蛋白浓度测定试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制试剂盒购自美国Cell Signaling Technology公司;一抗和二抗购自美国Thermo公司。
1.2 方法
1.2.1 动物分组、模型构建及药物处理
100只SD新生大鼠,随机分为假手术组(Sham组)、模型组(HIBD组)及LBP低剂量组(HIBD+L-LBP组)、中剂量组(HIBD+M-LBP组)、高剂量组(HIBD+H-LBP组),每组20只。Sham组大鼠只进行创伤处理;HIBD组采用Rice-Vannucci方法建立大鼠HIBD模型[6];HIBD+L-LBP组、HIBD+M-LBP组、HIBD+H-LBP组建立大鼠HIBD模型后,再用10、20、40 mg/kg的LBP进行药物处理。为观察高剂量LBP对脂多糖(LPS)激活TLR4/STAT3通路后相关蛋白表达、氧化应激和炎性因子的影响,建立大鼠HIBD模型后,LPS激活TLR4/STAT3通路(HIBD+LPS组),再用40 mg/kg的LBP进行处理(HIBD+LPS+H-LBP组)。
1.2.2 苏木精-伊红(HE)染色
处死大鼠,取脑组织,制成切片。将脑组织置于二甲苯溶液、无水乙醇、95%乙醇、85%乙醇、70%乙醇中各浸泡5 min;磷酸缓冲盐溶液(PBS)洗涤3次,然后浸入苏木精内染色3~5 min,水洗30~60 s;酸水浸润20 s,水洗30~60 s;氨水中浸润40 s,水洗30~60 s,伊红染液中染色2 min,清洗并用滤纸吸干多余染液,再滴加适量中性树胶,盖玻片封固,显微镜下观察染色情况并分析。
1.2.3 TUNEL染色
取大鼠脑组织切片,依次使用二甲苯和无水乙醇、95%乙醇、85%乙醇、70%乙醇溶液清洗,在37 ℃条件下,用蛋白酶K处理15 min,PBS清洗。10%中性甲醛固定2次,加入末端脱氧核苷酸转移酶(TdT)缓冲液,孵育5 min;再加入预热终止液,反应20 min,滴加过氧化酶标志物抗体,孵育20 min,加上3,3′-二氨基联苯胺(DAB)显色液,30 min后用无水乙醇和二甲苯固定,晾干,封片。荧光显微镜下观察染色结果。
1.2.4 试剂盒检测氧化应激水平
采用SOD、MDA、LDH试剂盒检测其氧化应激水平,操作过程按照附带的详细说明书进行。
1.2.5 ELISA检测炎性因子水平
ELISA试剂盒检测白细胞介素(IL)-1β、IL-18、IL-6炎性因子水平,实验过程按照试剂盒的说明书严格、逐步进行。
1.2.6 蛋白免疫印记法(Western Blot)检测蛋白表达
剪碎大鼠脑组织,加入RIPA裂解液提取总蛋白。根据BCA检测试剂盒测定蛋白浓度,取40 μg蛋白样品上样进行SDS-PAGE电泳,转膜后封阻2 h,加入稀释的一抗(Bcl-2、Bax 均为1∶800稀释,磷酸化STAT3(p-STAT3)/STAT3、TLR4、磷酸化p65(p-p65)/p65和肿瘤坏死因子-α(TNF-α)均为1∶1 000稀释),4 ℃过夜,加入1∶2 000稀释的二抗,室温孵育2 h,滴加增强型化学发光试剂(ECL)化学发光液显影,在凝胶成像系统中收集图像,使用Quantity One软件分析蛋白的相对表达水平。
1.3 统计学处理

2 结 果
2.1 LBP对HIBD大鼠脑组织损伤的影响
与Sham组比较,HIBD组大鼠脑组织细胞凋亡率、Bax蛋白表达明显升高,Bcl-2蛋白表达明显降低,差异均有统计学意义(P<0.05);与HIBD组比较,HIBD+L-LBP组、HIBD+M-LBP组、HIBD+H-LBP组大鼠脑组织细胞凋亡率、Bax蛋白表达明显降低,Bcl-2蛋白表达明显升高,差异均有统计学意义(P<0.05)。详见图1、表1。

表1 各组大鼠脑组织细胞凋亡率及Bcl-2、Bax蛋白表达比较(±s)

图1 各组脑组织Bcl-2、Bax蛋白表达条带图
2.2 LBP对HIBD大鼠脑组织氧化应激和炎性因子的影响
与Sham组比较,HIBD组脑组织SOD水平明显降低,MDA、LDH水平以及IL-1β、IL-18、IL-6水平明显升高,差异均有统计学意义(P<0.05);与HIBD组比较,HIBD+L-LBP组、HIBD+M-LBP组、HIBD+H-LBP组大鼠脑组织SOD水平明显升高,MDA、LDH、IL-1β、IL-18、IL-6水平明显降低,差异均有统计学意义(P<0.05)。详见表2。

表2 各组大鼠脑组织氧化应激和炎性因子表达比较(±s)
2.3 LBP对HIBD大鼠脑组织TLR4/STAT3通路相关蛋白表达的影响
与Sham组比较,HIBD组大鼠脑组织p-STAT3/STAT3、TLR4、p-p65/p65和TNF-α蛋白表达明显升高(P<0.05);与HIBD组比较,HIBD+L-LBP组、HIBD+M-LBP组、HIBD+H-LBP组大鼠脑组织p-STAT3/STAT3、TLR4、p-p65/p65和TNF-α蛋白表达明显降低(P<0.05)。详见表3、图2。

表3 各组大鼠脑组织TLR4/STAT3通路相关蛋白表达比较(±s)
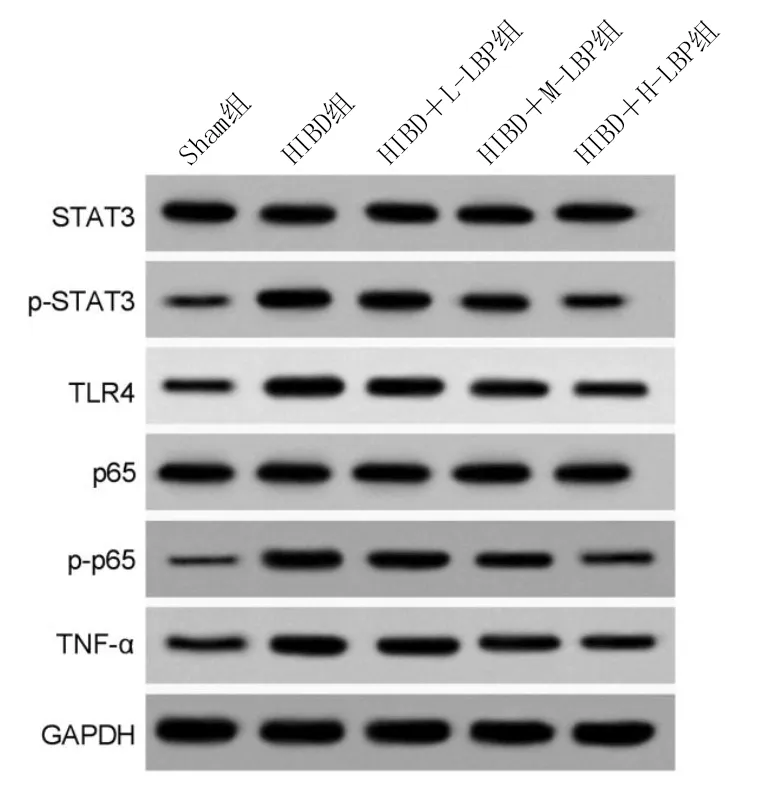
图2 各组TLR4/STAT3通路相关蛋白表达的条带图
2.4 高剂量LBP对LPS激活TLR4/STAT3通路后相关蛋白表达的影响
与Sham组比较,HIBD组大鼠脑组织p-STAT3/STAT3、TLR4、p-p65/p65和TNF-α蛋白表达明显升高(P<0.05)。与HIBD组比较,HIBD+H-LBP组大鼠脑组织p-STAT3/STAT3、TLR4、p-p65/p65和TNF-α蛋白表达明显降低(P<0.05);HIBD+LPS组各蛋白表达明显升高(P<0.05)。与HIBD+LPS组比较,HIBD+LPS+H-LBP组大鼠脑组织p-STAT3/STAT3、TLR4、p-p65/p65和TNF-α蛋白表达明显降低(P<0.05)。详见表4、图3。

表4 高剂量LBP对LPS激活TLR4/STAT3通路后相关蛋白表达的影响(±s)

图3 各组TLR4/STAT3通路相关蛋白表达的条带图
2.5 高剂量LBP对LPS激活TLR4/STAT3通路后氧化应激和炎性因子的影响
与Sham组比较,HIBD组大鼠脑组织SOD水平明显降低,MDA、LDH、IL-1β、IL-18、IL-6水平明显升高,差异均有统计学意义(P<0.05)。与HIBD组比较,HIBD+H-LBP组大鼠脑组织SOD水平明显升高,MDA、LDH、IL-1β、IL-18、IL-6水平明显降低,差异均有统计学意义(P<0.05);HIBD+LPS组大鼠脑组织SOD水平明显降低,MDA、LDH、IL-1β、IL-18、IL-6水平明显升高(P<0.05)。与HIBD+LPS组比较,HIBD+LPS+H-LBP组大鼠脑组织SOD水平明显升高,MDA、LDH、IL-1β、IL-18、IL-6水平明显降低,差异均有统计学意义(P<0.05)。详见表5。

表5 高剂量LBP对LPS激活TLR4/STAT3通路后氧化应激和炎性因子的影响(±s)
3 讨 论
HIBD的病理变化有很多,主要有脑水肿、选择性神经元坏死、基底神经节大理石样变性、大脑矢状旁区神经元损伤、脑室周围白质转化。临床症状有突然高热、畏寒、剧烈头痛伴喷射性呕吐,婴幼儿可有交替出现的烦躁与嗜睡,双目凝视,尖声哭叫,拒乳,易惊等,严重者迅速进入昏迷状态[7-9]。
本实验研究表明,与Sham组比较,HIBD组大鼠脑组织细胞凋亡率明显升高;与HIBD组比较,不同剂量LBP组脑组织细胞凋亡率明显降低。已有类似的研究报道,与模型组比较,LBP各剂量明显改善小鼠脑缺血后神经功能缺陷,大脑神经元凋亡率明显降低[10]。有研究表明,与正常组比较,氧糖剥夺再灌注损伤组神经细胞凋亡率明显升高;与损伤组比较,10、20、40 mg/L的LBP可明显降低神经细胞凋亡率。与正常组比较,模型组神经细胞凋亡率升高;与模型组比较,LBP治疗组(10、20、40 mg/L)神经细胞凋亡率明显降低[11]。
本研究发现显示,与Sham组比较,HIBD组大鼠脑组织氧化应激程度和炎性因子水平明显升高;与HIBD组比较,不同浓度LBP组氧化应激程度和炎性因子水平明显降低。有研究结果表明,LBP能够抑制糖尿病小鼠视网膜内的血管新生及氧化应激反应、炎症反应,对糖尿病视网膜病变具有治疗作用[12]。LBP可提高高脂血症小鼠抗氧化应激能力[13]。LBP可保护急性胰腺炎(AP)小鼠的胰腺损伤,其机制可能与抑制炎性因子、氧化应激分子有关,将为LBP的临床应用提供依据[14]。
本实验研究结果显示,与Sham组比较,HIBD组大鼠脑组织TLR4/STAT3通路相关蛋白表达明显升高;与HIBD组比较,不同浓度LBP组TLR4/STAT3通路相关蛋白表达明显降低。邓俊超等[15]研究发现,佛司可林通过抑制TLR4/STAT3通路减轻新生大鼠HIBD氧自由基水平和炎症水平。
本实验研究显示,与HIBD组比较,LPS激活大鼠脑组织TLR4/STAT3通路后,其相关蛋白表达明显升高,但LBP降低了LPS激活TLR4/STAT3通路后p-STAT3/STAT3、TLR4、p-p65/p65和TNF-α蛋白表达。与HIBD组比较,LPS激活TLR4/STAT3通路后,大鼠脑组织氧化应激程度和炎性因子水平明显升高,但LBP通过抑制TLR4/STAT3通路活化,降低氧化应激程度和炎性因子水平。
综上所述,LBP通过抑制TLR4/STAT3通路减轻新生大鼠HIBD,为治疗心脑血管疾病提供了机制。

