CT-MRI双定位图像融合技术在低级别脑胶质瘤术后调强放疗中的应用
冯 会,高 峰,黄丙俭,任 伟
(1 临沂市肿瘤医院,山东 临沂 276000;2 兰陵县人民医院)
近年来,放射治疗已从常规外照射向三维适型放疗、适型调强放疗、立体定向放疗等方向发展,而肿瘤靶区以及正常器官的精确勾画已成为评价放疗计划优劣的依据,甚至影响患者的预后生存。在精确放疗中,CT 为放疗计划的基石,因其可以提供用于剂量计算的解剖和电子密度的可靠信息。但由于对软组织的分辨率较差,若仍简单采用CT 图像来定义靶区轮廓,势必会造成靶区遗漏,从而增加了肿瘤复发的风险。因此,在软组织以及中枢神经系统等部位肿瘤的靶区勾画常需借助磁共振成像(MRI)影像[1]。本研究对比分析了CT/MRI融合图像与CT 图像勾画的临床靶区(CTV)的体积差异及对靶区勾画的影响,为临床提供参考。
1 资料与方法
1.1 一般资料 选择自2022 年1 月—2023 年2月本院收治的14例低级别脑胶质瘤患者,其中男8例,女6例;年龄14~66岁(中位年龄41岁)。纳入标准:均经术后病理确诊;低级别脑胶质瘤;PS评分≤2分。排除标准:脑转移瘤、高级别脑胶质瘤及原发灶不明的其他脑占位性病变。本研究经医院伦理委员会审批,患者或其家属签署知情同意书。
1.2 方法 CT 和MRI定位:CT 定位前患者空腹4 h以上,仰卧位,根据患者体型选择合适的枕型,采用热塑膜面罩配合发泡胶固定头部。采用西门子64排CT 模拟机定位,先用三维激光灯确定参考点的位置,并在体表放置铅豆标记为参考点,强化扫描采集图像。FOV 为380 mm,层厚3 mm,无间隔。患者保持相同的体位、枕垫和面罩固定进行强化MRI定位,在面罩上标记的同一参考点位置放置塑料标记,进行飞利浦3.0T MRI扫描,扫描范围、基线、层厚和FOV 值与CT 扫描保持一致,分别采集T1和T2加权图像。将采集的MRI图像刻录为光盘传输至Varian Eclipse TPS 计划系统。图像融合:分别由1名经验丰富的物理师及主任医师共同采用Auto Match 法+Manual Match 法进行图像融合,共同评价融合的效果。要求3个激光定位标记点完全重合,人体的外轮廓、解剖结构及骨性标志完全重合。靶区勾画及测量:运用Varian Eclipse TPS软件系统,由同一高年资主任医师分别对每例患者依据CT/MRI融合图像及CT 图像分别进行靶区勾画。勾画GTV 时CT 窗宽/窗位为30/300,MRI窗宽/窗位为400/600。分别需要勾画GTV、CTV、OAR。勾画标准参照RTOG。然后由同2名高年资医师共同确认靶区范围。利用Varian Eclipse TPS计划系统上的靶区体积计算功能分别计算并记录每例患者基于CT 图像以及CT/MRI融合图像上所勾画的CTVCT、CTVCT/MRI的体积并计算比值。若比值在0.9~1.1之间,则说明两种方法体积接近,比值<0.9或>1.1则说明两种勾画方法差异明显。
2 结果
CTVCT 为(196.73±132.74)cm3,CTVCT/MRI为(230.43±150.21)cm3,两者比较差异有统计学意义(t=84.35,P<0.01)。14例患者中2种靶区勾画方法差异明显者有8个(57.14%),所有靶区均为融合图像的体积大于CT 图像的体积。进一步分析发现,差异明显者主要分布在有瘤周水肿区的患者。各例患者的CTV 体积及比值见表1。
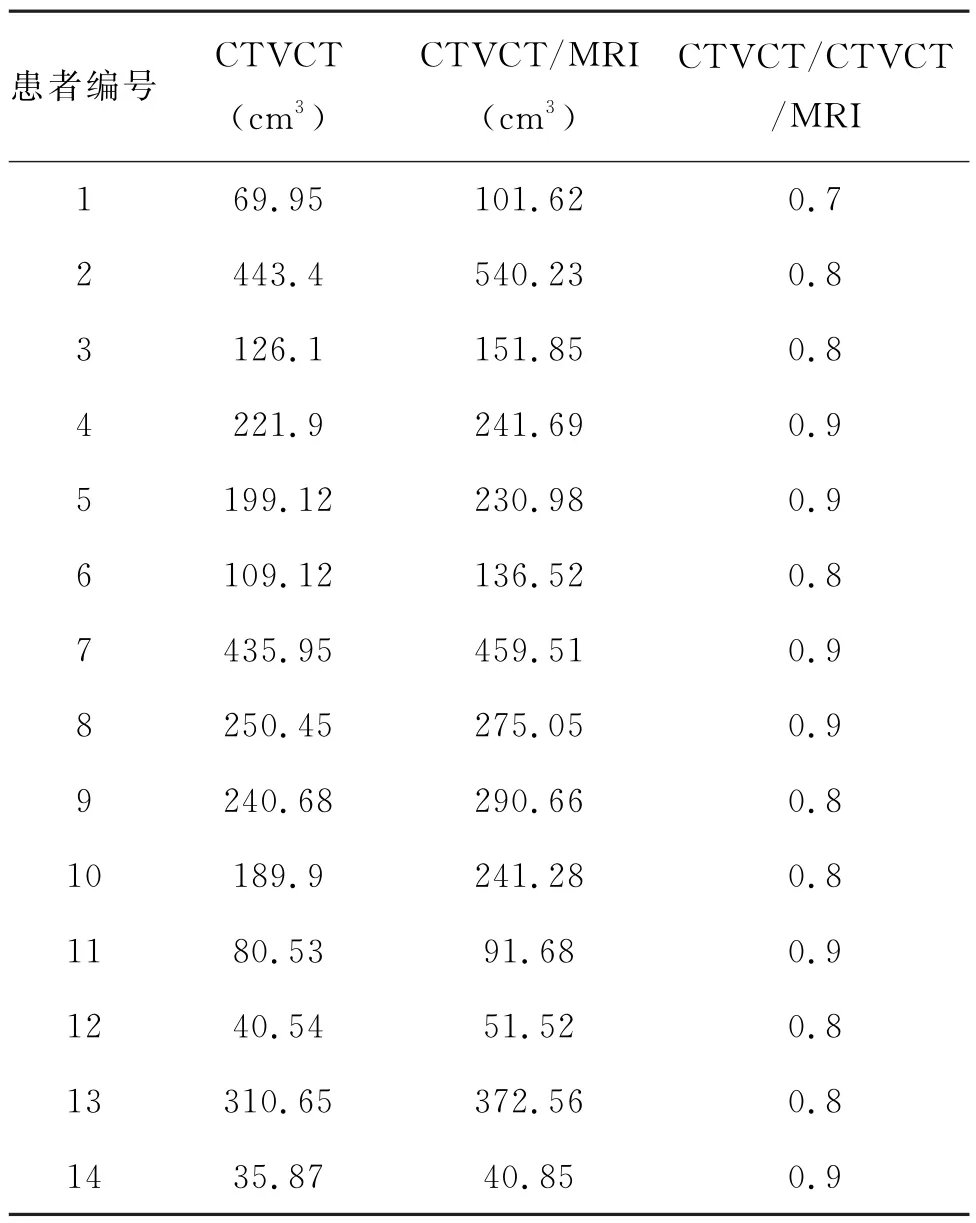
表1 14例患者的CTV 体积及比值
3 讨论
脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,根据2021年版WHO中枢神经系统肿瘤分类,脑胶质瘤分为1~4级,1、2级为低级别,3、4级为高级别。其中低级别脑胶质瘤约占脑胶质瘤的30%,患者的发病年龄相对年轻,发病部位常位于或靠近重要功能区,如运动、语言、视空间和记忆[2]。放射治疗是脑胶质瘤治疗中最重要的一环。
在放疗过程中,准确勾画靶区及危及器官是首要且关键的步骤。不同的图像技术提供了不同的信息,各种影像图像有其内在成像的优缺点,目前尚无单独一种图像能完全用于肿瘤靶区的勾画。CT 图像具有良好的空间分辨率,能清晰显示解剖结构及病变,且CT 值可直接转换为电子密度进行剂量计算。但其对软组织尤其浸润性肿瘤的分辨率差,无法清晰显示其边界。MRI成像中病变组织与正常组织之间的差异较明显,具有多参数成像特点、对软组织肿瘤特别是浸润性肿瘤有较高的敏感性,可以很好地界定由于手术造成的正常解剖结构的改变以及鉴别水肿区的存在,但不能提供剂量计算所需的电子密度。因此,可以将二者图像融合,来进一步提高靶区勾画的精确性,从而提高放疗的效果,并且能更好的保护正常组织。CT/MRI融合图像充分发挥了CT 和MRI的各自优势,对肿瘤边界的显示则更加清晰,尤其T2-FLAIR 图像对瘤周水肿区的显像要比CT 图像精确地多。
图像配准的方法很多,常用的有标点法、手动融合法、互信息法等[3]。本研究中,笔者采用计划系统中自带的自动匹配联合手动匹配,要求配准后的图像中3个激光定位标记点完全重合,人体外轮廓、骨性标志和解剖结构基本重合,定位精度大约在1~2 mm,完全满足临床的需要,且本院的MRI机可以采用与CT 定位相同的体位,误差更小。
对于脑胶质瘤术后放疗靶区的争议一直存在。对于靶区的制定需要考虑很多因素,包括术前肿瘤的位置、浸润范围、邻近的周围器官、肿瘤的病理学分级、分子分型、水肿区的大小以及术后有无残留等。对于低级别脑胶质瘤的勾画,GTV 主要是根据手术前、后MRI T2-FLAIR 异常的信号区域,推荐以GTV 外扩1~2 cm 作为CTV。高级别胶质瘤放疗靶区争议至今,其焦点主要是CTV 是否需要包括瘤周水肿区。但Ⅱ期临床试验证实:放疗靶区是否包括水肿区,在肿瘤控制和生存期上均无明显差异[4]。欧洲癌症研究和治疗组织(EORTC)推荐的CTV 设定并不强调一定要包括所有瘤周水肿区。本研究中,笔者只选取了低级别脑胶质瘤的患者,靶区勾画的原则遵循美国肿瘤放射治疗协会(RTOG)推荐的原则,包含术后MRI T2-FLAIR 异常信号的区域,对靶区勾画的争议少,异质性更小。本研究重点对比CT/MRI融合前后CTV 的变化,发现CTVCT 与CTVCT/MRI不一致,且所有的靶区均显示CTVCT 的靶区小于CTVCT/MRI,可能的原因考虑为瘤周水肿及残留病灶的影响。在CT 影像上瘤周水肿区与正常组织分界不清,勾画靶区时仅包含了术腔及残留灶,未包含或包全瘤周水肿区,导致靶区偏小,而MRI的不同序列,尤其T2-FLAIR序列,可以较清晰分辨出瘤周水肿和肿瘤的浸润范围。因此在CT/MRI融合图像上勾画靶区,可以使靶区剂量覆盖的更充分、更精确。
综上所述,将CT/MRI图像融合技术应用于脑胶质瘤术后调强放射治疗靶区勾画及放疗计划设计的制定,可以减少放疗靶区的遗漏,是更精确、合理、安全的方法。

