TCP1在上皮性卵巢癌组织中的表达及临床诊断价值
陈 燕,赵娟红,张洪专,张 康,王 娟
(山东医学高等专科学校附属医院,山东 临沂 276000)
上皮性卵巢癌(Epithelial ovarian cancer,EOC)是最常见的卵巢癌组织学亚型,占卵巢恶性肿瘤的95% 以上[1]。85% 的晚期卵巢癌血清CA125升高,并且与分期呈相关性,然而,早期卵巢癌CA125升高不到50%,寻找敏感、特异的诊断标记物来监测卵巢癌病情至关重要。分子伴侣素(Tcomplexprotein-1ringcomplex,TRiC,又称CCT)是普遍存在于细胞内的高度保守的基因家族产物,由8个同源基因编码的蛋白质亚基(TCP1.CCT2-CCT8)在每个环中精确排列组成的大型双环复合物,主要参与蛋白质的折叠和空间结构的形成[2]。研究表明,TCP1在许多肿瘤组织中表达升高[3-6],与肿瘤发生发展及不良预后相关。本研究通过分析TCP1在EOC中的表达,探讨其诊断价值。
1 资料与方法
1.1 一般资料 选取2017年1月—2022年1月本院收治的52例EOC 患者。纳入标准:均经术后病理组织学确诊;均为初诊,术前未接受过放化疗和激素治疗。排除标准:合并其他良、恶性女性生殖系统疾病;合并消化道肿瘤或其他系统的良恶性肿瘤。52例患者,年龄32~68 岁,平均(51.23±11.21)岁;国际妇产科联盟(FIGO)分期[2]:Ⅰ期9例,Ⅱ期11例,Ⅲ期18例,Ⅳ期14例;高、中分化(G1、G2)16例,低分化(G3)36例。另选取同期卵巢良性病变患者60例为良性组,年龄23~56岁,平均(50.82±10.04)岁。两组患者一般资料相比无统计学意义(P>0.05),具可比性。
1.2 方法 TCP1检测:将两组病变组织用石蜡包埋,切4~5μm 厚切片,经过烘干、脱蜡和水化,在柠檬酸钠缓冲液中抗原修复15 min;3%过氧化氢孵育10 min后洗涤3次;加入封闭液继续孵育10 min阻断非特异性结合。加入TCP1 抗体(1∶200),4℃孵育过夜,洗涤3次后与二抗(1∶300)室温孵育结合。再次洗涤,DAB显色,苏木素复染,常规脱水,透明,封片,阅片。显微镜下随机选取5个视野,按照染色强度和细胞阳性率进行评分。CA125检测:抽取所有受试者空腹外周静脉血4~5 m L,用化学发光法检测卵巢癌组患者血清CA125水平。
1.3 指标评定 TCP1:染色强度评分:无色为0分,淡黄色为1分,黄色为2分,棕黄色为3分;细胞染色阳性率评分:每张切片在高倍镜视野下连续计数100个细胞,阳性细胞数小于5%的为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。将染色强度和染色阳性率两项得分相乘作为免疫组化得分,<4 分为TCP1阴性,≥4 分为TCP1 阳性。CA125 正常值范围0~35 U/m L,以超过正常值上限为阳性。
2 结果
2.1 两组TCP1的表达情况 TCP1蛋白主要位于细胞质内,在上皮性卵巢癌组织中大量表达,阳性率高于良性组;CA125水平也高于良性组。见表1。

表1 两组TCP1、CA125表达水平的比较
2.2 EOC患者TCP1表达 与临床病理特征的关系FIGO 分期Ⅲ、Ⅳ期患者比Ⅰ、Ⅱ期患者TCP1的表达阳性率高,低分化患者比高分化患者TCP1的表达阳性率高;在年龄和淋巴结转移方面TCP1的表达阳性率无统计学差异。见表2。
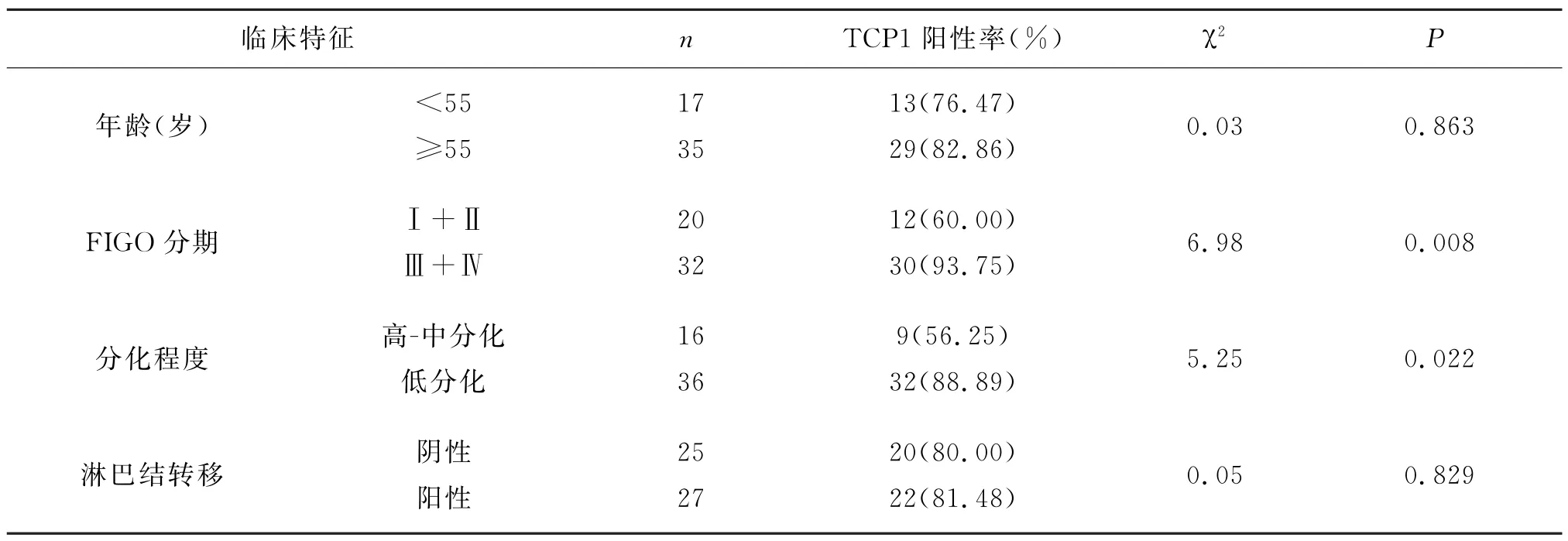
表2 TCP1表达与患者临床病理特征的关系
2.3 TCP1 联合CA125 对EOC 的诊断价值TCP1与血清CA125联合检测敏感度为88.46%,特异性为88.33%,高于TCP1、血清CA125单项检测。见表3。
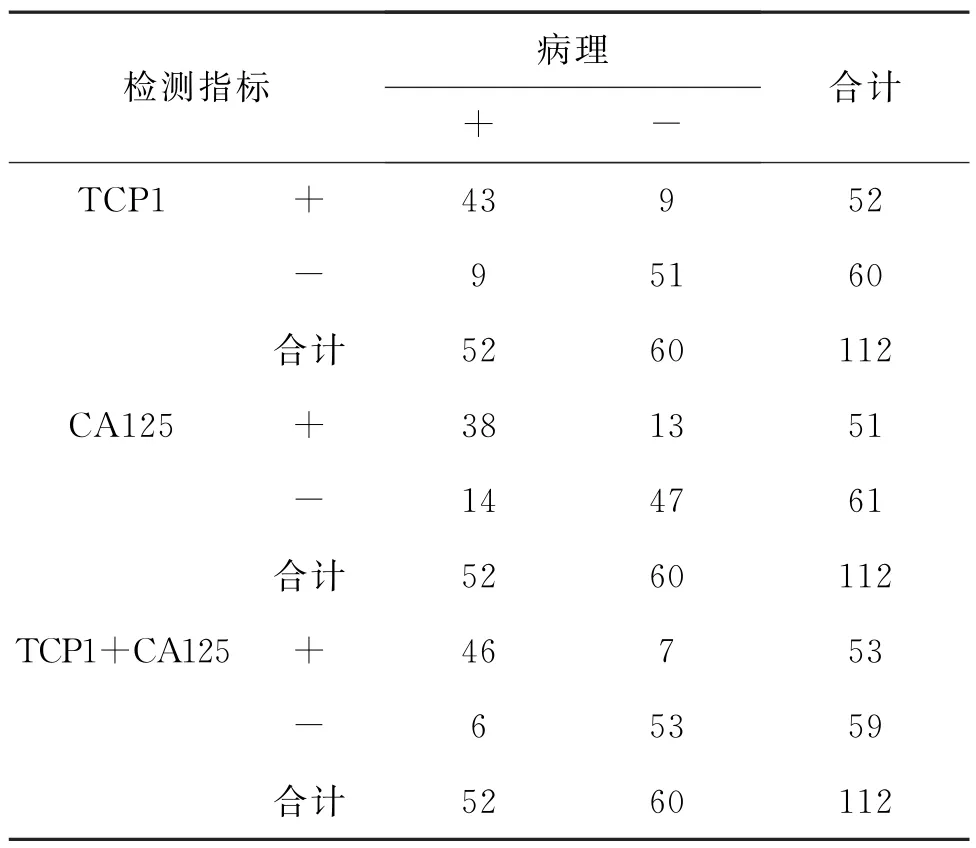
表3 TCP1、CA125及联合检测对EOC的诊断结果
3 讨论
卵巢癌是妇科中具有高度侵袭性和致命性的肿瘤。由于该病缺乏有效的筛查手段且早期临床症状不明显,患者确诊时多为中晚期,即使进行了手术和化疗,仍有75%的患者出现肿瘤复发,其中又有20%发展为耐药性。所以,阐明该病潜在的生物学机制,对开发有效的新型抗癌药物十分必要。
研究发现,当卵巢癌细胞对顺铂产生耐药性后,细胞中的TRiC m RNA 的表达增加了4倍以上[3]。越来越多的研究发现,TRiC 多种亚基在肿瘤样本中过表达,并在肿瘤的发生与发展中扮演着重要的角色。TCP1 通过AKTGSK3B 路和ERK 路稳定c Myc癌蛋白,促进c-Myc向促增值基因的转录,进而促进胰腺癌和肝癌细胞的增殖[5-6]。Sun等[7]研究显示,在含TCP1亚基的大肠癌患者预后不良与CD4+T 细胞、B 细胞和树突状细胞等免疫浸润减少有关,表明TCP1可能通过调节免疫细胞浸润,进而在调节抗肿瘤免疫反应中发挥作用。Chang等[8]研究发现TCP1 过表达时可以通过促进AKTGSK3β-β-catenin和XIAP-Survivin 通路恢复肿瘤的化学抗性和细胞迁移/侵袭,导致耐药和肿瘤细胞转移的发生。另外,TRiC的a亚基TCP1通过调控PI3K 信号通路促进乳腺癌细胞增殖,对患者预后至关重要[9]。
TCP1在卵巢癌的发生发展中的作用机制研究较少。本研究发现,TCP1 的表达随着卵巢病变的恶性程度而升高,病理分级与临床分期直接影响TCP1在卵巢癌组织中表达阳性率。表明TCP1表达上调使得卵巢癌细胞更具侵袭性。另外,结合CA125联合检查,可以提高卵巢癌肿瘤标记物的阳性筛查率,灵敏度和特异度均比单一检查时增高。
综上所述,TCP1 在EOC 患者组织中异常表达,检测其在肿瘤组织中的表达水平,可对疾病的诊断做出预测。TPC1有望成为卵巢癌患者预后的新的生物学标记物。本研究尚有不足之处:样本量不够大,尚需扩大样本量进一步研究证实;仅收集卵巢上皮性癌作为标本,对卵巢癌其他分类未做试验统计,下一步研究可以纳入实验组,进一步验证其临床价值。

