1例罕见反转型滤泡性淋巴瘤的诊断、鉴别诊断及文献复习
陈少红 王小拍
广州市第一人民医院病理科(广州 510180)
滤泡性淋巴瘤(follicular lymphoma,FL)是由生发中心性B细胞性(由中心细胞及中心母细胞)构成的肿瘤性病变,并且至少具有部分滤泡生长模式。2017年WHO造血淋巴组织肿瘤分类中,提到几种特殊类型的生发中心性肿瘤,如原位FL,儿童FL,睾丸FL,十二指肠FL,弥漫性FL,FL伴边缘区分化等,本文介绍一种罕见的具有独特生长方式的生发中心性淋巴瘤。
1 资料与方法
1.1 临床资料
男,12岁,发现左侧颈部包块半年余,无红肿热痛;核磁共振:双侧颈部多发小淋巴结,最大约2 cm;外周血检查:未见异常。
1.2 方法
切除淋巴结经10%福尔马林固定,常规石蜡包埋,4 μm厚切片,HE染色。免疫组织化学染色采用 EnVision 两步法,原位杂交检测EB病毒编码的小RNAs(EBV-encoded RNA,EBER)评估EB病毒的感染。荧光原位杂交(fluorescence in situ hybridization,FISH)法检测BCL-2基因是否有断裂。
2 结 果
2.1 HE组织形态学
淋巴结结构大部分破坏,淋巴窦消失,可见大小不等的结节状结构及局灶稍弥漫区域(图1A)。结节中央可见生发中心样结构,由中心细胞及中心母细胞样细胞组成,可见星空现象。周围可见套区样结构,由深染的小淋巴细胞组成。紧接着最外层为淡染区,由中心样细胞及中心母细胞样细胞组成,染色质疏松,胞浆稍丰富,未见星空现象(图1B-1F)。局灶区域,可见淡染区细胞破坏套区细胞并浸润至中央的生发中心样结构。稍弥漫区细胞形态与结节最外围的淡染区细胞一致。
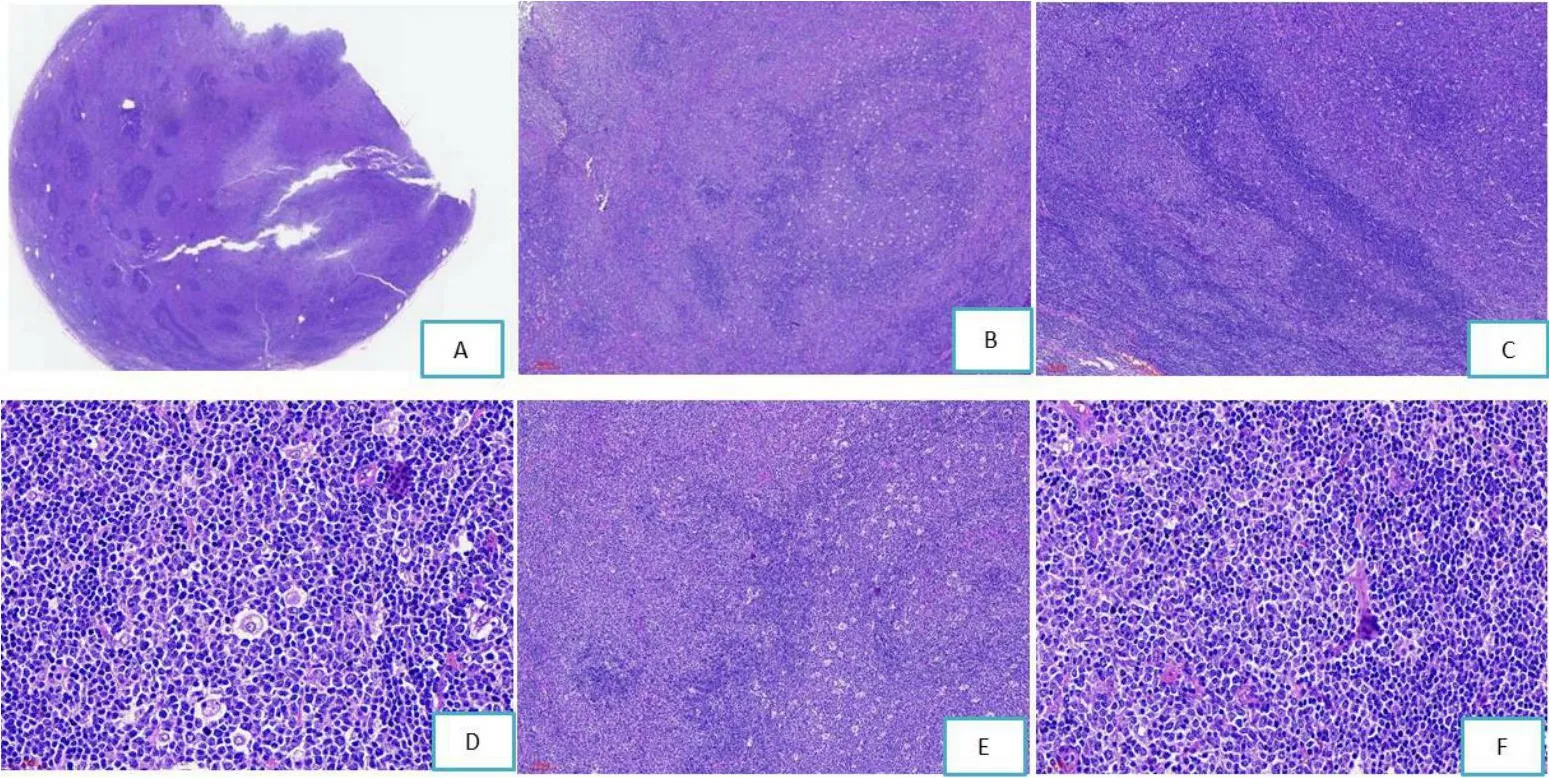
图1 HE组织形态学
2.2 免疫组织化学
CD20弥漫阳性(图2A)。结节中央生发中心细胞表达CD10、BCL-6,不表达BCL-2及IgD,Ki-67高表达(约90%),周围套区样细胞表达BCL-2(强表达)及IgD,Ki-67低表达(约1%),最外周淡染区细胞表达CD10、BCL-6、BCL-2(弱表达),不表达IgD,Ki-67高表达(约60%)(图2B-2F)。周围稍弥漫区淡染细胞免疫组化不表达或弱表达CD10、BCL-6、BCL-2,不表达IgD。CD21显示所有结节状结构都位于滤泡树突细胞网内(图2G),部分结节周围淡染细胞位于疏松的树突网结构内,紧密的树突网结构为套区区域(图2H)。部分套区区域可见不完整的树突网(图2I)。

图2 免疫组织化学
2.3 分子检测
原位杂交结果显示:EBER(-)。
基因重排结果为:外院检测IGH、IGK基因克隆性重排(+)。
FISH结果显示:BCL-2基因未见断裂(图3)。
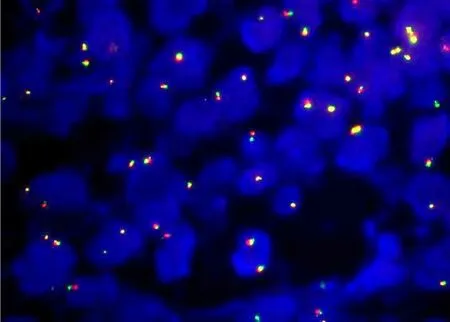
图3 BCL-2基因未见断裂 FISH
3 讨 论
3.1 病理诊断
淋巴结结构的破坏、CD20弥漫分布表达及单克隆基因重排提示,此淋巴结病变为B细胞性淋巴瘤。进一步的免疫组织化学检测表明,结节中央生发中心样结构及周围套区样结构均为正常的非肿瘤性生发中心及套区,分别由中心细胞、中心母细胞及套区细胞组成。最外围环状结构的淡染区域及稍弥漫区域为肿瘤性B淋巴细胞,此种细胞在形态上具有中心细胞及中心母细胞的特征,并表达生发中心标志物且部分位于疏松的滤泡树突细胞网内形成靶环样结构。根据2017年WHO造血淋巴组织肿瘤分类对滤泡性淋巴瘤的定义:FL是由生发中心性B细胞性(由中心细胞及中心母细胞)构成的肿瘤性病变,并且至少具有部分滤泡生长模式[1],本例初步可以诊断为FL。大部分FL病例低倍镜下通过仔细观察形态一般可以与反应性滤泡增生鉴别。在FL病例中,正常淋巴结结构消失或部分消失,大小较一致的淡染结节弥漫增生,排列拥挤,结节间几乎没有组织;因为肿瘤性中心细胞及中心母细胞与结节间小淋巴细胞相比,前者具有更疏松的染色质,因此会出现淡染的结节。在稍微疑难的FL病例中,通过其他特点,如细胞排列明区暗区极性消失,增殖指数降低,套区消失等,也可以与反应性滤泡增生相鉴别。在免疫组织化学检测结果方面,肿瘤性滤泡一般会表达BCL-2蛋白,并且表达生发中心标记物,如CD10、BCL-6等。在基因方面,FL一般有免疫球蛋白轻链及重链重排,以及BCL-2基因异位及融合。
3.2 文献复习
1988年Chan等[2]在Histopathology上首次报道了2例在形态学上与本例相似的病例。文章描述其中1例为淋巴结结构消失,结节状结构,结节中央为深染的密集分布的中心细胞,周围袖套区域为淡染的松散分布的中心母细胞;深染及淡染区域均为肿瘤细胞;另1例具有相似的形态学特征。相关描述及临床病理特征见表1。作者将此种生长模式的淋巴瘤命名为反转型滤泡性淋巴瘤(reverse variant of follicular lymphoma,RVFL)。作者还提示,RVFL并非一种独立的病种,而是FL的一种奇特生长模式。通过在PubMed查询,结果显示,2016年及2020年先后有2篇文章报道了RVFL[3-4],均具有类似的形态学特征(见表1)。在中国知网上通过查询关键字“反转型滤泡性淋巴瘤”,未见有报道。那么,本例能否诊断为RVFL呢?从临床病理特征来看,报道的7例中,年龄在31~62岁之间,中位年龄为50岁,大部分发生在中老年人,全身淋巴结肿大和(或)累及骨髓,而本例为12岁儿童,病灶局限于颈部,为多发小淋巴结。从组织形态学方面看,报道的7例中,6例生长模式基本相同,结节状结构,结节中央为深染的密集分布的中心细胞,周围袖套区域为淡染的松散分布的中心母细胞;深染及淡染区域均为肿瘤细胞(图4A),1例结节中央为深染的中心细胞,紧接着为套区细胞,最外层为淡染的中心母细胞,中心细胞及中心母细胞均为肿瘤细胞(图4B),而本例结节中央为非肿瘤性的生发中心;紧接着为非肿瘤性套区结构,最外面为淡染区域,由肿瘤性中心细胞及中心母细胞组成(图4C)。在分子检测方面,有4例可检测到BCL-2基因断裂,另外3例未见描述,而本例未见BCL-2基因断裂。因此,本例具有RVFL部分特点,但同时也具有本身自有的一些特征,因此可以增加我们对RVFL新的认识。

表1 反转型滤泡性淋巴瘤的临床病理特点
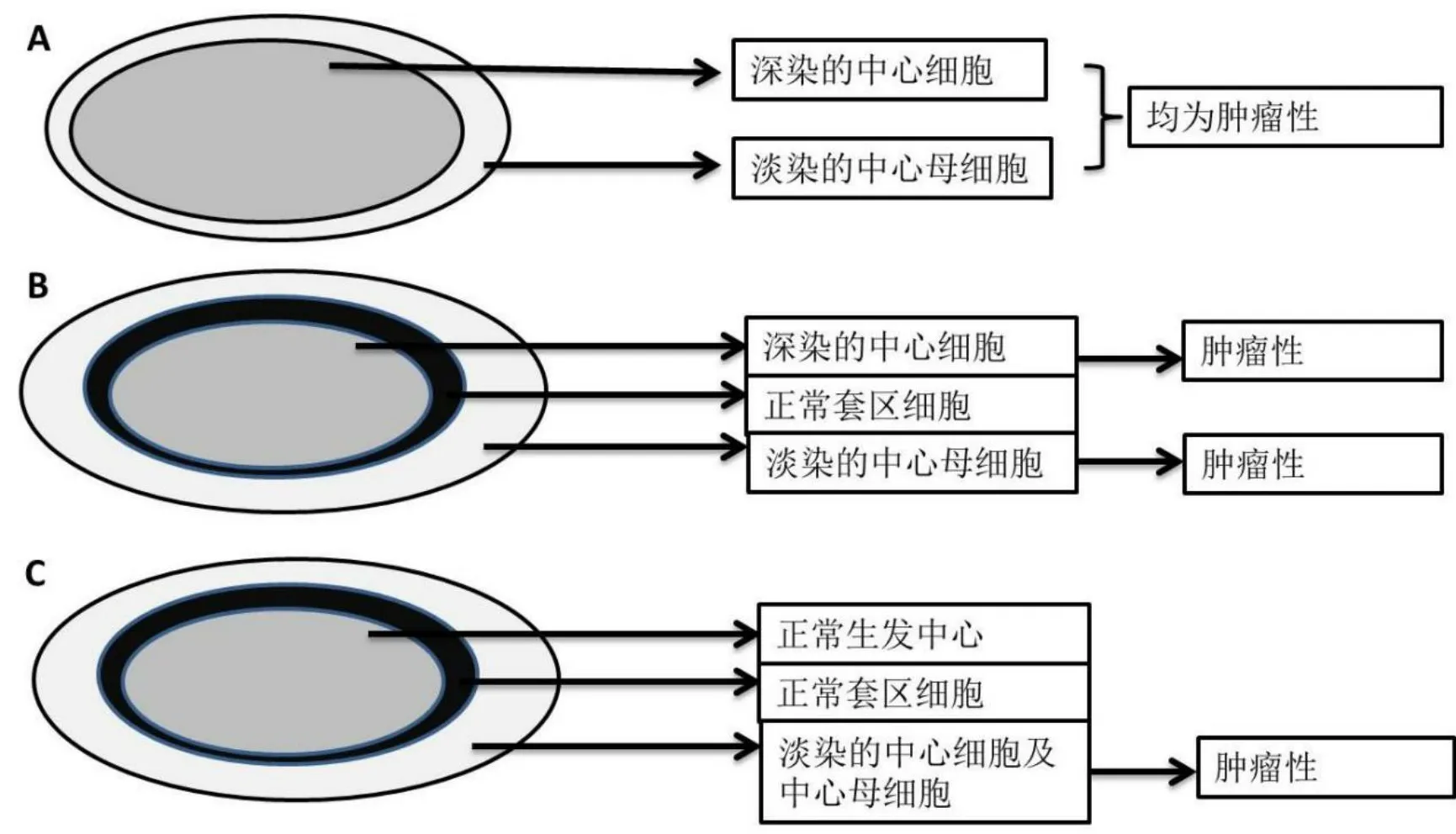
图4 反转型滤泡性淋巴瘤的生长模式图
在FL中,滤泡之间的肿瘤细胞与滤泡内的肿瘤细胞,在免疫组织化学方面可以表现不一致,CD10和BCL-6在滤泡内肿瘤细胞的表达要强于滤泡间的肿瘤细胞,在滤泡间肿瘤细胞甚至不表达[1],这可以解释本例CD10和BCL-6的表达模式。本例生发中心性肿瘤细胞围绕正常淋巴滤泡生长的独特模式,有可能提示,这种肿瘤细胞起源于后生发中心,而起源于后生发中心的FL,BCL-2往往不会发生重排[1]。
3.3 鉴别诊断
3.3.1 儿童滤泡性淋巴瘤 因本例发生于12岁的儿童颈部淋巴结,很容易被误诊为儿童滤泡性淋巴瘤(pediatric-type follicular lymphoma,PTFL)。PTFL有其独特的组织形态学、临床病理特征及基因表现。PTFL滤泡结构是一种膨大的生发中心样结构,多由中心母细胞组成,因此增殖指数较高,不表达或弱表达BCL-2蛋白,没有IG的异常重排[1],且肿瘤细胞只局限于滤泡内,不会扩散到滤泡间区,这些特点均与本例不符。
3.3.2 儿童结内边缘区淋巴瘤 在临床病理特征方面,本例与儿童结内边缘区淋巴瘤有相似之处,如男性儿童,局限于头颈部;组织形态学方面,也有部分类似,如生发中心进行性转化样模糊结节,但儿童结内边缘区淋巴瘤肿瘤细胞不会表达生发中心标志物如CD10和BCL-6。
3.3.3 滤泡性淋巴瘤伴边缘区分化 FL伴边缘区分化与本例在组织学形态学方面,均具有滤泡结节周围袖套样淡染区域,但前者滤泡结节为肿瘤性结节,而本例滤泡结节为正常的生发中心结构,而且FL伴边缘区分化周围淡染区细胞不会表达生发中心标志物。
综上所述,本例与文献中报道的RVFL有部分相似的特征,但又具有自身的一些特点,因此可以增加我们对RVFL新的认识。

