Vero 细胞生长过程中葡萄糖消耗量与细胞数量关系的研究
简伟,刘永连,张瑞,郭林,肖海峰,李国顺
(北京民海生物科技有限公司/北京市新型联合疫苗工程技术研究中心,北京 102600)
贴壁细胞培养的放大方式包括从方瓶或平皿放大至转瓶、多层方瓶或细胞工厂,这些培养方式均为低密度细胞培养,放大能力只能依靠增加培养单元的数量来提高[1-2]。因此,无论是贴壁培养工艺还是悬浮培养工艺,生物反应器工艺是大规模培养细胞和病毒最适合的选择[3]。固定床生物反应器片状载体工艺在病毒性疫苗领域已得到广泛应用,具有剪切力低、换液快、可大规模连续灌流培养等优势[4]。但由于不能实时取样难以对细胞进行消化计数,从而难以准确检测细胞密度、判断细胞生长速度,对于需严格按病毒感染复数(MOI)接毒的病毒培养工艺也造成一定的困扰[5]。本实验建立了一种简单快捷应用于固定床生物反应器(片状载体)的细胞计数方法,为片状载体细胞培养工艺的细胞计数提供参考。
1 材料与方法
1.1 细胞
Vero 细胞142 代,由北京民海生物科技有限公司研发中心保存。
1.2 试剂及耗材
Gibco OptiPRO SFM 培养基、基因重组胰酶,美国Thermo Fisher Scientific 公司;Cedex Bio 配套葡萄糖检测试剂盒,瑞士Hoffmann-La Roche 公司;片状载体,上海楚鲲生物科技有限公司。
75 cm2细胞培养瓶(T75)、225 cm2细胞培养瓶(T225)、2 层细胞工厂(CF2)、10 层细胞工厂(CF10),丹麦Corning 公司。
1.3 设备
MCO-20AIC 型二氧化碳培养箱,日本Panasonic公司;CKX53 型倒置显微镜,日本OLYMPUS 公司;IC1000 型细胞计数仪,上海睿钰生物科技有限公司;Cedex Bio 型生化分析仪,瑞士Hoffmann-La Roche 公司;Cellipower 09-5L 型生物反应器,上海戈洛思生物科技有限公司。
1.4 方法
1.4.1 细胞复苏和传代
(1)复苏。取1 支Vero 细胞(代次142),在(39±1)℃水浴快速化冻后接入T75 细胞培养瓶中,缓慢补加细胞培养液至30 mL,置于37.0 ℃、5% CO2的培养箱内培养3 d。
(2)传代。将1 个T75 按照1 ∶6 的传代比例,传2 个T225,置于37.0 ℃、5% CO2的培养箱内培养3 d,此时的细胞代次为144。取1 个144 代的T225按照1 ∶6 的传代比例,传6 个T225,置于37.0 ℃、5% CO2的培养箱内培养3 d,此时的细胞代次为145。取1 个145 代的T225 按照1 ∶6 的传代比例,传1 个CF2,置于37.0 ℃、5% CO2的培养箱内培养3 d,此时的细胞代次为146。
(3)传代比例控制。取146 代细胞消化后的细胞悬液,按照1 ∶4(7.5×104个/cm2)、1 ∶6(5×104个/cm2)、1 ∶8(3.75×104个/cm2)的接种密度接种至T75 细胞培养瓶,每个密度接种16 瓶,置于5% CO2培养箱内(37±1)℃进行培养。
1.4.2 葡萄糖含量检测及细胞计数
分别于24 h、48 h、72 h、96 h 和120 h 取3 瓶不同传代比例细胞的上清液检测葡萄糖含量,并消化细胞,取20 μL 细胞悬液用细胞计数仪计数,记录培养上清液葡萄糖含量和细胞密度。
1.4.3 统计方法
以培养时间为X 轴,细胞数量为Y 轴,绘制不同传代比例的细胞生长曲线。使用Excel 2010 软件,以葡萄糖累计消耗量为X 轴,以细胞数量为Y 轴作散点图,添加线性趋势线,得到葡萄糖消耗与细胞数量关系方程。
1.4.4 葡萄糖消耗和细胞数量关系在生物反应器上的应用
从反应器中每天取培养上清液,用生化分析仪检测其葡萄糖含量,再结合灌流量、上一次测得的培养上清液的葡萄糖含量,按照公式(1)计算出葡萄糖消耗量,将累计消耗的葡萄糖量代入葡萄糖消耗量与细胞数量关系方程,即可得到反应器内细胞总量。以培养时间为X轴,反应器内细胞总数为Y轴作生长曲线,分析Vero 细胞的生长规律。
其中,M为葡萄糖消耗量,M1为上次取样测得的葡萄糖浓度,M2为灌流培养液葡萄糖浓度,M3为本次取样测得的葡萄糖浓度,V1为生物反应器培养体积,V2为灌流体积。
2 结果与分析
2.1 葡萄糖消耗与细胞数量关系的确定
不同传代比例的细胞生长曲线见图1。从生长曲线上看,3 种传代比例细胞均呈现S 型的生长趋势,延迟期、对数生长期和平台期初期时间基本一致,所选传代比例对细胞生长影响不大。
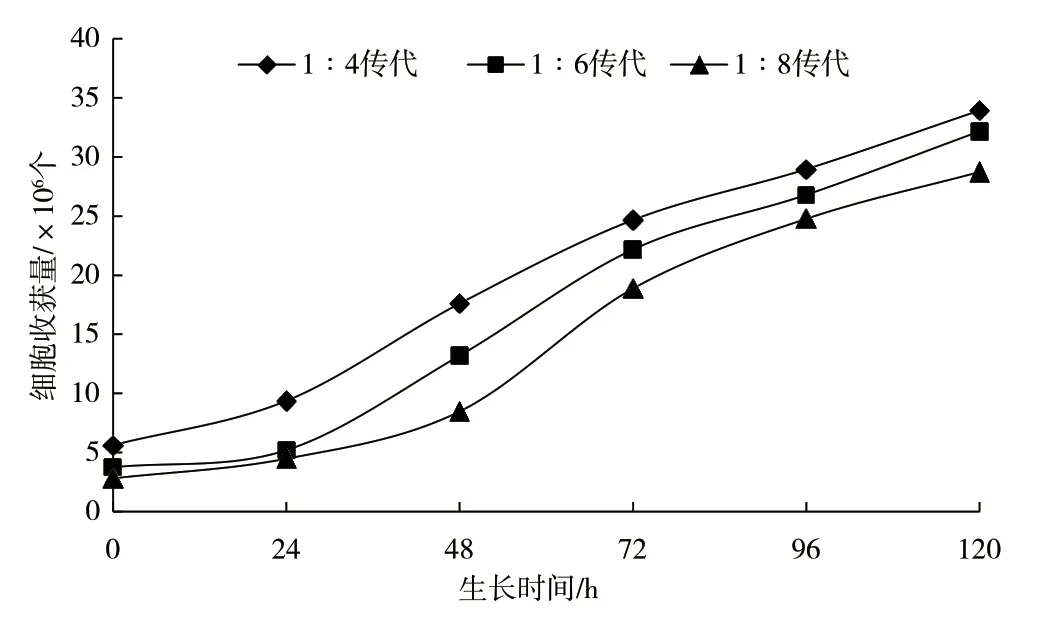
图1 Vero 细胞生长曲线
设置截距为0,1 ∶4、1 ∶6 和1 ∶8 传代比例的葡萄糖消耗量与细胞数量的线性方程分别如图2 所示,R2分别为0.966 1、0.983 3、0.969 1。葡萄糖消耗量与细胞数量基本呈线性关系,且呈现传代比例越小斜率越大的规律;取3 个斜率的平均值4.107×108作为葡萄糖消耗量与细胞数量线性方程的系数,即每消耗1 g 葡萄糖对应的细胞收获量为4.107×108个,与文献[6]报道的每消耗1 g 葡萄糖对应5.345×108个细胞非常接近。
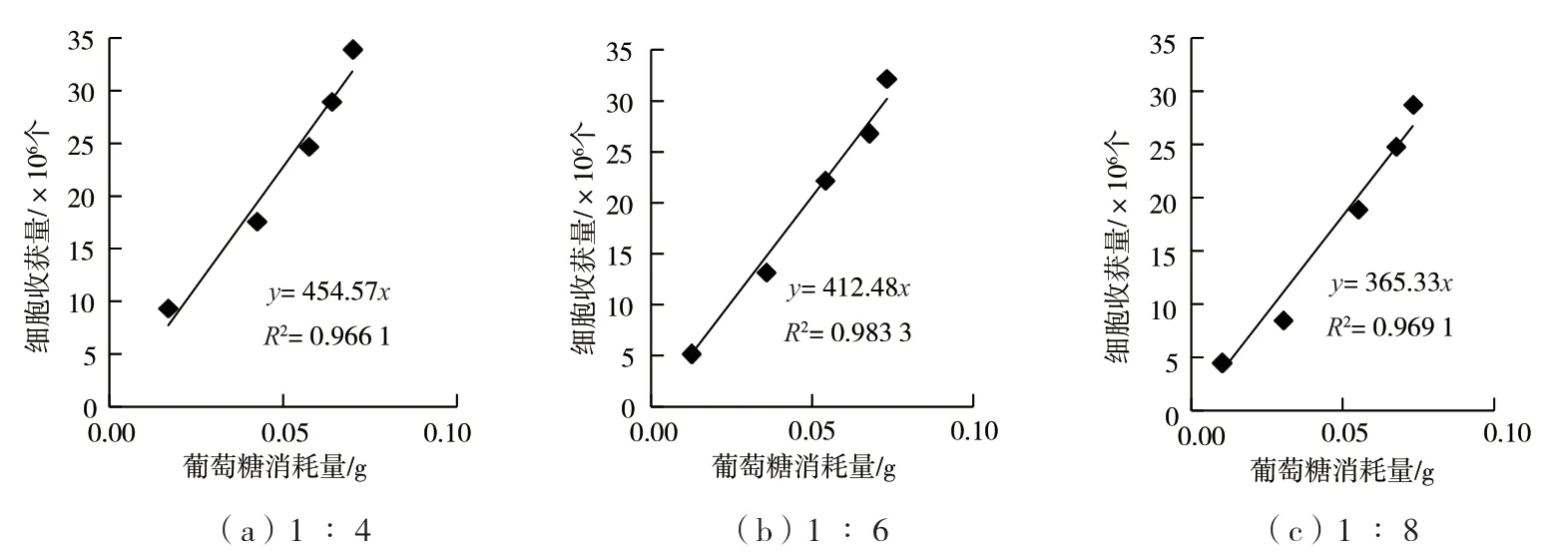
图2 葡萄糖消耗量与细胞数量关系
2.2 葡萄糖消耗量与细胞数量关系在反应器上的应用
Vero 细胞进行反应器培养,从图3 所示的生长曲线可以发现,0 ~2 d 细胞生长缓慢,为停滞期;2 ~6 d 细胞进入对数生长期,葡萄糖消耗量不断增加;5 ~6 d 达到最高峰,而后处于平台期。
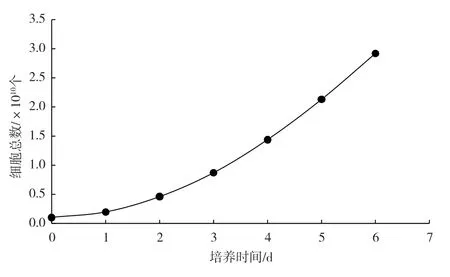
图3 生物反应器内Vero 细胞生长曲线
3 结论与讨论
片状载体和微载体细胞培养是最主流的贴壁细胞培养工艺,而片状载体相对于微载体培养,具有可以得到更高的细胞收获量、灌流速度和换液操作可在很短的时间内完成、不会对细胞造成影响等优点,被广泛应用于病毒疫苗生产领域[7]。如杨屹等[8]应用片状载体生产的Vero 细胞密度高达1.0×107个/mL,收获的病毒液毒力达7.5×106~3.4×108FFU/mL;刘岩松等[9]使用篮式生物反应器制备森林脑炎灭活疫苗(Vero 细胞),获得细胞密度1.04×107个/mL,病毒收获液平均滴度8.4 lg LD50/mL。
但片状载体工艺存在无法将载体取出进行计数的缺点[7],对于片状载体细胞计数方法的文献报道较少。周蕾等[6]使用培养瓶培养的细胞,先建立Vero细胞浓度与电容的线性关系,然后检测生物反应器内电容,通过电容值和线性方程算出细胞密度。基于此,本文建立了葡萄糖消耗量与Vero 细胞数量的计算方法,即每消耗1 g 葡萄糖对应的细胞数量为4.107×108个,在Cellipower 09-5L 反应器内细胞生长6 d 累计消耗葡萄糖71.28 g,所获得细胞数量为2.93×1010个,为生物反应器片状载体细胞培养工艺细胞计数提供了一种方法。

