PAN 微塑料胁迫下胞外聚合物对小球藻生长及光合特性的影响
苏芳,苏明德
(1.近海流域缓解测控治理福建省高校重点实验室,福建福清 350300;2.福建技术师范学院 海洋学院,福建福清 350300;3.宸鸿科技(厦门)有限公司,福建厦门 361000)
近年来,微塑料污染作为一种新兴有机污染物备受环保领域研究者的关注[1]。微藻作为水体中的初级生产者,是食物链的基础环节,对水体的生产力与自净能力有很大的影响,是重要的水体污染的指示生物[2]。目前研究主要集中在微塑料对微藻的毒性效应方面[3],关于微藻响应微塑料胁迫过程中的自我保护机制的研究较少。已有的报道称藻细胞能通过藻-微塑料的异聚集作用来抵御胁迫,恢复种群生长[4]。这提示,在微藻的细胞外有能与微塑料结合的物质或者位点。
细胞外聚合物(EPS)是微生物和藻类分泌的复杂高分子聚合物,主要由蛋白质和多糖组成,具有羧基、磷酸基、羟基、硫酸盐、氨基和疏水链等多种官能团[5],是污染物接触细胞的第一道屏障,能在一定程度上抑制重金属、纳米金属颗粒等常规污染物的毒性效应[5]。但在微塑料的胁迫下,EPS 是否能参与藻类的抗逆境胁迫,以及它是如何起抗逆境的作用机制还不明确,亟待开展相应的研究。本实验通过研究微塑料胁迫下,EPS 有无对藻类的生长及光合生理的影响来探寻藻类的抗逆生理机制,可为藻类的胞外聚合物的抗逆境胁迫、抵御污染机制研究提供一定参考。
1 材料与方法
1.1 材料与仪器
DM500 型三目生物显微镜,德国徕卡公司;UV-2600 型紫外分光光度计,岛津仪器(苏州)有限公司;TGL-16M 型台式高速冷冻离心机,湖南湘仪离心机仪器有限公司;HANDYPEA 型植物效率分析仪,英国汉莎科学仪器有限公司。
培养基和色素提取所用试剂均为分析纯,除VB1、VB12购自福晨(天津)化学试剂有限公司外,其余试剂均购自国药集团化学试剂有限公司。海水小球藻(Chlorella vulgaris)由福建技术师范学院近海流域环境测控治理福建省高校重点实验室微藻库提供。聚丙烯腈聚合物微塑料(PAN-MPS),粒径为0.05 ~0.20 μm,由福建师范大学聚合物资源绿色循环利用教育部工程研究中心提供。
1.2 试验方法
1.2.1 培养条件
使用L1 培养基培养小球藻,温度(25±0.5)℃,光照强度为4 000 lx,光暗比为12 h ∶12 h[6]。
1.2.2 试验设计
(1)EPS 去除组。采用高速离心法提取小球藻的EPS。将培养至指数生长后期藻液,在4 ℃、4 000 r/min条件下离心15 min 后取出,弃上清液后用0.6% NaCl重悬,再在4 ℃、10 000 r/min下离心15 min后弃上清液,剩余藻细胞即为无胞外聚合物的藻细胞(EPS-F)。
(2)EPS 保留组。取同批次藻细胞在4 ℃、4 000 r/min 条件下离心10 min 后弃上清液,获得的藻细胞即为EPS 保留的藻细胞(EPS-C)。
(3)微塑料胁迫处理。分别向EPS-F 组和EPS-C 组的各培养瓶中添加PAN-MPS 储备液,使得体系中PAN-MPS 的最终浓度为0 mg/L、50 mg/L、100 mg/L、500 mg/L,每个处理3 个重复,共24 个培养瓶,起始藻细胞密度约为3.0×106cell/mL。
1.2.3 测定方法
(1)采用血球计数板显微计数法测定生物量。
(2)每天定时取样后3 800 r/min 离心10 min 弃上清,加入5 mL 的乙醇溶液重悬,置于冰箱4 ℃过夜后3 800 r/min 离心5 min 获得色素提取液,随后使用分光光度法测定在470 nm、666 nm 和653 nm 处的吸光值。利用公式(1)~(3)计算出叶绿素和类胡萝卜素的含量[7-8]。
式中,Ca、Cb和Cl分别表示叶绿素a、叶绿素b和总类胡萝卜素含量,mg/L;A666、A653、A470分别表示色素提取液在666 nm 、653 nm 和 470 nm 处的吸光度值。
(3)每天定时取样,暗适应20 min 后,根据ZHANG 等[9]的方法用植物效率分析仪测定样品叶绿素荧光参数。
1.2.4 数据处理
采用Excel 2021 软件对数据进行统计处理,结果用平均值±标准差表示;通过软件SPSS 26.0 进行数据的差异显著性分析,使用Origin 2021 软件作图。
2 结果与分析
2.1 不同浓度PAN-MPS 对小球藻种群生长的影响
由图1 可知,PAN-MPS 的添加,显著抑制了小球藻的生长,且抑制效果随着微塑料暴露浓度的增加而加强。对比EPS-C 和EPS-F 小球藻的生长表现,发现由于EPS 的缺失,EPS-F 组的球藻细胞少了抵御缓解微塑料的污染侵害的第一道防线,受到微塑料的毒害更加严重,不仅细胞总量低于EPS-C 组,且指数期也比EPS-C 组晚。

图1 不同浓度PAN-MPS 胁迫下EPS-C 和EPS-F 小球藻种群数量增长曲线
2.2 不同浓度PAN-MPS 胁迫对小球藻光合色素含量的影响
图2 是不同浓度PAN-MPS 胁迫下,EPS-C 和EPS-F 小球藻光合色素含量变化情况。(1)EPS-C 组,在PAN-MPS 暴露的前48 h,各实验组光合色素的含量显著上升,最大值出现50 mg/L PAN-MPS 添加组。(2)EPS-F 组,PAN-MPS 添加后,整个实验周期中光合色素的积累均受到抑制,最小值出现在500 mg/L PAN-MPS 添加组。(3)对比EPS-C 和EPS-F 组的数据,可以发现去除EPS 后,藻细胞中的叶绿素a 和总类胡萝卜素的含量均显著下降,但叶绿素b 的含量在实验后期有显著提升。此外,所有处理组的叶绿素a 和总类胡萝卜素含量的组间差异随培养时间的增加而缩小。
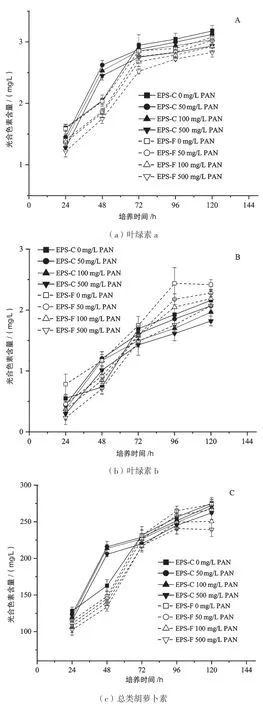
图2 不同浓度PAN-MPS 胁迫下EPS-C 和EPS-F 小球藻的光合色素含量变化
2.3 不同浓度PAN-MPS 胁迫对小球藻叶绿素荧光参数的影响
由图3 可以看出,不同浓度PAN-MPS 胁迫后,小球藻的PSII 潜在活性(Fv/Fo)以及最大光量子效率(Fv/Fm)有着不同程度的变化。(1)EPS-C 组,随着PAN-MPS 浓度的增加,Fv/Fo 和Fv/Fm 大体呈下降趋势,且差异随着培养时间的增加而逐渐显著。(2)EPS-F 组,Fv/Fo 和Fv/Fm 的变化趋势与EPS-C组基本一致,但从数值上来看,EPS-F 组的Fv/Fo 和Fv/Fm 值显著高于EPS-C 组。同时随着培养时间的增加,EPS-F 组的叶绿素荧光参数值均有不同程度的提升,说明小球藻在通过调节光合作用相关活性来对抗微塑料的胁迫。

图3 不同浓度PAN-MPS 胁迫下EPS-C 和EPS-F 小球藻的叶绿素荧光参数变化
3 结论
聚丙烯腈微塑料(PAN-MPS)会抑制小球藻的生长,且存在浓度依赖效应。对比EPS-C 和EPS-F的各个实验组小球藻的光合色素含量,EPS-F 的藻细胞中光合色素含量下降更为明显。在PAN-MPS 胁迫下,小球藻的Fv/Fm 和Fv/Fo 不管EPS 存在与否都会被抑制,但是EPS-F 组的Fv/Fo 和Fv/Fm 值显著高于EPS-C 组。

