CUMS 抑郁小鼠模型海马氧化损伤的研究及大黄酚的保护作用
蔡依琳,朱乐玫,陈彬,李千喜,陈光领
(长沙医学院,湖南长沙 410200)
抑郁症是最常见的精神障碍疾病之一,对患者的身心健康具有严重影响,全球约有三亿人受到抑郁症的困扰且发病率逐年上升[1]。抑郁症具有高患病率、高复发率和高致残率的特点,对患者家庭及社会带来了沉重的经济和心理负担[2]。
目前为止,抑郁症以药物治疗为主,尽管进行了充分的药物治疗,仍有约1/3 的患者不能达到临床痊愈的效果。现在市场上代表性的抗抑郁西药种类有限,机制不清晰,且存在复发率较高、副作用大和停药易复发等缺陷[3]。中药具有资源丰富、疗效准确、副作用较小的优势,因此进一步寻找治疗抑郁症的中药,发挥中药在治疗抑郁方面的独特优势是中国医药事业的一项重任。
大黄酚(Chrysophanol,CHR)是从中药大黄、何首乌和虎杖中提取出来的具有多方面生物治疗潜力的蒽醌类有效单体[4],国内外许多研究表明其具有显著的抗肿瘤、抗氧化、抗炎、神经保护及改善学习认知功能障碍的作用[5]。特别是大黄酚的神经系统保护作用在近年来备受关注,既往研究表明,大黄酚通过抗氧化、抑制胆碱酯酶活性、提升抗氧化酶活性[6-7]、抑制神经元凋亡[8]等作用保护神经及改善学习记忆障碍。但是,大黄酚对由慢性不可预见性温和应激(Chronic Unpredictable Mild Stress,CUMS)诱导抑郁症状的小鼠是否具有行为学的改善作用和有神经保护功能以及其具体的分子机制,目前尚未见报道。基于此,本研究用CUMS 法来建立小鼠的抑郁模型,探讨大黄酚对抑郁症行为学改善作用及其作用机制。
1 材料与方法
1.1 仪器与试剂
H2050R 高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;EL104 万分之一电子天平,梅特勒-托利多仪器有限公司;ELx800 全自动酶标仪,美国BioTek公司;3-30K 微量高速离心机,德国Sigma 公司。
大黄酚(纯度>98%,批号:AF21022853),成都埃法生物科技有限公司;Tween 80、N,N-二甲基甲酰胺(DMF),上海麦克林生化科技有限公司;超氧化物歧化酶(SOD)检测试剂盒、丙二醛(MDA)检测试剂盒,沈阳万类生物科技股份有限公司。
清洁级BALB/c 雄性小鼠(18 ~22 g),购自湖南斯莱克景达实验动物公司,许可证号:SYXK(湘)2019-0004。实验前放置在动物房适应性饲养7 d。
1.2 方法
将小鼠随机分为5组,每组8只,分别为空白组(生理盐水组)、抑郁组(生理盐水)、低剂量组(TD-CHR,大黄酚给药量0.1 mg/kg)、中剂量组(TZ-CHR,大黄酚给药量1.0 mg/kg)和高剂量组(TG-CHR,大黄酚给药量10.0 mg/kg)。
1.2.1 构建CUMS 抑郁模型小鼠
参照文献[9-10]的方法并进行适当的改进,刺激因素:41 ℃热水游泳5 min、4 ℃冰水游泳5 min、夹尾2 min、笼子倾斜45°(8 h)、潮湿环境(12 h)、禁水24 h、禁食24 h、彻夜光照及振荡。除空白组外其余每组每天随机进行1 ~2 种刺激,保证不连续出现同种刺激,连续进行42 d。
每种刺激方法的具体操作如下:(1)热水游泳,将小鼠放入装有41 ℃热水的塑料箱中,水深15 cm;(2)冰水游泳,将小鼠放入装有冰块的4 ℃冰水的塑料箱中,水深15 cm;(3)夹尾,用燕尾夹夹住距小鼠尾根部1 cm 处,每次同时夹四只同组小鼠;(4)笼子倾斜,将鼠笼靠墙以45°放置8 h;(5)潮湿环境,在鼠笼中导入100 mL 清水使垫料湿透,12 h 后再替换干净垫料;(6)禁食,暂停供给饲料24 h;(7)禁水,暂停供水24 h;(8)彻夜光照,将小鼠放置在白炽灯照射的明亮房间中,持续24 h;(9)振荡,将小鼠置于笼中,手动振荡1 min。
1.2.2 动物模型评价指标和方法
(1)小鼠的体质量测量
在CUMS 造模前1 d(第0 天)、开始造模后第21天和第42 天对所有小鼠称量一次体重。
(2)小鼠的糖水偏好测试
测定前1 天对小鼠进行一次糖水训练(每只鼠笼放置1 瓶1%蔗糖水和1 瓶普通自来水,适应24 h)。于实验第1 天、第21 天以及第42 天测定小鼠的糖水偏好度。测试开始先禁食禁水24 h,然后随机在鼠笼放入1 瓶1%的蔗糖水和1 瓶普通饮用水,12 h 后,记录瓶内液体的消耗量,按照公式(1)计算糖水消耗百分比。
式中:V糖和V水分别为1%蔗糖水消耗量和普通饮用水消耗量,mL。
(3)小鼠氧化应激指标的检测
在完成行为学实验后(即第42 天),将小鼠麻醉,取眼眶血后采用脱颈椎法处死小鼠,在冰上剥离全脑,取海马组织,放入EP管中,在-80 ℃冰箱冻存以备取用。检测时称取一定数量海马组织,置于玻璃匀浆器中,加入PBS 缓冲液,制备10%的组织匀浆,取上清液,严格按试剂盒说明书测定小鼠海马MDA 和SOD 水平。
1.2.3 给药方法
所有药物通过腹腔注射,以10 g 体质量给药0.1 mL 每天注射1 次,共42 d。
1.3 统计处理
应用SPSS 25.0 统计软件,计量资料以均值±标准差表示,多组间比较采用完全随机设计的单因素方差分析(one-way ANOVA),采用LSD 法,P<0.05为差异有统计学意义。
3 结果与分析
3.1 大黄酚对CUMS 抑郁模型小鼠行为学的影响
图1(a)显示,给药第21 天抑郁组的体重显著低于空白组(P<0.05),提示慢性不可预计刺激对小鼠的体重有影响;给药第42 天后,抑郁组体重明显低于CHR 剂量组(P<0.05),且CHR 对体重的影响存在剂量依赖性。图1(b)显示,抑郁组小鼠糖水消耗百分比持续降低,与抑郁组相比,在实验第21 天和42 天后空白组和各CHR 剂量组糖水消耗量升高(P<0.05)。

图1 CHR 对CUMS 小鼠行为学的影响(n=8)
应用CUMS 建立小鼠抑郁模型是当前运用最广泛的方法,此方法主要是对动物进行长期轻度应激刺激以模拟人类在生活遇到的压力和打击,导致动物心理上的抑郁[11-12]。本实验通过42 d 一系列的不可预知温和随机刺激建立抑郁动物模型,实验中抑郁组体重增长缓慢,糖水偏好百分比显著下降,表明小鼠心境低落、快感缺失,这些都是抑郁症患者的核心症状之一,提示小鼠抑郁模型建立成功[13-14]。小鼠行为学的评估是评价药物抗抑郁效果的重要指标,适量CHR的治疗可显著改善CUMS 抑郁模型小鼠的抑郁行为,表明CHR 对改善小鼠抑郁行为具有一定作用。
2.2 大黄酚对CUMS 抑郁模型小鼠海马体中MDA及SOD 水平的影响
图2(a)显示,与空白组相比,抑郁组及大黄酚低、中、高剂量组中小鼠海马体中SOD 活力显著降低(P<0.05);与抑郁组相比,大黄酚中、高剂量组小鼠海马体中SOD 活力显著升高(P<0.05)。图2(b)显示,与空白组相比,抑郁组及大黄酚低、中剂量组小鼠海马中MDA 含量显著增加(P<0.05);与抑郁组相比,大黄酚高剂量组小鼠海马中MDA 含量显著降低(P<0.05)。
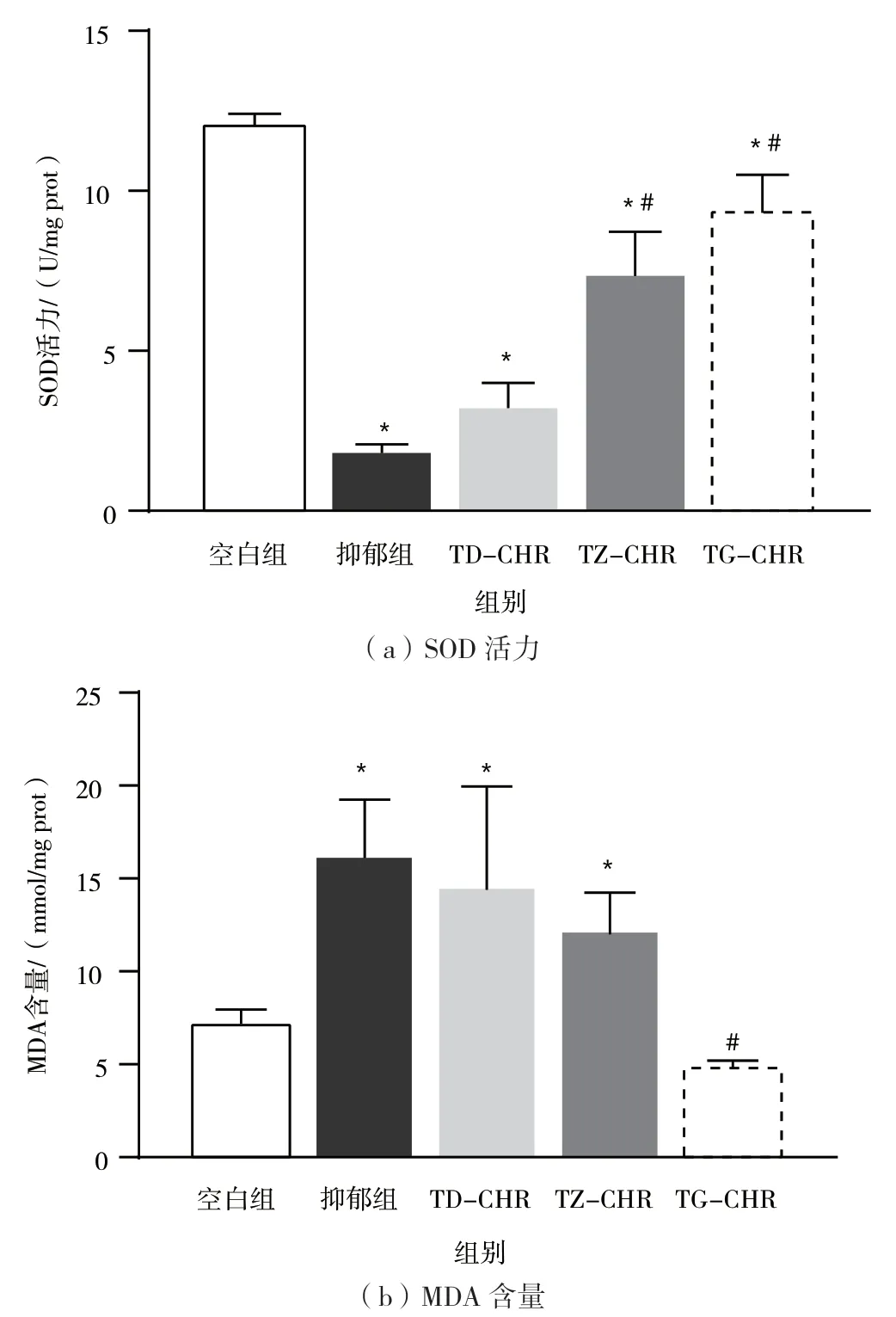
图2 CHR 处理对CUMS 小鼠脑组织SOD 活力和MDA 含量的影响(n=8)
抑郁症的发生与神经系统的氧化应激失衡关系紧密[15]。氧化应激失衡产生的过量氧自由基(Reactive Oxygen Species,ROS)能作用于中枢神经系统,造成神经细胞RNA、DNA 断裂以及脂质的损伤,从而诱导神经细胞凋亡,并影响其信息传递、细胞修复等功能[16-18]。表明抑郁症患者认知功能受损的重要原因之一可能是氧化应激系统的激活。人体内抗氧化酶以超氧化物歧化酶(SOD)为主,其功能受到影响,会造成自由基大量堆积[19]。MDA 是脂质过氧化的重要代谢产物,其能衡量氧化应激的损伤程度[20]。研究表明,当发生氧化应激时,MDA 水平显著升高,SOD水平显著降低[21]。基于此,本实验用小鼠脑中海马体SOD 活力和MDA 含量变化来揭示大黄酚可能的作用机制。实验结果显示,患有抑郁障碍小鼠大脑中的氧化应激系统存在显著的失衡现象。给予大黄酚干预后,大脑组织中SOD 活力升高、MDA 水平降低,表明大黄酚能有效改善小鼠氧化应激系统,有助于小鼠认知功能恢复。
3 结论
综上,大黄酚能改善CUMS模型小鼠的抑郁行为,其机制可能与改善小鼠海马体的氧化应激系统平衡状态有关。

