腺苷A2A 受体参与脂类代谢的研究进展
李佳纹,王琰
(武汉大学 生命科学学院 细胞稳态湖北省重点实验室,湖北武汉 430072)
腺苷(adenosine)是一种内源性嘌呤核苷,已被证明参与调节免疫反应、脂解、血管舒张等生理功能[1-3],这些功能由细胞膜上的特定腺苷受体介导。目前已成功克隆出4 种腺苷受体(Adenosine Receptor,AR),分别为A1、A2A、A2B、A3腺苷的受体(A1R、A2AR、A2BR、A3R)。其中A2AR 在巨噬细胞、肝脏、棕色脂肪等脂质代谢相关组织中高表达,并参与巨噬细胞胆固醇外排、炎症反应以及脂肪组织能量代谢[4-7],有望成为预防和治疗脂代谢相关疾病的有效靶点。本文主要综述了A2AR 对机体脂类代谢的调节功能及其作用机制的研究进展。
1 A2AR 及其下游信号转导通路简述
1.1 腺苷的产生及其代谢途径
细胞外腺苷的来源主要有2 个途径:在细胞内合成,经核苷转运蛋白运输到胞外;由细胞释放出的腺嘌呤核苷酸在胞外空间发生水解生成。(1)胞内腺苷的合成也有2 条途径:通过胞质5’-核苷酸水解酶的活性由三磷酸腺苷(Adenosine Triphosphate,ATP)、二磷酸腺苷(Adenosine Diphosphate,ADP)和单磷酸腺苷(Adenosine Monophosphate,AMP)水解生成;通过s-腺苷同型半胱氨酸水解酶将s-腺苷同型半胱氨酸(S-Adenosyl-Homocysteine,SAH)水解生成腺苷[8]。(2)胞外生成途径主要为,生理或者病理条件刺激下组织释放出ADP 或ATP,ATP 被CD39 水解为ADP 和AMP[9],AMP 再通过CD73 进一步水解生成腺苷[10]。CD39 和CD73 为定位于细胞膜外表面的水解酶[11],在不同的组织中对调节胞外腺苷水平发挥重要作用。
腺苷的分解途径主要是被细胞膜上的腺苷转运蛋白ENT(Equilibrative Nucleoside Transporters,ENT)或CNT(Concentrative Nucleoside Transporters,CNT)摄取入胞内后,经腺苷脱氨酶(Adenosine Deaminase,ADA)迅速代谢为肌苷,或被腺苷激酶转化为AMP[12-14]。细胞外腺苷也可被胞外的ADA 代谢为肌苷,从而调节胞外腺苷的水平[15](图1)。
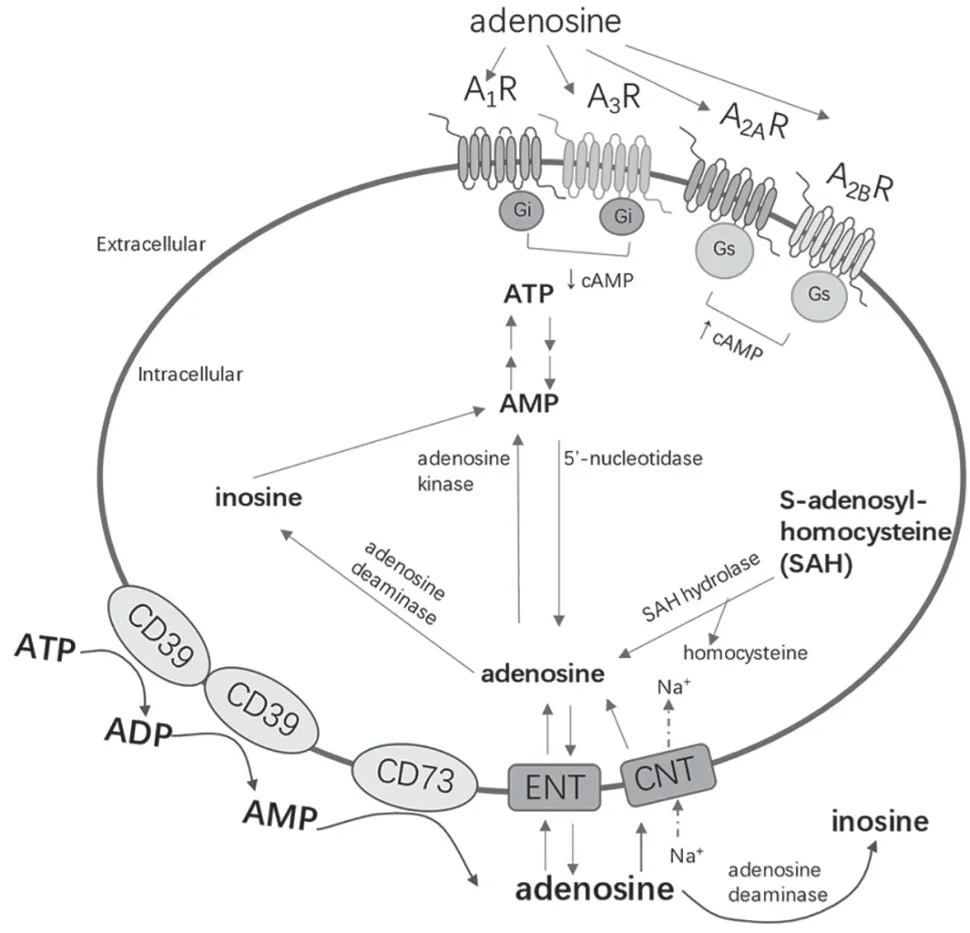
图1 腺苷的代谢途径及四种腺苷受体示意图
1.2 腺苷受体家族及其下游信号转导通路
细胞外空间中的腺苷通过与腺苷受体结合,改变受体的构象进而激活受体下游耦联的G 蛋白及其下游信号转导通路从而发挥生理功能。腺苷受体家族目前主要有4 种受体(A1R、A2AR、A2BR、A3R)[16-17],定位于细胞膜表面响应胞外的腺苷分子的刺激。其中A1R、A2AR 和A3R 是高亲和性受体,与腺苷的亲和力较高;A2BR 为低亲和性受体,需要较高的腺苷浓度才能激活[18]。A1R 和A3R 与G 蛋白亚型Gi和Go耦联,抑制腺苷酸环化酶的活性,降低胞内环磷酸腺苷(cyclic Adenosine Monophosphate,cAMP)浓度;A2AR 和A2BR 则通过与激活型G 蛋白Gs耦联,激活腺苷酸环化酶,从而增加cAMP 的浓度并激活下游蛋白激酶A(Protein Kinase A,PKA)[19]。
2 A2AR 参与脂类代谢的研究进展
A2AR 主要在肝脏、心脏、肺、棕色脂肪组织(Brown Adipose Tissue,BAT)、免疫系统(脾、胸腺、免疫细胞和血小板)及中枢神经系统中表达[20]。在巨噬细胞与棕色脂肪组织中,A2AR 响应外环境中的腺苷及腺苷衍生物的刺激,调控巨噬细胞胞内胆固醇外排与棕色脂肪组织的脂解与能量代谢。在NPC1 病理状态下A2AR 可能参与细胞内胆固醇的转运,从而改善胆固醇在溶酶体的异常积累。
2.1 A2AR 参与巨噬细胞中胆固醇外排与泡沫细胞形成
巨噬细胞胞内脂类堆积促使其转变为泡沫细胞(foam cell),泡沫细胞在内膜空间的积聚导致动脉粥样硬化早期病变的发展[21-23]。因此,降低巨噬细胞中的脂质含量可以减缓动脉粥样硬化的进展。研究表明A2AR 的激活可以促进体外培养的巨噬细胞胆固醇转运相关蛋白ABCA1、ABCG1、CYP27A1 的表达,进而促进胞内胆固醇的外排、抑制泡沫细胞的形成。研究者采用免疫复合物(Immune Complex, IC)/干扰素-γ(Interferon-γ,IFN-γ)与乙酰化低密度脂蛋白诱导人巨噬细胞系THP-1 转化为泡沫细胞,进一步用A2AR 特异性激动剂CGS21680 处理使泡沫细胞的产生率显著下降[24]。CGS21680 的处理显著抑制野生型小鼠中分离的腹膜巨噬细胞转变为泡沫细胞,并且该作用可被A2AR 特异性拮抗剂ZM-241385 抑制;CGS21680 处理A2AR 敲除小鼠中分离的巨噬细胞无法降低泡沫细胞的形成。这些结果表明A2AR 的特异性激活可减少泡沫细胞的产生。
参与巨噬细胞胆固醇稳态调控的重要基因有3个。(1)ABCA1 为ABC 转运蛋白家族成员,介导巨噬细胞胞内胆固醇与磷脂外排到不含脂的载脂蛋白A Ⅰ(Apolipoprotein A I,ApoA-I)[25-26]。(2)ABCG1也属于ABC 转运蛋白,其参与调节细胞内胆固醇及其他氧化甾醇与磷脂外排至成熟高密度脂蛋白(High Density Lipoprotein,HDL)、低密度脂蛋白(Low Density Lipoprotein,LDL)、磷脂囊泡等受体[27-29]。(3)CYP27A1编码胆固醇27 羟化酶,催化胆固醇代谢为极性更强的27-羟基胆固醇或3-羟基-5-胆甾烯酸,因此使其更容易被排出细胞[30]。其催化产物27-羟胆固醇可作为肝X 受体的配体,调节脂质代谢相关基因的转录[31]。A2AR 选择性激动剂CGS21680、ATL313与MRE-0094 显著增加THP-1 细胞与鼠原代巨噬细胞ABCA1、ABCG1 与CYP27A1 的mRNA 与蛋白水平,并且拮抗剂ZM-241385 的处理阻断了CGS21680对胆固醇反向转运蛋白表达的升高作用[24,32-33]。在THP-1 细胞中用siRNA 敲低ABCA1 或CYP27A1 后,CGS21680 处理不能抑制泡沫细胞形成且不能增加H3标记的胆固醇外排[32,34]。PKA 抑制剂KT5720 处理几乎完全抑制了CGS21680 诱导的ABCA1 与CYP27A1表达量的增加[24],而cAMP 激活的交换蛋白分子(Exchange protein activated by cAMP,Epac)或PKA的激活减少了泡沫细胞的形成,并且该作用依赖于ABCA1[32]。这些结果表明在巨噬细胞中A2AR 的激活通过cAMP-PKA 通路上调了下游的胆固醇外排相关靶基因ABCA1 与CYP27A1 的表达,增强巨噬细胞中的胆固醇外排,从而抑制巨噬细胞转化为泡沫细胞(图2)。
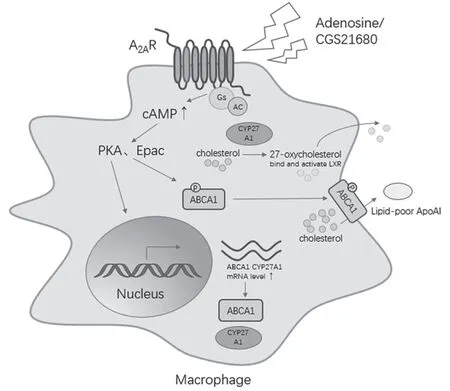
图2 A2AR 在巨噬细胞胆固醇外排中发挥的功能
此外,A2AR 的激活也可以通过减少氧化低密度脂蛋白(oxidized Low Density Lipoprotein,ox-LDL)的摄取来抑制泡沫细胞的形成。在THP-1 细胞中的结果表明,巨噬细胞A2AR 的激活可能通过减少清道夫受体CD36 mRNA 与蛋白水平进而抑制ox-LDL 摄取[33],但A2AR 的激活具体如何调控CD36 表达还需要进一步探究。
然而,以上研究都是在体外培养的巨噬细胞中进行的,动物体内实验表明,与载脂蛋白E(Apolipoprotein E,ApoE)单敲除鼠相比,ApoE 与A2AR 双敲除鼠虽然表现出显著升高的血浆胆固醇水平,但是其动脉粥样硬化病变更小,表明在小鼠体内,A2AR 的缺失对动脉粥样硬化具有保护作用[35]。这与体外实验中A2AR 激活降低巨噬细胞转变为泡沫细胞的表型相反,表明巨噬细胞中A2AR 在动脉粥样硬化进展中发挥的功能可能较为复杂。因此想要阐明巨噬细胞中的A2AR 在体内动脉粥样硬化进展中发挥的功能,还需要构建A2AR 在巨噬细胞中特异性敲除的动物模型进行进一步探究。
2.2 A2AR 参与细胞内胆固醇转运
如前文所述,在巨噬细胞表面表达的A2AR 通过调节胆固醇的外排参与这些细胞中的胆固醇稳态,A2AR 可能也参与调控细胞内的胆固醇转运。尼曼匹克氏病C 型(Niemann-Pick Disease Type C,NPC)综合征是由NPC1 或NPC2 基因的缺失功能突变导致的。这两种基因的突变都能导致胆固醇转运的缺陷,最终导致未酯化的胆固醇、鞘氨醇、鞘磷脂在多种组织细胞的晚期胞内体/溶酶体区室中积累[36]。脂质在溶酶体中的积累会导致自噬功能缺陷,抑制Ca2+摄取入酸性腔室,最终导致胆固醇、鞘磷脂和鞘糖脂的流出障碍[37-38]。NPC 综合征另一个典型特征是胆固醇在线粒体中的积累,最终导致线粒体失能与氧化应激[39]。研究表明,A2AR 激动剂CGS21680 处理NPC1综合征患者分离的成纤维细胞、以及敲低NPC1 模拟NPC 疾病表型的少突胶质细胞系,能够显著减少胞内胆固醇积累,增加溶酶体中Ca2+含量以及恢复线粒体膜电位,并且这种改善作用特异性依赖于A2AR 的激活[40-41]。这些发现表明A2AR 的激活能够部分缓解由于NPC1 的缺失导致的胆固醇异常积累的表型,该作用可能依赖于A2AR 激活导致的胞内Ca2+浓度的升高,与下游PKA 信号通路的激活[41],但A2AR 调控不同类型细胞胞内胆固醇的转运的具体机制仍需进一步探究。
2.3 A2AR 参与肝脏中脂质代谢调控
肝脏是人体重要的脂质代谢器官,已有研究表明肝脏驻留免疫细胞中A2AR 的激活抑制肝脏中炎症反应并在缺血-再灌注损伤、非酒精性脂肪肝炎(Nonalcoholic Steatohepatitis,NASH)中起保护作用[2,42-43]。研究表明与野生型小鼠相比,A2AR 全身敲除小鼠表现出更加显著的蛋氨酸和胆碱缺乏饮食诱导的肝脏脂肪变性与炎症;并且在高脂喂食(High Fat Diet,HFD)条件下,A2AR 髓细胞特异性敲除小鼠同样表现出更严重的肝脏脂肪变性与促炎信号通路激活增强[43]。从A2AR-/-鼠分离的骨髓来源巨噬细胞表现出激活的促炎信号通路与增强的炎症相关细胞因子的分泌[43-44]。共培养实验表明,与A2AR-/-鼠分离的骨髓来源巨噬细胞共培养的野生型原代肝细胞中积累了更多脂肪,并且脂肪酸合成相关基因Acc1、Fas 与Srebp1c 的mRNA 水平显著升高[44]。这些结果表明肝驻留巨噬细胞中的A2AR 可以防止巨噬细胞的促炎激活,进而减少肝细胞中的脂肪沉积和炎症反应。研究发现A2AR 的激活能够降低肝细胞中参与辅助T细胞(helper T cell,Th)募集或极化的细胞因子和趋化因子(CXCL10、CCL2 与IL-12 等)的产生,并减少Th17、Th22 和Th1 细胞的增殖,从而抑制小鼠NASH的进展[45]。这些研究表明A2AR 的激活可能是通过抑制巨噬细胞、T 细胞等免疫细胞介导的炎症反应从而改善肝脏脂肪变性。
除了调控免疫细胞中的炎症反应从而间接影响肝细胞脂质代谢,肝细胞中的A2AR 也可以直接发挥作用。蛋白质组学研究发现肝细胞A2AR 的激活通过上调糖酵解、脂肪酸β-氧化等通路相关酶保护肝脏免受缺血再灌注的损伤,表明A2AR 的激活可以调控肝脏中脂肪酸代谢相关酶的表达[46];咖啡因(caffeine)是腺苷受体的非选择性拮抗剂[18],研究表明咖啡因通过抑制A2AR-cAMP-PKA 通路上调了小鼠肝脏中胆固醇合成相关基因的表达与肝脏中胆固醇水平[47],但无法证明该作用只是通过抑制A2AR 产生的。因此肝细胞中A2AR 在调控肝脏脂质代谢中的作用需要深入探究。
2.4 A2AR 参与脂肪组织产热调控与能量代谢
棕色脂肪组织是介导非颤抖型产热的关键组织,它能够通过解耦联蛋白(Uncoupling Protein 1,UCP1)介导的解耦联呼吸增加脂肪酸氧化与产热[48]。在冷刺激的作用下,BAT 被交感神经系统激活,通过促进脂解以及激活产热相关基因转录促进产热[49]。白色脂肪组织(White Adipose Tissue,WAT)在冷刺激或β-肾上腺素受体激动剂处理的条件下可触发UCP1 阳性、具有与棕色脂肪细胞相似特征的细胞亚群形成,该过程称为白色脂肪的米色化[50]。动物研究表明,增强棕色脂肪的活性或促进白色脂肪组织的米色化能够保护动物免于肥胖和相关的代谢综合征,并且在人群中,BAT 的激活与人的体重指数、脂肪重量、血糖水平呈负相关[51-53]。因此BAT 的激活可作为肥胖等代谢性疾病的重要治疗手段。
研究表明腺苷的注射促使人锁骨上BAT 组织氧化代谢活性增强,表明腺苷与人BAT 组织的激活相关[54]。腺苷在人棕色脂肪细胞系hMADS、人白色脂肪细胞、小鼠棕色脂肪细胞中促进脂解与增加产热标志基因的表达[7]。在人的BAT 组织中,A2AR 是4 种腺苷受体当中表达量最高的,并且A2AR 下游激活Gs信号通路,因此研究者进一步探究腺苷是否通过A2AR发挥促进脂解的作用。A2AR 激动剂CGS21680 处理显著增加了棕色脂肪细胞脂解与产热基因(UCP1、PGC1α、PPARγ、PRDM16、CIDEA、DIO2)表达[7,55]。A2AR 激动剂PDRN 或CGS21680 处理分化的小鼠成熟脂肪细胞3T3L1 显著减少了脂质堆积并增加了棕色化的标志基因Ucp1、Prdm16 与Dio2 的表达,减少了白色化的标志基因Fasn、Fabp4 表达[56]。CGS21680 处理HFD 诱导肥胖模型的小鼠后其体重显著下降并且其BAT中产热基因表达增加、WAT米色化程度增加[7]。这些结果表明A2AR 特异性地激活促进棕色脂肪细胞的脂解与产热基因的表达、促使白色脂肪组织的米色化,并且其激活能够改善饮食诱导的肥胖。
研究者探究A2AR 调控棕色脂肪细胞产热的机制发现,腺苷或CGS21680 处理通过激活AMP 依赖的蛋白激酶(AMP-Activated Protein Kinase,AMPK)磷酸化,上调转录辅激活因子PGC-1α 水平,进而上调产热相关基因的表达[55](图3)。该研究还发现A2AR 的激活通过AMPK-PGC1α 通路促进棕色脂肪细胞中成纤维细胞生长因子-21(Fibroblast Growth Factor-21,FGF21)的表达,进而增加FGF21 在循环中的水平[55]。FGF21 是能量稳态的重要调节因子,可促进葡萄糖利用,改善血糖和血脂,在棕色脂肪中促进产热和脂肪的分解代谢[57-59]。由于肝脏被认为是产生FGF21 的主要器官[60],BAT 中A2AR 的激活如何影响FGF21 在BAT 中的产生与分泌到循环当中还需要进一步探究。研究发现腺苷经腺苷脱氨酶代谢的产物肌苷(inosine)也可以激活棕色脂肪细胞中的A2AR 与A2BR[61],通过激活下游的cAMP-PKA 通路,促进p38 MAPK 的磷酸化,进而导致下游靶蛋白ATF2、Sik2、Crtc3 与Creb1 的激活,促进米色化相关基因的表达与产热[61]。
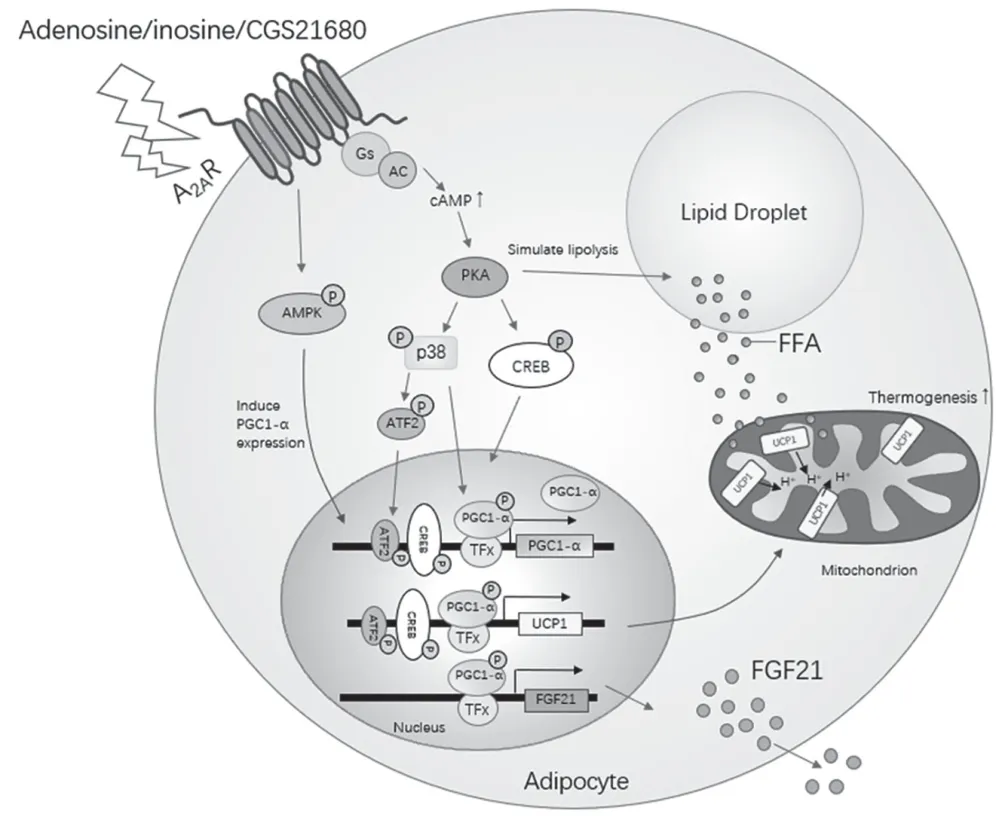
图3 A2AR 在脂肪细胞产热与能量代谢中的功能
3 展望
A2AR 是一种腺苷受体,在不同组织细胞中的A2AR 响应细胞外环境中腺苷或腺苷衍生物的刺激,从而参与巨噬细胞中胆固醇的外排、肝脏脂肪酸合成、棕色脂肪组织的产热等脂类代谢过程。对A2AR 在脂类代谢中作用的探究还有以下问题需要解决。
(1)体内不同腺苷衍生物激活A2AR 的药理学性质的准确测定。体内存在着多种腺苷的衍生物或修饰物,如肌苷、鸟苷、N6-甲基腺嘌呤等[62]。这些衍生物当中有一部分对于A2AR 激活的药理学机制尚未明确,并且其在各种组织中的生理学浓度也尚不清楚。基于质谱的代谢组学的应用能够鉴定出各类腺苷的衍生物,并有望准确测定其在不同组织中的生理水平。过去研究认为肌苷只能够结合并激活A3R[63],然而最新的研究表明肌苷能够直接激活A2AR,并且通过A2AR 与A2BR 促进棕色脂肪细胞的产热[61,64]。因此这些体内存在的腺苷衍生物对A2AR 的药理学激活效应需要仔细探究。
(2)A2AR 与其他腺苷受体在脂质代谢上的协同/拮抗作用。A1R 在白色脂肪组织中高表达,并且能通过Gi/o通路降低cAMP 含量从而抑制脂解[1];而A2AR 的激活能够通过cAMP-PKA 通路促进白色脂肪细胞的脂解[7]。腺苷刺激下A1R 与A2AR 的下游通路是如何协调作用的还需进一步探究。A2AR 在脂肪组织能量代谢中发挥作用可能依赖于A2BR,研究发现A2AR 激动剂CGS21680 增加能量消耗的作用在A2BR敲除鼠中完全被抑制[65]。邻近连接技术发现A2AR 与A2BR 能够在BAT 组织中形成复合体,并且抑制A2AR与A2BR 的互作可以完全抑制腺苷对棕色脂肪细胞脂解的促进作用[65]。因此阐明不同组织中各类腺苷受体的相对表达量与相互作用,以及相互作用对配体药理学性质、受体激活下游信号转导通路的影响对腺苷类似物药物的开发具有重要意义。
综上所述,未来进一步阐明A2AR 激动剂改善脂代谢疾病的作用机制,并开发A2AR 选择性激动剂/拮抗剂作为可能的治疗药物,有望应用于心脑血管疾病、动脉粥样硬化、NPC 综合征以及肥胖等多种脂代谢相关疾病的治疗,为这些疾病提供新的疗法。

