基于Nrf2/HO-1 信号通路探讨山楂叶总黄酮对多囊卵巢综合征大鼠卵巢氧化应激的影响
刘桂宇,谢倩倩,陈希芬,元 丽,康雪敏
(1.河北师范大学职工医院,河北 石家庄 050024;2.河北师范大学生命科学学院,河北 石家庄 050024)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS) 主要以多囊卵巢形态、卵巢功能障碍以及高雄激素血症为主要特征,是导致育龄女性不孕不育的常见代谢紊乱与生殖内分泌性疾病[1-3]。PCOS患者若未能得到及时合理的治疗,会使子宫内膜癌、代谢综合征、心血管疾病及2 型糖尿病的发病几率增加[4-5]。因此,寻找安全有效及更加完善的PCOS 治疗方案,是当前急需解决的难题。山楂具有抗氧化、抗炎、预防动脉粥样硬化、治疗心肌缺血及调节糖脂代谢紊乱等作用[6]。山楂中黄酮类化合物含量丰富,研究发现,山楂叶总黄酮可以使高脂血症大鼠总胆固醇 (total cholesterol,TC)、甘油三酯 (triglyceride,TG) 及低密度脂蛋白(low density lipoprotein,LDL) 水平降低,具有改善脂代谢紊乱作用[7]。山楂叶总黄酮也能够使糖尿病大鼠血糖水平降低,改善脂代谢,同时可以降低血清丙二醛(malondialdehyde,MDA) 水平,升高超氧化物歧化酶 (superoxide dismutase,SOD)及过氧化氢酶(catalase,CAT) 活性,表现出了明显的抗氧化损伤作用[8]。糖脂代谢异常及氧化应激是PCOS 发病的重要机制[9],由此推测山楂叶总黄酮对于PCOS 的预防及治疗具有潜在的应用价值。本研究采用高脂饲料喂食联合灌胃来曲唑法建立大鼠PCOS 模型,并给予不同剂量山楂叶总黄酮干预,探讨山楂叶总黄酮对PCOS 大鼠的保护作用及潜在机制。
1 材料
1.1 动物 健康雌性SD 大鼠70 只,SPF 级,6周龄,具有正常动情周期,体质量180~220 g,由斯贝福(北京) 生物技术有限公司提供[实验动物生产许可证号SCXK (京) 2019-0010]。大鼠饲养于河北中医学院实验动物中心[实验动物使用许可证号SYXK (冀) 2022-010],环境为相对湿度50%~60%,温度22~23 ℃,12 h/12 h 昼夜循环交替,自由饮食及饮水。本实验方案经河北师范大学动物伦理委员会审批 (伦理号2022LLSC023),符合实验动物的3R 原则。
1.2 药物与试剂 山楂叶总黄酮为山楂叶黄酮提取物(黄酮含量90.0%,批号20220125,陕西瑞沃生物科技有限公司);二甲双胍 (规格0.5 g/片,国药准字H20023370,中美上海施贵宝制药有限公司)。来曲唑(规格2.5 mg/片,国药准字H20133109,浙江海正药业股份有限公司);苏木精-伊红(hematoxylin eosin,HE) 染色试剂盒(货号WH2144,上海威奥生物科技有限公司);卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、睾酮(testosterone,T)、抗缪勒管激素 (anti-mullerian hormone,AMH)、雌二醇(estradiol,E2) 检测试剂盒 (货号JEB-13680、JEB-13774、JEB-13693、JEB-13167、JEB-13691,南京金益柏生物科技有限公司);空腹胰岛素(fasting insulin,FINS) 检测试剂盒(货号H203-1-2,南京建成生物工程研究所);SOD、谷胱甘肽过氧化物酶 (glutathione peroxidase,GSH-Px)、MDA 检测试剂盒 (货号ml095208、ml095263、ml094963,上海酶联生物科技有限公司);核因子红细胞系2 相关因子2(nuclear factor erythroid 2 related factor,Nrf2)、血红素氧合酶1 (heme oxygenase 1,HO-1) 多克隆抗体 (货号ab137550、ab13243,英国Abcam 公司);磷酸甘油醛脱氢酶(reduced glyceraldehyde phosphate dehydrogenase,GAPDH) 多克隆抗体、IgG 二抗(货号R1210-1、HA1001,杭州华安生物技术有限公司)。
1.3 仪器 UXF40086 型超低温冰箱 (美国Thermo Fisher Scientific 公司);BSA2202S 型电子天平(德国Sartorius 公司);KC-100 型酶标仪(安徽鸿众医疗器械有限公司);RM2135 型病理组织切片机 (德国Leica 公司);NE930 型光学显微镜(宁波永新光学股份有限公司);血糖试纸条、ACCU-CHEK 型血糖仪(瑞士Roche 公司);BK-200VET 型全自动生化分析仪(济南欧莱博科学仪器有限公司);UV9000 型紫外可见分光光度仪(上海元析仪器有限公司);Mini-PROTEAN Tetra型蛋白电泳及转印系统 (美国Bio-Rad 公司);3200-97001 型凝胶成像仪(上海勤翔科学仪器有限公司)。
2 方法
2.1 造模、分组及给药 大鼠分为空白组(10只) 及造模组(60 只),空白组大鼠饲喂普通饲料,并灌胃 1% 羧甲基纤维素钠 (sodium carboxymethyl cellulose,CMC-Na);造模组大鼠饲喂高脂饲料,并用灌胃1 mg/kg 来曲唑混悬液(1%CMC-Na 配制),共21 d[10]。从第10 天开始行阴道涂片观察,连续10 d,当出现动情周期紊乱、阴道上皮白细胞持续增多时,随机选取5 只大鼠处死后取材,并通过HE 染色检测卵巢组织病理变化以进一步判断PCOS 模型是否成功建立。建模成功的大鼠分为模型组、二甲双胍组(100 mg/kg) 及山楂叶总黄酮低、中、高剂量组(100、200、400 mg/kg),每组10 只。各给药组按上述剂量灌胃,其中山楂叶总黄酮的灌胃剂量参考文献[11] 报道,灌胃体积均为10 mL/kg,每天1 次,持续21 d。给药期间,大鼠动情周期的观察继续以阴道涂片法进行,连续14 d,以评价山楂叶总黄酮对PCOS 大鼠动情周期的影响。
2.2 取材及体质量、子宫质量、卵巢质量测定 末次给药结束后,禁食不禁水12 h,称定体质量。使用10%水合氯醛(300 mg/kg) 麻醉大鼠,腹主动脉取血,分离血清。摘取双角子宫和双侧卵巢,冲洗残留血迹并拭干,称定子宫及卵巢质量,将一侧卵巢固定于多聚甲醛,另一侧保存于-80 ℃冰箱。
2.3 卵巢组织病理变化检测 取固定24 h 的卵巢组织,脱水后进行石蜡包埋,切片(4 μm),行常规HE 染色,观察卵巢病理变化。
2.4 激素水平、糖代谢及脂代谢指标检测 通过血糖仪检测大鼠空腹血糖(fasting blood glucose,FBG),采用酶联免疫吸附法检测FINS 水平,并计算胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR),公式为HOMA-IR=FBG × FINS/22.5。取冻存于-80 ℃冰箱中的血清,解冻后,按照试剂盒说明书,采用酶联免疫吸附法检测血清FSH、LH 活性及T、AMH、E2水平;通过全自动生化分析仪检测血清脂代谢指标LDL、高密度脂蛋白(high density lipoprotein,HDL)、TC及TG 水平。
2.5 卵巢组织氧化应激水平检测 取100 mg 卵巢组织,加入1 mL 预冷的生理盐水,在冰水浴上用组织研磨器充分研磨,3 000 r/min 离心10 min,取上清液,按照试剂盒说明书,通过比色法检测卵巢组织SOD、GSH-Px 活性及MDA 水平。
2.6 卵巢组织Nrf2、HO-1 蛋白表达检测 取100 mg 卵巢组织,加入1 mL 预冷的裂解液,在冰水浴上用组织研磨器充分研磨。离心后取上清液,蛋白定量试剂盒进行定量分析。蛋白样本经SDS-PAGE电泳,湿转法转移至PVDF 膜,用5%牛血清白蛋白室温封闭2 h,TBST 洗膜3 次,分别加入Nrf2、HO-1 (1 ∶1 000)、GAPDH (1 ∶2 500) 一抗,4 ℃冰箱孵育过夜,TBST 洗膜3 次,加入二抗(1 ∶5 000) 室温孵育2 h,TBST 洗膜3 次,ECL显色,曝光,通过Image J 1.8.0 软件分析各条带灰度值。
2.7 统计学分析 通过SPSS 20.0 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,两两比较采用LSD 检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 山楂叶总黄酮对PCOS 大鼠动情周期的影响 SD大鼠一般以4~5 d 为一个动情周期,其中动情前期(proestrus,P) 以有核上皮细胞为主,呈膨大、椭圆形;动情期(estrus,E) 主要为无核角化细胞,且形态不规则;动情后期(metestrus,M) 可见白细胞和有核上皮、角化细胞,且数量相当;间期(diestrus,D) 主要的细胞类型为白细胞,见图1A。经过连续14 d 对动情周期变化的动态监测绘制动情周期折线图,见图1B,发现空白组大鼠有规律的动情周期;模型组大鼠动情周期完全紊乱;二甲双胍组及山楂叶总黄酮各剂量组大鼠动情周期均有逐渐恢复的趋势,表明山楂叶总黄酮对PCOS 大鼠动情周期的紊乱具有改善作用。
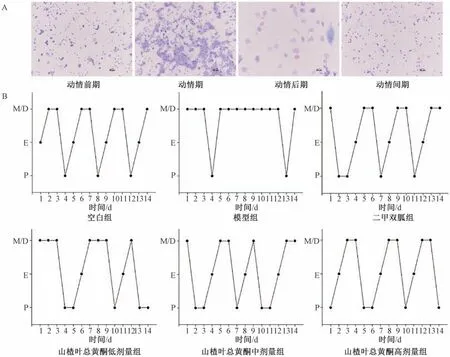
图1 山楂叶总黄酮对PCOS 大鼠动情周期的影响Fig.1 Effects of hawthorn leaves flavonoids on estrous cycle in PCOS rats
3.2 山楂叶总黄酮对PCOS 大鼠体质量、子宫及卵巢质量的影响 如表1 所示,干预前与干预后,模型组大鼠体质量均高于空白组(P<0.01);干预前,与模型组比较,二甲双胍组及山楂叶总黄酮各剂量组大鼠体质量无明显变化(P>0.05);干预后,与模型组比较,二甲双胍组及山楂叶总黄酮中、高剂量组大鼠体质量降低 (P<0.05,P<0.01),山楂叶总黄酮低剂量组大鼠体质量无明显变化(P>0.05)。与空白组比较,模型组大鼠子宫质量降低 (P<0.01),卵巢质量升高 (P<0.01);与模型组比较,二甲双胍组及山楂叶总黄酮各剂量组大鼠子宫质量升高 (P<0.05,P<0.01),卵巢质量降低(P<0.01)。
表1 山楂叶总黄酮对PCOS 大鼠体质量、子宫及卵巢质量的影响(±s,n=10)Tab.1 Effects of hawthorn leaves flavonoids on body weight,uterus and ovary weight in PCOS rats (±s,n=10)
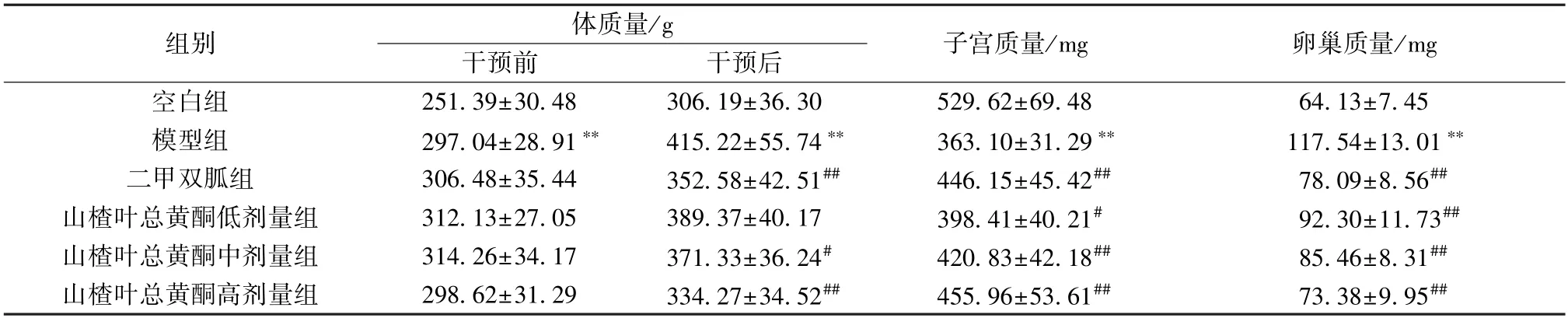
表1 山楂叶总黄酮对PCOS 大鼠体质量、子宫及卵巢质量的影响(±s,n=10)Tab.1 Effects of hawthorn leaves flavonoids on body weight,uterus and ovary weight in PCOS rats (±s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别体质量/g干预前干预后子宫质量/mg卵巢质量/mg空白组251.39±30.48306.19±36.30529.62±69.4864.13±7.45模型组297.04±28.91**415.22±55.74**363.10±31.29**117.54±13.01**二甲双胍组306.48±35.44352.58±42.51##446.15±45.42##78.09±8.56##山楂叶总黄酮低剂量组312.13±27.05389.37±40.17398.41±40.21#92.30±11.73##山楂叶总黄酮中剂量组314.26±34.17371.33±36.24#420.83±42.18##85.46±8.31##山楂叶总黄酮高剂量组298.62±31.29334.27±34.52##455.96±53.61##73.38±9.95##
3.3 山楂叶总黄酮对PCOS 大鼠卵巢组织病理变化的影响 空白组大鼠卵巢组织未发生病理损伤变化,卵母细胞结构清晰,颗粒细胞排列整齐、紧密;模型组大鼠卵巢组织内可见囊性扩张卵泡及闭锁卵泡,颗粒细胞层数减少且排列疏松;二甲双胍组及山楂叶总黄酮各剂量组大鼠囊性扩张卵泡及闭锁卵泡减少,颗粒细胞层数增加且排列较为紧密,其中二甲双胍组及山楂叶总黄酮高剂量组对卵巢病理损伤变化的改善最为明显,见图2。
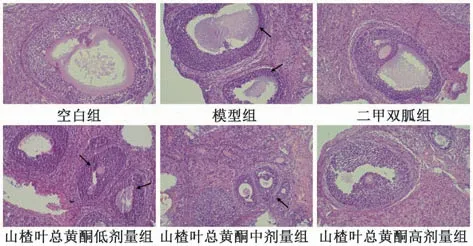
图2 山楂叶总黄酮对PCOS 大鼠卵巢组织病理变化的影响(HE,×200)Fig.2 Effects of hawthorn leaves flavonoids on ovarian pathological changes in PCOS rats (HE,×200)
3.4 山楂叶总黄酮对PCOS 大鼠血清激素水平的影响 如表2 所示,与空白组比较,模型组大鼠血清FSH 活性及E2水平降低(P<0.01),LH 活性及T、AMH 水平升高(P<0.01);与模型组比较,二甲双胍组及山楂叶总黄酮各剂量组大鼠血清FSH活性及E2水平升高(P<0.01),LH 活性及T、AMH 水平降低(P<0.05,P<0.01)。
表2 山楂叶总黄酮对PCOS 大鼠血清激素水平的影响(±s,n=10)Tab.2 Effects of hawthorn leaves flavonoids on serum hormone levels in PCOS rats (±s,n=10)
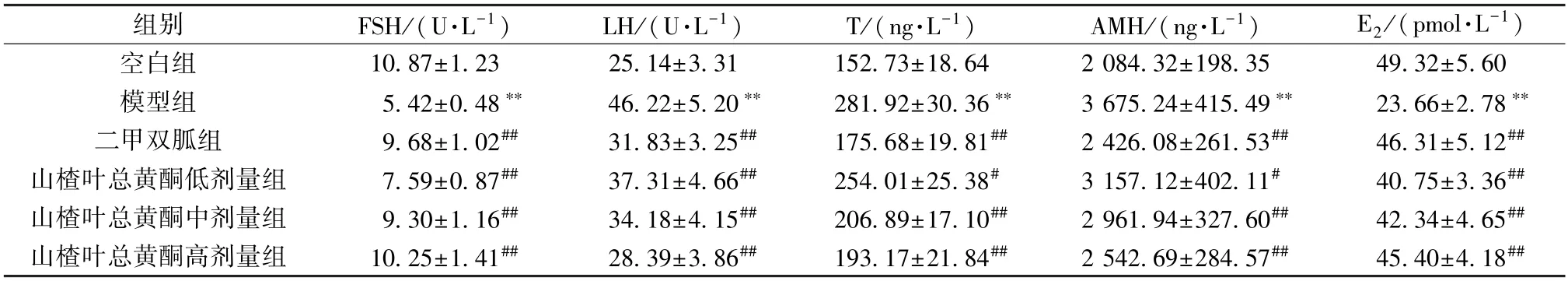
表2 山楂叶总黄酮对PCOS 大鼠血清激素水平的影响(±s,n=10)Tab.2 Effects of hawthorn leaves flavonoids on serum hormone levels in PCOS rats (±s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别FSH/(U·L-1)LH/(U·L-1)T/(ng·L-1)AMH/(ng·L-1)E2/(pmol·L-1)空白组10.87±1.2325.14±3.31152.73±18.642 084.32±198.3549.32±5.60模型组5.42±0.48**46.22±5.20**281.92±30.36**3 675.24±415.49**23.66±2.78**二甲双胍组9.68±1.02##31.83±3.25##175.68±19.81##2 426.08±261.53##46.31±5.12##山楂叶总黄酮低剂量组7.59±0.87##37.31±4.66##254.01±25.38#3 157.12±402.11#40.75±3.36##山楂叶总黄酮中剂量组9.30±1.16##34.18±4.15##206.89±17.10##2 961.94±327.60##42.34±4.65##山楂叶总黄酮高剂量组10.25±1.41##28.39±3.86##193.17±21.84##2 542.69±284.57##45.40±4.18##
3.5 山楂叶总黄酮对PCOS 大鼠糖代谢的影响 如表3 所示,与空白组比较,模型组大鼠FBG、FINS 水平及HOMA-IR 值均升高(P<0.01);与模型组比较,二甲双胍组及山楂叶总黄酮各剂量组大鼠FBG、FINS 水平及HOMA-IR 值均降低 (P<0.05,P<0.01)。
表3 山楂叶总黄酮对PCOS 大鼠糖代谢的影响(±s,n=10)Tab.3 Effects of hawthorn leaves flavonoids on glucose metabolism in PCOS rats (±s,n=10)
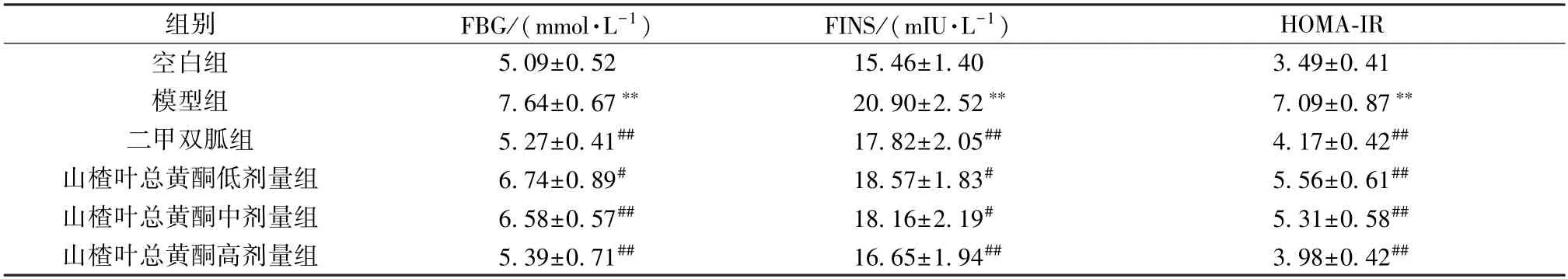
表3 山楂叶总黄酮对PCOS 大鼠糖代谢的影响(±s,n=10)Tab.3 Effects of hawthorn leaves flavonoids on glucose metabolism in PCOS rats (±s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别FBG/(mmol·L-1)FINS/(mIU·L-1)HOMA-IR空白组5.09±0.5215.46±1.403.49±0.41模型组7.64±0.67**20.90±2.52**7.09±0.87**二甲双胍组5.27±0.41##17.82±2.05##4.17±0.42##山楂叶总黄酮低剂量组6.74±0.89#18.57±1.83#5.56±0.61##山楂叶总黄酮中剂量组6.58±0.57##18.16±2.19#5.31±0.58##山楂叶总黄酮高剂量组5.39±0.71##16.65±1.94##3.98±0.42##
3.6 山楂叶总黄酮对PCOS 大鼠脂代谢的影响如表4 所示,与空白组比较,模型组大鼠血清LDL、TC 及TG 水平升高(P<0.01),HDL 水平降低(P<0.05);与模型组比较,二甲双胍组及山楂叶总黄酮各剂量组大鼠血清LDL、TG 水平降低(P<0.05,P<0.01),HDL 水平均无明显变化(P>0.05),山楂叶总黄酮中、高剂量组大鼠血清TC 水平降低(P<0.05,P<0.01)。
表4 山楂叶总黄酮对PCOS 大鼠脂代谢的影响(mmol/L,±s,n=10)Tab.4 Effects of hawthorn leaves flavonoids on lipid metabolism in PCOS rats (mmol/L,±s,n=10)
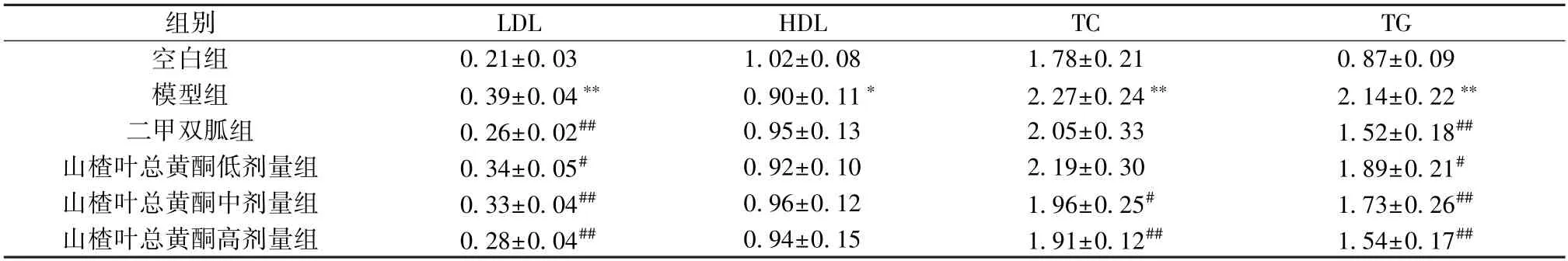
表4 山楂叶总黄酮对PCOS 大鼠脂代谢的影响(mmol/L,±s,n=10)Tab.4 Effects of hawthorn leaves flavonoids on lipid metabolism in PCOS rats (mmol/L,±s,n=10)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别LDLHDLTCTG空白组0.21±0.031.02±0.081.78±0.210.87±0.09模型组0.39±0.04**0.90±0.11*2.27±0.24**2.14±0.22**二甲双胍组0.26±0.02##0.95±0.132.05±0.331.52±0.18##山楂叶总黄酮低剂量组0.34±0.05#0.92±0.102.19±0.301.89±0.21#山楂叶总黄酮中剂量组0.33±0.04##0.96±0.121.96±0.25#1.73±0.26##山楂叶总黄酮高剂量组0.28±0.04##0.94±0.151.91±0.12##1.54±0.17##
3.7 山楂叶总黄酮对PCOS 大鼠卵巢组织氧化应激水平的影响 如表5 所示,与空白组比较,模型组大鼠卵巢组织SOD、GSH-Px 活性降低 (P<0.01),而MDA 水平升高(P<0.01);与模型组比较,二甲双胍组及山楂叶总黄酮各剂量组大鼠卵巢组织SOD、GSH-Px 活性升高 (P<0.01),而MDA 水平降低(P<0.05,P<0.01)。
表5 山楂叶总黄酮对PCOS 大鼠卵巢组织氧化应激的影响(±s,n=10)Tab.5 Effects of hawthorn leaves flavonoids on oxidative stress in ovarian tissue of PCOS rats (±s,n=10)
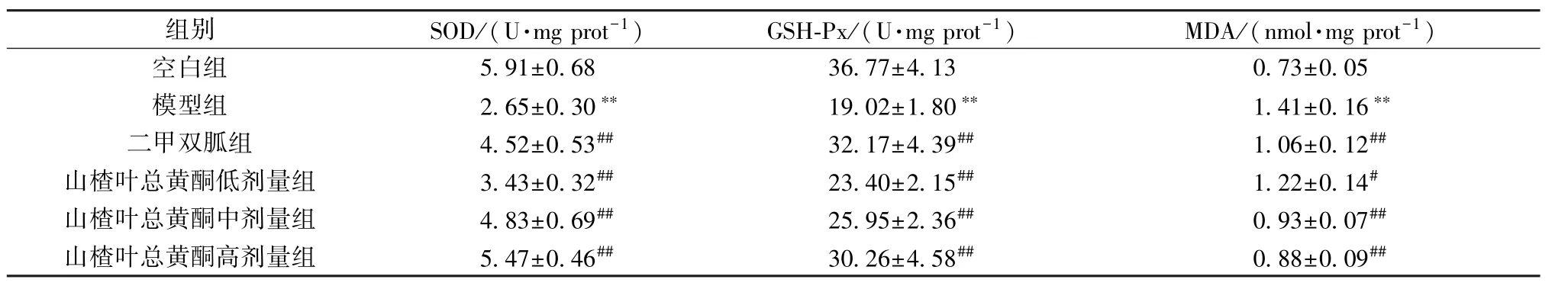
表5 山楂叶总黄酮对PCOS 大鼠卵巢组织氧化应激的影响(±s,n=10)Tab.5 Effects of hawthorn leaves flavonoids on oxidative stress in ovarian tissue of PCOS rats (±s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
?
3.8 山楂叶总黄酮对PCOS 大鼠卵巢组织Nrf2/HO-1 信号通路的影响 如图3、表6 所示,与空白组比较,模型组大鼠卵巢组织Nrf2、HO-1 蛋白表达降低(P<0.01);与模型组比较,二甲双胍组及山楂叶总黄酮各剂量组大鼠卵巢组织Nrf2、HO-1 蛋白表达升高(P<0.05,P<0.01)。
表6 山楂叶总黄酮对PCOS 大鼠卵巢组织Nrf2/HO-1 信号通路的影响(±s,n=3)Tab.6 Effects of hawthorn leaves flavonoids on Nrf2/HO-1 signaling pathway in ovarian tissue of PCOS rats(±s,n=3)
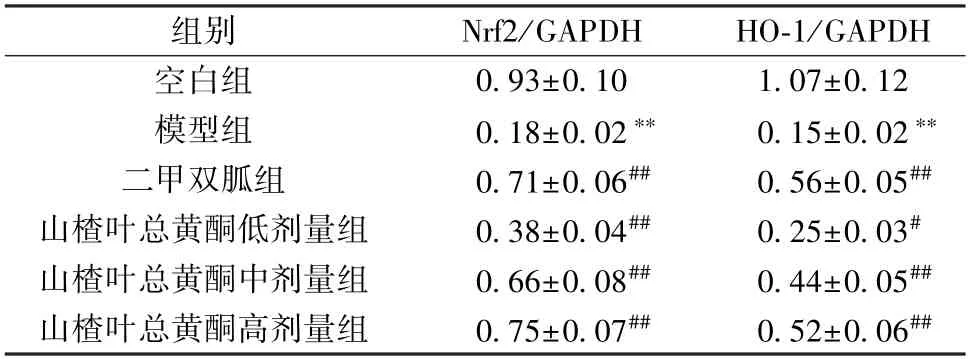
表6 山楂叶总黄酮对PCOS 大鼠卵巢组织Nrf2/HO-1 信号通路的影响(±s,n=3)Tab.6 Effects of hawthorn leaves flavonoids on Nrf2/HO-1 signaling pathway in ovarian tissue of PCOS rats(±s,n=3)
注:与空白组比较,**P <0.01;与模型组比较,#P <0.05,##P<0.01。
组别Nrf2/GAPDHHO-1/GAPDH空白组0.93±0.101.07±0.12模型组0.18±0.02**0.15±0.02**二甲双胍组0.71±0.06##0.56±0.05##山楂叶总黄酮低剂量组0.38±0.04##0.25±0.03#山楂叶总黄酮中剂量组0.66±0.08##0.44±0.05##山楂叶总黄酮高剂量组0.75±0.07##0.52±0.06##
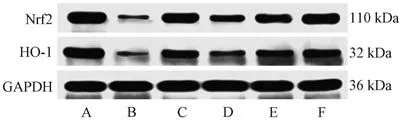
图3 各组大鼠卵巢组织Nrf2 及HO-1 蛋白表达Fig.3 Nrf2 and HO-1 protein expressions in rat ovarian tissue of each group
4 讨论
本研究通过高脂饲料喂食及灌胃来曲唑法成功复制了大鼠PCOS 模型,并证实山楂叶总黄酮能够使PCOS 大鼠紊乱的动情周期恢复,减轻卵巢组织病理损伤变化。激素水平失衡是引起代谢紊乱和生殖功能障碍的重要原因,其中FSH、LH、T、AMH及E2等激素对卵巢正常功能的发挥具有关键性的影响[12]。FSH 的主要作用为促进卵泡成熟,LH 可以调节月经周期及促进合成雌激素、雄激素;T 能够影响卵泡成熟的生理过程,其水平增加会使卵泡的发育成熟过程被抑制,并能降低卵母细胞数量;AMH 的水平与窦状卵泡数呈正比,E2具有较强的抗雄激素作用[13]。本研究结果发现,山楂叶总黄酮能够增加血清FSH 活性及E2水平,降低LH 活性及T、AMH 水平,可以通过影响体内激素水平改善PCOS 大鼠卵巢内环境。
糖代谢紊乱是PCOS 病因研究中公认的重要发病机制之一,FBG、FINS 及HOMA-IR 是反映糖代谢紊乱的常用指标,具体表现为FBG、FINS 水平及HOMA-IR 值升高[14]。糖代谢紊乱可以对下丘脑-垂体-卵巢轴造成影响,干扰卵子的生成及排出过程,进而引起女性内分泌系统和生殖功能的持久性损伤;糖代谢紊乱也可以通过抑制性激素结合球蛋白的合成,升高游离T 水平,使卵巢合成雄激素增加并促进释放,导致PCOS 发生[15]。本研究结果发现,山楂叶总黄酮组大鼠FBG、FINS、LDL、TG、TC 水平及HOMA-IR 值均有不同程度的降低,表明山楂叶总黄酮具有改善PCOS 大鼠糖脂代谢紊乱作用,进而缓解PCOS 症状。
氧化应激不仅在各种代谢性疾病、衰老、肿瘤及慢性炎症中发挥着重要作用,同时也参与了PCOS 的发生及发展[16]。研究发现,卵巢的内分泌功能可以受到氧化应激的影响,导致卵泡发育受损、卵泡闭锁及成熟障碍;氧化应激也可使卵巢雄激素相关合成酶的表达增加,促进雄性激素的生成和分泌,从而加速PCOS 的发生及进展[17]。因此,抑制氧化应激是预防和治疗PCOS 的潜在手段。周少英等[18]研究发现,山楂叶总黄酮可以减轻糖尿病大鼠肝组织损伤,该作用与提高机体抗氧化酶活性,进而使氧化应激损伤降低有关。在大鼠肺缺血再灌注损伤模型中,山楂叶总黄酮可以升高SOD、CAT 活性和降低MDA 水平,通过增加自由基清除能力及减轻氧化应激损伤发挥保护肺组织损伤作用[19]。Nrf2/HO-1 信号通路是机体抗氧化反应的主要调节通路,Nrf2 具有调节氧化应激反应作用,而HO-1 是Nrf2 发挥抗氧化活性的重要媒介[20]。研究证实,HO-1 的高表达与PCOS 发病风险的增加密切相关[21]。Li 等[22]研究发现,NADPH 氧化酶4 缺失可能通过激活Nrf-2/HO-1 信号通路,减轻氧化应激,从而改善PCOS。本研究结果发现,山楂叶总黄酮组大鼠卵巢组织SOD、GSH-Px 活性及Nrf2、HO-1 蛋白表达升高,MDA 水平降低,表明山楂叶总黄酮能够活化PCOS 大鼠Nrf2/HO-1 信号通路进而发挥抗氧化应激作用。
综上所述,山楂叶总黄酮能够活化PCOS 大鼠卵巢组织Nrf2/HO-1 信号通路发挥抗氧化应激作用,改善糖脂代谢异常及胰岛素敏感性,调节激素水平,减轻卵巢病理变化,恢复紊乱的动情周期。本研究结果可为山楂叶总黄酮预防和治疗PCOS 提供科学依据,也有助于扩展山楂叶总黄酮的应用范围,但对于作用机制及靶点的研究还有待深入。

