基于网络药理学和细胞实验探讨桂枝茯苓丸对卵巢癌的作用
冯 敏,袁 烁,黄艳茜,赖裕玲,曾富玲,邓高丕*
(1.广州中医药大学第一临床医学院,广东 广州 510405;2.广州中医药大学第一附属医院,广东 广州 510405)
卵巢癌是女性中最常见的妇科恶性肿瘤之一,其发病率仅次于宫颈癌[1]。由于卵巢癌在早期缺乏特异性症状和有效的筛查策略,患者多在晚期诊断,因此预后较差。仅有15%卵巢癌患者能在早期被诊断,而5 年生存率为47%[2]。目前,卵巢癌的一线治疗方法为手术和铂类及紫杉醇类的药物化疗[3-5]。但化疗有诸多不良反应,如脱发、恶心、呕吐和骨髓抑制等[6]。虽然靶向疗法在卵巢癌的治疗中取得了重大进展,但是其费用昂贵且有高血压、蛋白尿、血栓等并发症[7]。
桂枝茯苓丸是妇科经典方剂,由桂枝、茯苓、丹皮、芍药、桃仁组成,在临床和研究中被用于治疗原发性痛经、围绝经潮热、子宫内膜异位症、子宫肌瘤、多囊卵巢综合征、乳腺癌、卵巢癌等[8-15]。研究证实,桂枝茯苓丸在治疗卵巢癌中显示出安全性和有效性,并抑制了卵巢癌中的肿瘤进展。同时,桂枝茯苓丸还可以改善卵巢癌患者的生活质量[16]。
中药配方是典型的“多组分、多靶点、多途径” 复方,在治疗卵巢癌中具有很大的优势。但是,桂枝茯苓丸治疗卵巢癌的活性成分、特定靶标和分子机制尚未明确。本研究通过网络药理学和体外实验验证的方法,探究桂枝茯苓丸治疗卵巢癌的有效成分、作用靶点及通路,为后续研究提供参考。
1 材料与方法
1.1.1 桂枝茯苓丸活性成分的筛选 通过检索TCMSP 数据库(http://tcmspw.com/tcmsp.php) 筛选桂枝茯苓丸的活性成分,筛选条件为口服生物利用度(oral bioavailability,OB) ≥30%及类药性(drug likeness,DL) ≥0.18。
1.1.2 桂枝茯苓丸活性成分靶点的预测 根据TCMSP 数据库获取的桂枝茯苓丸活性成分,利用PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)得到3D 分子结构文件(.SDF) 和SMILE 结构,通过TCMSP、SwissTargetPrediction(http://www.swisstargetprediction.ch/) 和 STITCH(http://stitch.embl.de/) 平台得到桂枝茯苓丸活性成分的相关靶点。最后,使用UniProt 知识数据库 (www.uniprot.org) 将相应靶点名称转化为基因名称。
1.1.3 卵巢癌疾病靶点的筛选 以“ovarian cancer” 为关键词检索 GeneCards 数据库 (http://www.genecards.org/) 和 DisGeNET 数据库 (https://www.disgenet.org/),收集卵巢癌的疾病靶点。
1.1.4 桂枝茯苓丸与卵巢癌共同靶点蛋白质互作网络(PPI) 的构建 通过R 语言将获得的活性成分靶点与卵巢癌疾病靶点相交得到交集靶点和Venn 图,将交集靶点通过STRING (https://string-db.org/) 平台得到蛋白质-蛋白质相互作用(PPI) 网络,网络构建条件为种属人,最小互作分数0.4。将所得网络通过R 语言绘制为蛋白互作网络靶点条形图。
1.1.5 活性成分-靶点网络及疾病-药物-活性成分-靶点网络的构建 选取蛋白互作网络靶点条形图中前20 个重要靶点及相应活性成分,通过Cytoscape 3.7.1 软件 (www.cytoscape.org/) 构建活性成分-靶点网络及疾病-药物-活性成分-靶点网络,根据网络计算出的连接度(Degree)、紧密中心度(Closeness Centrality) 得到核心活性成分及核心靶点。
1.1.6 GO 功能和KEGG 通路富集分析 将重要靶点通过DAVID (https://david.ncifcrf.gov/) 数据库进行基因本体论(gene ontology,GO) 功能注释和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,筛选条件为P<0.05。然后利用Omicshare平台对GO 与KEGG 富集结果进行可视化处理。
榜单中较为明显的变化是,美国页岩油气独立生产商有8 家进入榜单。加拿大两家油砂开采商排名也有所提高。榜单中,国家石油公司有30家,占比60%。
1.1.7 核心活性成分及核心靶点分子对接验证 将获得的核心成分作为配体及核心靶点作为受体进行分子对接,首先通过PDB 数据库(http://www.rcsb.org/) 下载核心靶点蛋白结构,在PubChem 数据库获得核心成分蛋白3D结构,利用AutoDock Tools 对上述受体和配体进行常规处理并进行分子对接,以自由结合能的数值为评价标准,选取最优结果进行可视化处理。
1.2 体外细胞实验验证
1.2.1 试剂与药物 桂枝、茯苓、牡丹皮、赤芍、桃仁均购自广东省康美药业有限公司,取桂枝、茯苓、牡丹皮、赤芍、桃仁各15 g,加150 mL 蒸馏水煎煮60 min 后过滤,取滤液加热浓缩至生药量1.5 g/mL,于4 ℃保存备用。细胞增殖毒性检测(CCK-8) 试剂(日本东仁公司,批号NU680);胎牛血清、RPMI Medium 1640 培养基 (美国Gibco 公司,批号16000-044、8119080);Annexin Ⅴ细胞凋亡检测试剂盒、SDS-PAGE 凝胶快速配制试剂盒、BCA 蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号C1062M、51319190513、10719190418);PI3K 多克隆抗体、GAPDH 单克隆抗体(武汉三鹰生物技术有限公司,批号10016961、00083125);p-PI3K 多克隆抗体、Akt 单克隆抗体、p-Akt 单克隆抗体、抗兔IgG-HRP 抗体(美国CST 公司,货号17366S、4691、4060、7074);Bax 单克隆抗体、Bcl-2 单克隆抗体 (英国Abcam 公司,货号ab32503、ab32124)。
1.2.2 动物 SPF 级雌性SD 大鼠20 只,6~8 周龄,体质量220~300 g,购自广东省实验动物中心[实验动物质量合格证号44007200068190],饲养环境恒温、恒湿,采用12 h/12 h 光/暗周期,大鼠自由饮水、摄食,实验开始前适应性饲养1 周。
1.2.3 含药血清制备 大鼠随机分为空白组及桂枝茯苓丸组,每组10 只,桂枝茯苓丸组灌胃给予1.5 g/mL 桂枝茯苓丸药液(10 g/kg),空白组灌胃给予等体积生理盐水,每天2 次,连续5 d。末次给药0.5 h 后,于大鼠腹主动脉取血,室温静置4 h,离心后收集血清分装至1 mL 离心管中,于-80 ℃保存。
1.2.4 细胞培养 人卵巢癌SKOV3 细胞系购自美国菌种保藏中心(ATCC),使用含有10%FBS、100 μ/mL 青霉素和链霉素的RPMI 1640 培养基,于37 ℃、5% CO2细胞培养箱中常规传代培养。
1.2.5 细胞活力检测 取对数生长期SKOV3 细胞,以每孔1.0×104个细胞的密度接种到96 孔板中,在培养箱中培养24 h,之后加入不同浓度的空白血清及含药血清,分组为对照组、10%空白血清组、5%含药血清组、10%含药血清组、15%含药血清组,每组设置3 个复孔,培养6、12、24 h 后,加入10 μL CCK8 试剂,孵育3 h,用酶标仪测定各组450 nm 波长处吸光度值,筛选出适宜的含药血清浓度及作用时间。
1.2.6 流式细胞仪检测细胞凋亡 取对数生长期SKOV3细胞,以每孔1.0×105个细胞的密度接种到6 孔板中,培养24 h 后加入含药血清及空白血清,分组为对照组、10%空白血清组、10%含药血清组,干预24 h 后收集细胞,重悬并进行细胞计数,取含1×106个细胞的悬液,1 000×g离心3 min,加入195 μL Buffer 试剂重悬,避光加入5 μL Annexin V-FITC、10 μL PI,室温孵育15 min,流式细胞仪上机检测。
1.2.7 蛋白免疫印迹法检测相关蛋白表达 SKOV3 细胞按“1.2.6” 项下方法分组、给药,药物干预24 h 后加入细胞裂解液60 μL,冰上裂解30 min,12 000 r/min 离心15 min,取上清液采用BCA 法检测蛋白浓度,蛋白煮沸变性后上样、电泳,将目的条带电转至硝酸纤维素膜上,快速封闭液室温封闭15 min,一抗4 ℃孵育过夜,洗膜3 次,二抗室温孵育1 h,经ECL 化学发光试剂显色,置于凝胶成像系统中成像。
1.2.8 统计学分析 通过SPSS 20.0 及GraphPad Prism 6.0软件进行处理,计量资料以(±s) 表示,组间比较采用单因素方差分析,方差齐时两两比较采用LSD 检验,方差不齐时采用Dunnett’s T3 检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 桂枝茯苓丸活性成分及相关靶点筛选 通过TCMSP数据库筛选得到桂枝茯苓丸85 种活性成分,其中桂枝7种,茯苓15 种,牡丹皮11 种,赤芍有29 种和桃仁23 种,活性成分具体见表1。根据所得到的85 种成分,提交至TCMSP、SwissTargetPrediction 和STITCH 平台得到桂枝茯苓丸活性成分相关的476 个靶点,删除重复项目后,共得到203 个相关靶点。

表1 桂枝茯苓丸活性成分信息表
2.2 卵巢癌疾病靶点筛选 使用GeneCards 和DisGeNET 疾病数据库筛选得到117 个卵巢癌疾病相关靶点。利用R 语言对桂枝茯苓丸活性成分的203 个相关靶点及卵巢癌疾病相关的117 个靶点取交集,得到23 个共同靶点,并绘制韦恩图,见图1。

图1 桂枝茯苓丸-卵巢癌共同靶点
2.3 桂枝茯苓丸与卵巢癌共同靶点蛋白质互作网络(PPI)建立 将23 个共同靶点递交至STRING 数据库构建PPI 网络(图2),该网络由23 个节点和167 条边组成。在PPI 网络图中,节点和边缘分别代表蛋白质/基因靶点及其相互作用。在随机选择23 个节点的情况下,获取的PPI 预期边数为56,平均局部聚类系数为0.829,PPIN 富集的统计值为(<1.0×10-16),具有统计学意义。根据PPI 图中的节点程度利用R 语言得到蛋白互作网络靶点条形图,见图3。
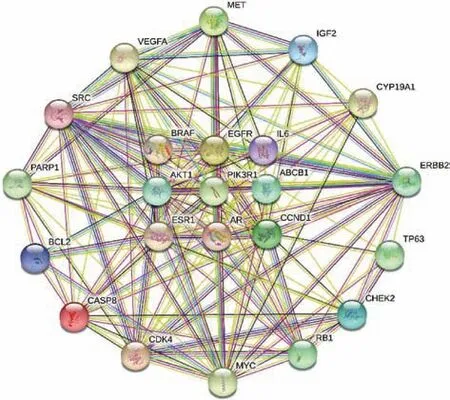
图2 桂枝茯苓丸与卵巢癌共同靶点蛋白质互作网络

图3 蛋白互作网络靶点条形图
2.4 活性成分-靶点网络及疾病-药物-活性成分-靶点网络建立 活性成分-靶点网络如图4 所示,桂枝茯苓丸对卵巢癌的治疗作用与9 种活性成分和20 个靶点相关。在9 种活性成分中,槲皮素连接靶点数最多,共有18 个靶点与其相接,因此,槲皮素可能为桂枝茯苓丸治疗卵巢癌的关键活性成分。在20 个靶点中ESR1 与6 种活性成分相关,ESR1可能为桂枝茯苓丸治疗卵巢癌的关键靶点。疾病-药物-活性成分-靶点网络如图5 所示,其中绿色节点代表疾病,粉红色节点代表药物,黄色节点代表活性成分,蓝色节点代表靶点。通过连接度、紧密中心度来分析疾病-药物-活性成分-靶点网络拓扑特征,可知在这9 种活性成分中,有2 种活性成分的连接度和紧密度中心度高于平均连接度和平均紧密度中心度,包括槲皮素 (连接度38,紧密度中心度0.576)、鞣花酸(连接度23,紧密度中心度0.507)。在20个靶点中,网络拓扑特征显示EGFR (连接度6,紧密度中心度0.447)、ESR1 (连接度12,紧密度中心度0.486)、VEGFA (连接度6,紧密度中心度0.459)、AR (连接度8,紧密度中心度0.472)、CASP8 (连接度8,紧密度中心度0.459)、IGF2 (连接度6,紧密度中心度0.459)、Akt1(连接度6,紧密度中心度0.459) 是核心靶点。

图4 活性成分-靶点网络

图5 疾病-药物-活性成分-靶点网络
2.5 GO 和KEGG 富集分析 GO 富集分析是根据基因的功能对其进行分类的一种分析方法,可分为生物过程(BP)、分子功能(MF) 和细胞组成(CC)。本研究BP 主要涉及ERBB2 信号通路、上皮细胞增殖、细胞对胰岛素刺激反应、细胞增殖、细胞对表皮生长因子刺激反应、凋亡负反馈等,见图6A。CC 主要涉及核浆、蛋白质复合体、质膜、细胞质核周区、线粒体等,见图6B。MF 主要涉及蛋白激酶活性、蛋白酪氨酸激酶活性、ATP 结合、蛋白磷酸酶结合等,见图6C。

图6 GO 功能富集分析
KEGG 富集分析共获得了26 条相关途径,其中主要涉及肿瘤的蛋白聚糖、肿瘤碳代谢,局部黏附、PI3K-Akt 信号通路、ErbB 信号通路、HIF-1 信号通路、甲状腺激素信号通路、泌乳素信号通路等,具体见图7。
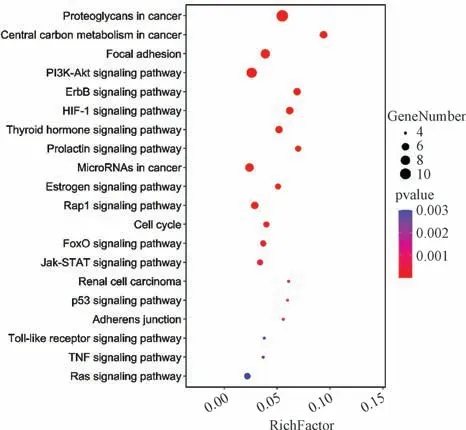
图7 KEGG 通路富集分析
2.6 核心活性成分及核心靶点分子对接验证 将核心活性成分槲皮素、鞣花酸和核心靶点分子ESR1、AR、EGFR、CASP8、VEGFA 进行分子对接验证,结果见表2。文献研究认为,若结合能<0,表明配体和受体能自发结合;若结合能<-4.25 kJ/mol 表明配体与受体有一定的结合活性;<-5.0 kJ/mol表明受体和配体有较好的结合活性;<-7.0 kJ/mol 表明配体和受体有强烈的结合活性[17]。活性成分槲皮素与ESR1、AR、EGFR、CASP8 有较低的结合能,因此结合活性好;活性成分鞣花酸与VEGFA 有较低的结合能,结合活性好,具体分子对接结合模式见图8。

图8 桂枝茯苓丸核心活性成分与核心靶点的分子对接

表2 核心活性成分与核心靶点结合能预测表(kJ/mol)
2.7 桂枝茯苓丸对SKOV3 细胞增殖的影响 与对照组比较,给药干预24 h 后,10%空白血清组细胞活力无明显变化(P>0.05),不同浓度桂枝茯苓丸含药血清组SKOV3细胞均受到抑制(P<0.05),且呈剂量依赖性,见图9A。10%、15%含药血清在6、12、24 h 对SKOV3 细胞均有不同程度的抑制作用(P<0.05),且呈时间依赖性,见图9B。10%含药血清作用于SKOV3 细胞24 h 后细胞存活率为63.23%,抑制作用较强,故后续实验选用此浓度及时间。

图9 桂枝茯苓丸对SKOV3 细胞增殖活力的影响
2.8 桂枝茯苓丸对SKOV3 细胞凋亡的影响 如图10、表3所示,与对照组比较,10% 空白血清组细胞凋亡率无明显变化(P>0.05);与对照组和10% 空白血清组比较,10%含药血清组细胞凋亡率均升高(P<0.05),且凋亡主要以晚期凋亡为主。
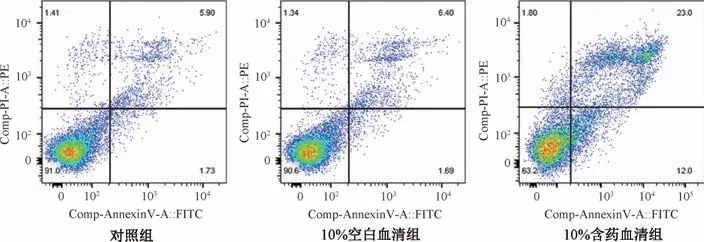
图10 各组SKOV3 细胞凋亡情况
表3 桂枝茯苓丸对SKOV3 细胞凋亡的影响(±s,n=3)

表3 桂枝茯苓丸对SKOV3 细胞凋亡的影响(±s,n=3)
注:与对照组比较,*P<0.05;与空白血清组相比,#P<0.05。
组别细胞凋亡率/%对照组6.65±0.43 10%空白血清组7.43±0.52 10%含药血清组34.20±1.90*#
2.9 桂枝茯苓丸对SKOV3 细胞凋亡蛋白及PI3K/Akt 信号通路蛋白表达的影响 如图11、表4 所示,与对照组比较,10%空白血清组细胞p-PI3K/PI3K、p-Akt/Akt、Bax、Bcl-2蛋白表达无明显变化(P<0.05);与对照组和10% 空白血清组比较,10%含药血清组细胞p-PI3K/PI3K、p-Akt/Akt、Bax 蛋白表达降低(P<0.05),Bax 表达升高(P<0.05)。

图11 各组SKOV3 细胞PI3K、Akt、Bax、Bcl-2 蛋白条带图
表4 桂枝茯苓丸对SKOV3 细胞凋亡蛋白及PI3K/Akt 信号通路蛋白表达的影响(±s,n=3)

表4 桂枝茯苓丸对SKOV3 细胞凋亡蛋白及PI3K/Akt 信号通路蛋白表达的影响(±s,n=3)
注:与对照组比较,*P<0.05;与10%空白血清组比较,#P<0.05。
组别p-PI3K/PI3Kp-Akt/AktBaxBcl-2对照组0.92±0.041.01±0.070.96±0.021.55±0.10 10%空白血清组0.88±0.020.95±0.081.01±0.061.46±0.06 10%含药血清组0.33±0.01*#0.49±0.20*#1.27±0.11*#0.68±0.07*#
3 讨论
卵巢癌死亡率位居妇科肿瘤之首,严重威胁了女性的生命健康[18]。目前,桂枝茯苓丸对卵巢癌的临床疗效已获得广泛认可,在强化肿瘤控制效果、提高免疫力、减少化疗不良反应等方面具有优越性[19-20]。但是桂枝茯苓丸治疗卵巢癌的机制目前尚不明确,故本研究通过网络药理学预测结合体外实验来阐明桂枝茯苓丸对卵巢癌的治疗机制。
本研究发现槲皮素和鞣花酸的连接度要比其他活性成分高,有可能是桂枝茯苓丸治疗卵巢癌的核心成分。鞣花酸是一种天然的多酚化合物,具有很强的抗癌作用[21]。据报道,鞣花酸能抑制卵巢癌细胞的增殖和迁移,降低基质MMP2 和MMP9 表达[22]。鞣花酸还可改善顺铂诱导的肾小管扩张、坏死、退行性变等病理改变[23]。槲皮素是一种类黄酮化合物,目前已证明合理剂量的槲皮素具有抗炎、抗氧化剂、抗癌作用等[24]。在临床试验中发现静脉注射槲皮素不仅能抗肿瘤且具有良好的安全性[25]。本研究还发现有7 个靶点在活性成分-靶点网络中连接度大于4.5 (平均连接度),分别为 ESR1、AR、EGFR、CASP8、VEGFA、IGF2、Akt1。ESR1 是雌激素受体α (ERα) 的编码基因,其甲基化会影响卵巢癌的发展,并可能在卵巢癌患者的预后中发挥作用[26]。AR是编码雄激素受体的基因,在卵巢癌中AR基因表达上调[27],AR 信号通路已被证明可促进卵巢癌细胞的增殖、迁移和侵袭[28-29]。EGFR 是一种跨膜糖蛋白,是酪氨酸激酶受体ErbB 家族成员之一,EGFR 参与了肿瘤启动、血管生成和转移等过程[30]。CASP8 基因位于人类染色体2q33.1 上,是一种启动外部凋亡途径的半胱氨酸蛋白酶,其高表达与卵巢癌预后不良和进展相关[31]。VEGFA 是最有效的血管生成因子,在正常和癌症组织中均可刺激干细胞样细胞,它在卵巢癌中过表达,诱导DNMT3A 蛋白上调,介导了卵巢癌中干细胞样细胞的扩张[32]。IGF-2 是一种小型多肽配体,与癌症的发展、进展和化疗反应有关[33]。Akt1 属于丝氨酸/苏氨酸蛋白激酶家族,在Akt 基因家族中,Akt1 在细胞生存、分化和代谢中发挥重要作用,Akt1 的E17K 突变是一种致癌突变,这种突变主要发生在卵巢癌中[34]。
GO 富集分析结果提示20 个靶点主要参与细胞凋亡、细胞增殖和分化、蛋白磷酸化等过程。细胞凋亡是一种程序性细胞死亡,目前已经发现异常的细胞凋亡可导致许多人类疾病,尤其是癌症[35]。而细胞凋亡在预防癌症发生中起着重要作用[36]。Bcl-2 通常被认为是抗凋亡相关蛋白,其过表达已被确定为一些癌症的原因[37]。不受控制的细胞增殖是癌症的一个特征,在卵巢癌中,信号转导和转录激活因子(STATs) 将信号从细胞膜转导到细胞核,在控制细胞增殖和分化方面发挥基础性作用[38]。肿瘤发生是一个复杂的过程,lncRNA 表现出多种功能,例如ANRIL 能在卵巢癌细胞系过表达和影响细胞增殖[39]。有报道称,HOST2在卵巢癌中过表达促进癌细胞的增殖和迁移[40]。多种分子的磷酸化与肿瘤发展相关,如Akt、ERK1 和ERK2 的磷酸化与肿瘤密切相关[41]。研究表明p53 蛋白在丝氨酸15 位点磷酸化(Ser15) 和丝氨酸20 位点磷酸化(Ser20) 决定肿瘤细胞的凋亡活性[42]。
KEGG 通路分析结果表明20 个靶点主要参与26 条通路,这些信号通路可能是桂枝茯苓丸治疗卵巢癌的机制。肿瘤蛋白聚糖、肿瘤中心碳代谢、局灶性粘附、PI3K/Akt信号通路、ErbB 信号通路是富集程度最高的5 条通路。蛋白聚糖是细胞外基质的主要成分,它们在形成肿瘤生长的临时基质中发挥重要作用,影响细胞-细胞间和细胞-基质间的相互作用和肿瘤细胞信号传导[43]。细胞能量代谢失调是癌症的一个标志[44]。丙氨酸、精氨酸、谷氨酸和天冬酰胺与癌症的中心碳代谢有关[45]。既往研究表明,在卵巢癌中二甲双胍和天冬酰胺影响了葡萄糖进入线粒体的能力[46]。粘附局灶激酶(FAK) 在粘附局灶动力学调控中具有重要作用[47]。在卵巢癌中,FAK 调节癌细胞的迁移和侵袭[48]。众所周知,PI3K/Akt 通路在调节细胞生长、运动、生存和代谢以及血管生成等方面发挥重要作用[49]。近70%的卵巢癌过度激活了PI3K/Akt 通路[50]。因此,PI3K 信号级联异常可能是治疗卵巢癌的一个潜在靶点[51]。ERBB 信号通路参与多种人类癌症,大约20%~30% 的卵巢癌存在ErbB2、ErbB3 的过表达[52-53]。
本研究重点验证了桂枝茯苓丸通过抑制PI3K/Akt 通路诱导SKOV3 细胞凋亡。研究报道,50%以上的肿瘤细胞存在凋亡缺陷,可以通过多种途径逃避凋亡[54]。因此,诱导凋亡是诸多化疗药物治疗肿瘤的作用机制,而且许多中药活性成分也通过抑制抗凋亡蛋白达到相同目的[55]。在卵巢癌的发生发展过程中,PI3K/Akt 信号通路异常激活,PI3KCA 基因作为PI3K 的催化亚基的编码基因,在80%的早期卵巢癌中发生了突变,从而引起了PI3K 的活化,Akt是PI3K 下游的重要靶点,Akt 磷酸化抑制或激活细胞的分化、增殖及凋亡等过程[56-58]。本实验结果表明,桂枝茯苓丸能下调SKOV3 细胞p-PI3K/PI3K、p-Akt/Akt 表达,证实桂枝茯苓丸能抑制PI3K/Akt 信号通路。本实验结果还显示,桂枝茯苓丸促进了SKOV3 细胞的凋亡,提示桂枝茯苓丸通过抑制PI3K/Akt 信号通路来促进SKOV3 细胞凋亡,抑制卵巢癌的发生和发展。
综上所述,桂枝茯苓丸治疗卵巢癌的活性成分可能为槲皮素和鞣花酸等,这些活性成分作用于ESR1、AR、EGFR、CASP8、VEGFA、IGF2、Akt1 等靶点,参与调节细胞增殖、细胞凋亡、PI3K/Akt 信号通路等。体外实验验证桂枝茯苓丸可能通过抑制PI3K/Akt 通路来促进SKOV3 细胞凋亡,达到抗肿瘤的作用。本研究为桂枝茯苓丸治疗卵巢癌的作用机制提供了参考,为后续研究奠定了基础。

