大孔吸附树脂分离纯化白子菜总黄酮工艺优化
于 凤,许凯歌,许秋双,李天祥
(天津中医药大学,天津 301617)
白子菜为菊科菊三七属植物,2010 年被批准为新食品原料,全草入药[1-2],具有降尿酸[3]、抗痛风[4]、治疗2 型糖尿病[5-7]、胰岛素抵抗[8-9]、治疗脂肪肝[10-11]、增强胃肠蠕动[12]等功效,并且活性成分丰富,包括黄酮、生物碱、酚酸[13]。课题组前期发现,白子菜黄酮有着显著的降低血尿酸作用。
黄酮分离纯化方法诸多,以大孔吸附树脂为主[14],它作为一种绿色环保材料在中药材、中药制剂方面应用广泛[15-20],但目前尚未涉及白子菜总黄酮。因此,本实验考察了HPD600、AB-8、ADS-7、D101、DM301 型大孔吸附树脂对白子菜总黄酮的吸附性能,并优化该成分分离纯化工艺,以期为其药理活性研究及相关制剂开发奠定基础。
1 材料
1.1 仪器 HNY-200F 型恒温培养振荡器(天津市欧诺仪器仪表有限公司);UV-6100 PCS 型紫外分光光度计(上海美普达仪器有限公司);DT5-1型低速台式离心机(北京时代北利离心机有限公司);R-1001N 型旋转蒸发仪(郑州长城科工贸有限公司)。
1.2 试剂与药物 芦丁对照品(批号1009H022,纯度≥98%,北京索莱宝科技有限公司)。ZTC1+1Ⅱ型天然澄清剂(A、B 组分,武汉振天成科技有限公司)。HPD600、AB-8、ADS-7、D101、DM301型大孔吸附树脂(北京索莱宝科技有限公司)。硫酸、硝酸铝、氢氧化钠、亚硝酸钠为分析纯;无水乙醇为分析纯(天津市富宇精细化工有限公司);水为纯净水(杭州娃哈哈集团有限公司)。
1.3 药材 白子菜于2020 年9 月采自天津种质资源圃,经天津中医药大学李天祥教授鉴定为菊科植物白子菜Gynuradivaricate(L.) DC.。
2 方法与结果
2.1 总黄酮含量测定
2.1.1 对照品溶液制备 精密称取干燥至恒重的芦丁对照品3.140 2 mg,置于25 mL 棕色量瓶中,60%乙醇溶解,即得(该成分质量浓度为0.125 6 mg/mL),精密吸取0.1、0.25、0.5、1.0、1.5、2.0 mL,置于10 mL 量瓶中,60%乙醇定容,制成系列质量浓度。
2.1.2 线性关系考察 精密吸取不同质量浓度对照品溶液各0.5 mL,置于10 mL 量瓶中,加入5%NaNO2溶液0.4 mL,摇匀,静置5 min,加入10%Al (NO3)3溶液0.4 mL,摇匀,静置5 min,加入4%NaOH 溶液5 mL,摇匀,静置5 min,以相应试剂为空白,在510 nm 波长处测定吸光度。以对照品质量浓度为横坐标(X),吸光度为纵坐标(A)进行回归,得方程为A=0.012 1X+0.002 6 (r=0.999 8),在12.56~251.2 μg/mL 范围内线性关系良好。
2.1.3 上样液制备 称取白子菜粉末300 g,20倍量60%乙醇浸泡30 min,回流提取1 h,共2 次,滤过,合并滤液,回收溶剂,制备0.2 g/mL 醇提液,置于50 ℃水浴锅中,缓慢加入4%B 组分(含ZTC1+1 Ⅱ型天然澄清剂) 并不断搅拌,水浴30 min,加入2%A 组分水浴20 min,每隔5 min 搅拌20 s,室温静置2 h,3 000 r/min 离心5 min,取上清液,即得。
2.1.4 测定方法 精密吸取0.5 mL 上样液,按“2.1.2” 项下方法测定3 次吸光度,取平均值,代入方程,计算总黄酮含量。
2.2 树脂预处理 取HPD600、AB-8、ADS-7、D101、DM301 型树脂适量,装柱(2 cm×30 cm),8 BV 2%NaOH 溶液以4 BV/h 体积流量冲洗2 h,蒸馏水冲洗至流出液呈中性,60 ℃水浴加热5 min,95%乙醇浸泡30 min,以3 BV/h 体积流量冲洗4 BV,2%HCl 浸泡30 min,以3 BV/h 体积流量冲洗4 BV,蒸馏水冲洗至流出液呈中性。
2.3 大孔吸附树脂筛选
2.3.1 静态吸附性能 称取预处理后抽滤至干的5 种树脂各1.5 g,置于具塞锥形瓶中,加入0.2 g/mL 上样液20 mL,置于恒温振荡培养箱(25 ℃、100 r/min) 中振荡3 h,滤过,取续滤液,测定吸附率,公式为吸附率=[(C1-C2)/V1] ×100%,其中C1为吸附前总黄酮质量浓度,C2为吸附后总黄酮质量浓度,V1为上样液体积。弃去上清液后,加入55%乙醇20 mL,置于恒温振荡培养箱中振荡3 h,取上清液,计算解吸率,公式为解吸率={C3V2/[(C1-C2) ×V1] } ×100%,其中C3为解吸后总黄酮质量浓度,V2为解吸后溶液体积,结果见表1。由此可知,AB-8 型树脂吸附能力最强,HPD600 型树脂解吸能力最强。
表1 总黄酮在不同树脂上的静态吸附能力(±s,n=3)Tab.1 Static adsorption capacities of total flavonoids on different resins (±s,n=3)
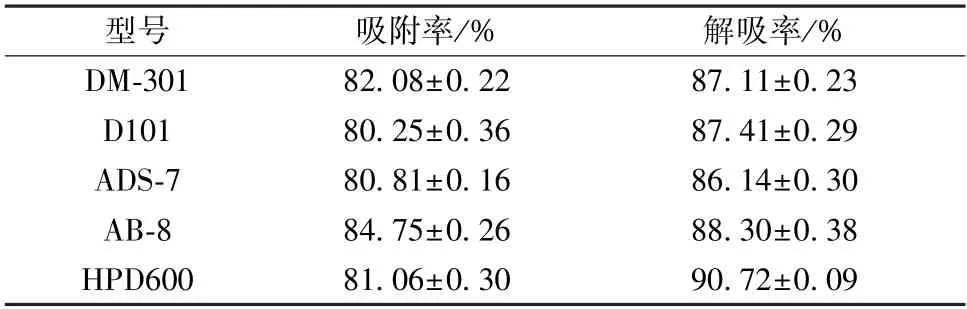
表1 总黄酮在不同树脂上的静态吸附能力(±s,n=3)Tab.1 Static adsorption capacities of total flavonoids on different resins (±s,n=3)
型号吸附率/%解吸率/%DM-30182.08±0.2287.11±0.23 D10180.25±0.3687.41±0.29 ADS-780.81±0.1686.14±0.30 AB-884.75±0.2688.30±0.38 HPD60081.06±0.3090.72±0.09
2.3.2 动态吸附性能 称取预处理后抽滤至干的5 种树脂各3.0 g,装柱(1 cm×50 cm),40 mL 0.2 g/mL 上样液以3 BV/h 体积流量上样,收集流出液,4 BV 55% 乙醇洗脱,保持体积流量不变,收集洗脱液,计算吸附率、解吸率,结果见表2。由此可知,AB-8 型树脂吸附能力最强,HPD600型树脂解吸能力最强。
表2 总黄酮在不同树脂上的动态吸附能力(±s,n=3)Tab.2 Dynamic adsorption capacities of total flavonoids on different resins (±s,n=3)

表2 总黄酮在不同树脂上的动态吸附能力(±s,n=3)Tab.2 Dynamic adsorption capacities of total flavonoids on different resins (±s,n=3)
型号吸附率/%解吸率/%DM-30172.46±0.6790.27±0.24 D10171.09±0.2187.44±0.48 ADS-772.15±0.2490.47±0.42 AB-878.28±0.4589.12±0.25 HPD60074.20±0.4391.45±0.44
2.3.3 混合树脂吸附性能 分别按1 ∶0、2 ∶1、3 ∶ 2、1 ∶ 1、2 ∶ 3、1 ∶ 2、0 ∶ 1 比例称取HPD600、AB-8 型树脂共3.0 g,混匀后装柱,40 mL 0.2 g/mL 上样液以4 BV/h 体积流量上样,收集流出液,计算吸附率,20 mL 55% 乙醇以4 BV/h 体积流量洗脱,收集洗脱液,计算解吸率,结果见表3。由此可知,两者比例为3 ∶2 时吸附性能最佳。
表3 不同比例混合树脂吸附性能(±s,n=3)Tab.3 Adsorption capacities of mixed resins with different ratios (±s,n=3)

表3 不同比例混合树脂吸附性能(±s,n=3)Tab.3 Adsorption capacities of mixed resins with different ratios (±s,n=3)
HPD600、AB-8 型树脂比例吸附率/%解吸率/%1 ∶083.14±0.0983.96±0.05 1 ∶185.98±0.0889.10±0.05 2 ∶183.88±0.0587.67±0.06 3 ∶286.71±0.0589.94±0.07 2 ∶385.05±0.0988.43±0.01 1 ∶284.88±0.0285.66±0.02 0 ∶184.16±0.0183.43±0.06
2.4 混合树脂吸附研究
2.4.1 生药量与混合树脂干重比例 称取HPD600 型树脂1.8 g、AB-8 型树脂1.2 g,共5份,混匀后装柱,设定生药量与混合树脂干重比例分别为1 ∶2、1 ∶1、2 ∶1、3 ∶1、4 ∶1,分别量取0.2 g/mL 上样液7.5、15、30、45、60 mL,以4 BV/h 体积流量上样,收集流出液,计算总黄酮吸附率,结果见表4。由此可知,两者比例大于3 ∶1时吸附率迅速降低,表明吸附已饱和。
表4 生药量与混合树脂干重比例对总黄酮吸附率的影响(±s,n=3)Tab.4 Effect of crude drug dosage-mixed resin dry weight ratio on adsorption rate of total flavonoids (±s,n=3)

表4 生药量与混合树脂干重比例对总黄酮吸附率的影响(±s,n=3)Tab.4 Effect of crude drug dosage-mixed resin dry weight ratio on adsorption rate of total flavonoids (±s,n=3)
生药量与混合树脂干重比例吸附率/%1 ∶291.78±0.07 1 ∶191.68±0.06 2 ∶191.31±0.08 3 ∶189.92±0.09 4 ∶179.81±0.07
2.4.2 上样液质量浓度 称取HPD600 型树脂1.8 g、AB-8 型树脂1.2 g,共5 份,混匀后装柱,按“2.1.3” 项下方法制备上样液,取质量浓度为1.2 g/mL 者7.5 mL,蒸馏水依次稀释至0.075、0.15、0.3、0.6、1.2 g/mL,以4 BV/h 体积流量上样,收集流出液,计算总黄酮吸附率,结果见表5。由此可知,上样液质量浓度为0.3 g/mL 时药液流动性、混合树脂吸附性能较好,并且可避免药液浪费。
表5 上样液质量浓度对总黄酮吸附率的影响(±s,n=3)Tab.5 Effect of sample solution concentration on adsorption rate of total flavonoids (±s,n=3)

表5 上样液质量浓度对总黄酮吸附率的影响(±s,n=3)Tab.5 Effect of sample solution concentration on adsorption rate of total flavonoids (±s,n=3)
上样液质量浓度/(g·mL-1)吸附率/%0.07576.24±0.09 0.1581.64±0.04 0.385.82±0.04 0.687.02±0.07 1.287.97±0.04
2.4.3 上样体积流量 按“2.4.2” 项下方法装柱,取0.3 g/mL 上样液30 mL,分别以1、2、3、4、5 BV/h 体积流量上样,收集流出液,计算总黄酮吸附率,结果见图1。由此可知,体积流量为1、2 BV/h 时该成分吸附率较大,为了节省时间,最终确定为2 BV/h。

图1 上样体积流量对总黄酮吸附率的影响Fig.1 Effect of sample volumetric flow rate on adsorption rate of total flavonoids
2.5 混合树脂解吸研究
2.5.1 杂质洗脱液体积流量 按“2.4.3” 项下方法装柱、上样、收集流出液后,6 BV 蒸馏水分别以3、4、5、6、7、8 BV/h 体积流量除杂,6 BV 55%乙醇以4 BV/h 体积流量洗脱,收集洗脱液,计算总黄酮转移率,公式为转移率=(Z2/Z1) ×100%,其中Z1为上样液中总黄酮含量,Z2为解吸液中总黄酮含量,结果见表6。由此可知,随着洗脱液体积流量增加,流出液颜色逐渐加深浑浊,为了提高解吸后溶液中总黄酮纯度并节约时间,最终确定为5 BV/h。
表6 杂质洗脱液体积流量对总黄酮转移率的影响(±s,n=3)Tab.6 Effect of impurity eluent volumetric flow rate on transfer rate of total flavonoids (±s,n=3)

表6 杂质洗脱液体积流量对总黄酮转移率的影响(±s,n=3)Tab.6 Effect of impurity eluent volumetric flow rate on transfer rate of total flavonoids (±s,n=3)
杂质洗脱液体积流量/(BV·h-1)转移率/%3 87.97±0.08 87.71±0.06 5 87.42±0.06 6 84.27±0.08 7 82.04±0.08 8 81.45±0.09 4
2.5.2 杂质洗脱液用量 按“2.5.1” 项下方法装柱、上样、收集流出液,分别用2、4、6、8、10、12 BV 蒸馏水以5 BV/h 体积流量除杂,6 BV 55%乙醇以4 BV/h 体积流量洗脱,收集洗脱液,计算总黄酮转移率,结果见表7。由此可知,洗脱液用量为8 BV 时流出液几乎无色澄清,表明树脂柱中杂质冲洗较完全。
表7 杂质洗脱液用量对总黄酮转移率的影响(±s,n=3)Tab.7 Effect of impurity eluent consumption on transfer rate of total flavonoids (±s,n=3)

表7 杂质洗脱液用量对总黄酮转移率的影响(±s,n=3)Tab.7 Effect of impurity eluent consumption on transfer rate of total flavonoids (±s,n=3)
杂质洗脱液用量/BV转移率/%2 85.94±0.07 85.48±0.09 6 84.64±0.07 8 84.53±0.09 1083.86±0.09 1283.72±0.09 4
2.5.3 洗脱剂体积分数 按“2.5.1” 项下方法装柱、上样,8 BV 蒸馏水以5 BV/h 体积流量除杂,分别用6 BV 10%、25%、40%、55%、70%、85%乙醇以4 BV/h 体积流量洗脱,收集洗脱液,计算转移率,结果见图2。由此可知,体积分数为70%时转移率显著升高,并且可节约试剂。

图2 洗脱剂体积分数对总黄酮转移率的影响Fig.2 Effect of eluent concentration on transfer rate of total flavonoids
2.5.4 洗脱剂体积流量 按“2.5.3” 项下方法装柱、上样、除杂,6 BV 70% 乙醇分别以1、2、3、4、5、6 BV/h 体积流量洗脱,收集洗脱液,计算转移率,结果见图3。由此可知,体积流量为1、2 BV/h 时转移率较高,为了节约时间,最终选择2 BV/h。

图3 洗脱剂体积流量对总黄酮转移率的影响Fig.3 Effect of eluent volumetric flow rate on transfer rate of total flavonoids
2.5.5 洗脱剂用量 按“2.5.3” 项下方法装柱、上样、除杂,分别用5、6、7、8、9 BV 70%乙醇以2 BV/h 体积流量洗脱,收集洗脱液,计算转移率,结果见表8。由此可知,用量大于4 BV 时转移率升高,而且逐渐平稳,为了节约试剂,最终选择8 BV。
表8 洗脱剂用量对总黄酮转移率的影响(±s,n=3)Tab.8 Effect of eluent consumption on transfer rate of total flavonoids (±s,n=3)
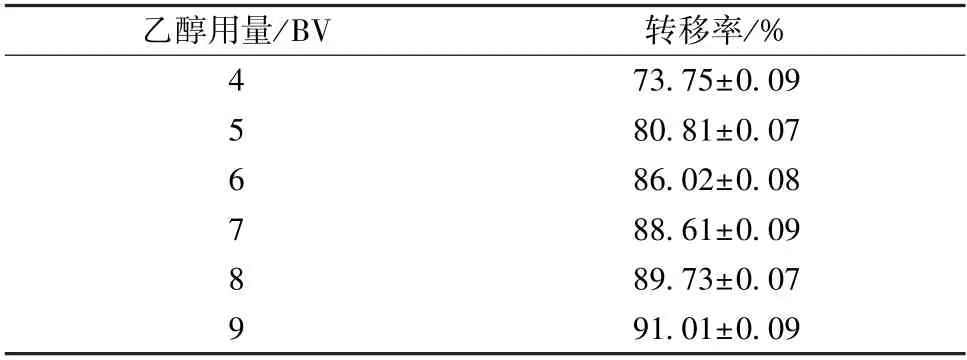
表8 洗脱剂用量对总黄酮转移率的影响(±s,n=3)Tab.8 Effect of eluent consumption on transfer rate of total flavonoids (±s,n=3)
乙醇用量/BV转移率/%4 73.75±0.09 80.81±0.07 6 86.02±0.08 7 88.61±0.09 8 89.73±0.07 9 91.01±0.09 5
2.6 验证试验 称取HPD600 型树脂1.8 g、AB-8型树脂1.2 g,混匀后装柱,30 mL 0.3 g/mL 上样液以2 BV/h 体积流量上样,8 BV 蒸馏水以5 BV/h体积流量除杂,8 BV 70%乙醇以2 BV/h 体积流量洗脱,收集洗脱液,测定总黄酮含量,计算转移率;取3 份纯化前后上样液,每份10 mL,置于干燥至恒重的蒸发皿中,水浴蒸至无液体流动,置于105 ℃烘箱中2 h,冷却干燥,称定质量,计算总黄酮纯度,公式为纯度=(X/Y) ×100%,其中X为纯化前总黄酮含量,Y为样品液烘干后质量,结果见表9。由此可知,纯化后总黄酮纯度显著升高,表明该工艺稳定可靠。
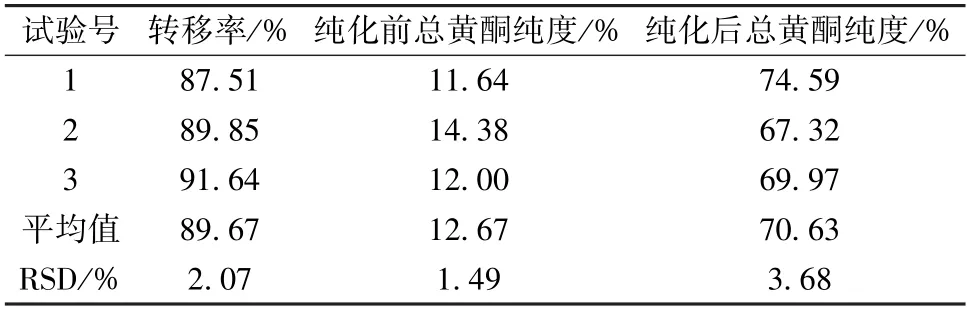
表9 验证试验结果(n=3)Tab.9 Results of verification tests (n=3)
3 讨论
本实验发现,经95%乙醇浸泡并以1 BV/h 体积流量洗脱后,大孔吸附树脂再生处理效果较好;提取物大多残留在柱尾,并且较难洗脱,故可考虑逆向洗脱以再生树脂。
在考察检测波长时发现,芦丁对照品溶液、白子菜醇提液分别在510、507 nm 波长处有最大吸收,可能是由于后者所含成分复杂,造成波长略微蓝移,故选择510 nm 作为检测波长。在考察树脂吸附效果时发现,动态、静态解吸结果有所差异,可能是由于树脂球径不同而导致树脂和药液中物质接触面积、药液流动速度不一。在考察吸附条件时发现,药液酸性增加时变浑浊,有沉淀生成,并且析出的灰黑色物质中可能含有较多黄酮,故本实验不对上样液pH 进行调节。
验证试验发现,白子菜总黄酮转移率达89.67%,纯度由上样前的12.67%增加至70.63%,RSD 均小于5%,表明成本低廉、绿色环保的HPD600、AB-8 型大孔吸附树脂适用于该成分分离纯化,可为其开发利用提供有力支持。

