紫草素对体外模拟糖尿病并发抑郁症环境大鼠海马神经元凋亡的影响
张洪艳,张燕娇,郑静静,卞 睿,顾 鑫,李文慧,任卫东
(1.河北北方学院附属第一医院神经内三科,河北 张家口 075000;2.河北北方学院附属第二医院心血管内科,河北 张家口 075000;3.河北北方学院附属第一医院内分泌科,河北 张家口 075000)
糖尿病并发抑郁症(diabetes mellitus with depression,DD) 是糖尿病患者的一种慢性并发症,发病隐匿且易反复,患者自杀倾向高,其致死率比单纯糖尿病患者高,因此对此进行积极防治具有重大意义[1-2]。DD 的发病机制复杂,高糖能引发炎性因子异常过量表达,诱导强烈的神经炎症,造成神经元损伤,是导致DD 的主要病理机制,抑制糖尿病引发的炎症可明显改善抑郁症状[3-4]。紫草素是中药紫草中含有的一种萘醌类活性成分,具有显著的抗菌消炎、抗氧化、降血糖的作用[5],可以降低炎性细胞因子表达,通过抑制神经炎症减轻缺血引发的神经元损伤,起到脑保护作用[6],由此推测紫草素可能对DD 具有治疗作用。丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK) 是关键的炎症信号分子,调控细胞增殖、凋亡等多种生理行为,在糖尿病引发的神经病理性疼痛和抑郁症的发病过程中起到关键作用,抑制MAPK 信号激活可减弱促炎细胞因子表达,减轻糖尿病引发的大鼠神经病理性疼痛,改善其抑郁样行为[7-8],并可通过抑制神经炎症改善阿尔茨海默病小鼠神经元突触可塑性和认知缺陷[9]。但紫草素是否可通过MAPK 信号改善DD 症状,目前还未见明确报道,本研究通过构建模拟DD 环境体外细胞模型,探讨紫草素对模拟DD 环境大鼠海马神经元凋亡的保护作用。
1 材料
1.1 动物 SD 大鼠,SPF 级,雄性体质量350~380 g,雌性体质量200~240 g,购自湖南安生美药物研究院有限公司[实验动物生产许可证号SCXK (湘) 2020-0014],饲养于本院动物中心屏障环境动物房[实验动物使用许可证号SYXK (冀) 2019-0016],环境相对湿度(51±5)%、温度(24±1)℃、12 h/12 h 光暗循环,适应性饲喂1 周后开始实验。本实验经河北北方学院附属第一医院伦理委员会批准(伦理号LLS2022 第73 号)。
1.2 药物与试剂 紫草素(纯度>98%,批号dasf0508,南京道斯夫生物科技有限公司)。皮质酮(纯度99.63%)、MAPK 激活剂(C16-PAF)、羊抗兔二抗(批号HY-B1618、HY-108635、HY-90126,美国MCE 公司);胶原酶Ⅰ、葡萄糖、噻唑蓝(methyl thiazolyl tetrazolium,MTT) 试剂盒、尼氏染色液、Annexin V-FITC/PI 凋亡检测试剂盒、大鼠白细胞介素-6 (interleukin-6,IL-6)、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α) 酶联免疫吸附 (enzyme linked immunosorbent assay,ELISA) 试剂盒 (批号17100017、G8150、M1020、C0117、CA1020、PI328、PI915,北京索莱宝科技有限公司);大鼠海马神经元细胞完全培养基、BCA 蛋白质定量检测试剂盒(批号CM-R107、C503021,武汉普诺赛生命科技有限公司);胰蛋白酶、RIPA 裂解液[批号A600626-0005、C500005-0050,生工生物工程 (上海) 股份有限公司];大鼠白细胞介素-18 (interleukin-18,IL-18) ELISA 试剂盒、兔源p38 MAPK、磷酸化p38 MAPK(phosphorylated p38 MAPK,p-p38 MAPK)、半胱氨酸天冬氨酸蛋白酶-9 (caspase-9)、B 淋巴细胞瘤-2 相关X 蛋白(Bax)、β-肌动蛋白 (β-actin) 一抗 (批号ab213909、ab8227、ab60179、ab30275、ab10861、ab10263,英 国Abcam 公司)。
1.3 仪器 MR-96A 型酶标仪、DSX100 型光学显微镜、CytoFLEX 型流式细胞仪(北京昊诺斯科技有限公司);1703930 型转印槽、1659001 型电泳仪 (美国Bio-Rad 公司);Bio-Best 型化学发光图像分析系统(上海人和科学仪器有限公司)。
2 方法
2.1 原代培养大鼠胎鼠海马神经元 将雌、雄大鼠以1 ∶2 的比例合笼,交配获得孕鼠,以检查到阴栓为孕1 d,取孕18 d 的孕鼠,吸入异氟醚麻醉后,开腹取出胎鼠,剪下大脑,分离出海马组织,剪碎后加入等体积的胶原酶Ⅰ和胰蛋白酶,混匀后充分消化,以200 目筛过滤后1 000 r/min离心5 min,以大鼠海马神经元细胞完全培养基洗涤细胞沉淀后再次离心,加入完全培养基后,将细胞吹打成单细胞悬浮液,计数并调整细胞密度为3.0×105/mL,接种在培养瓶中无菌培养。
2.2 构建模拟DD 环境细胞模型并筛选紫草素最佳作用浓度 取培养5 d 的大鼠胎鼠海马神经元原代培养细胞,传代接种在96 孔板中;其中6 孔不接种细胞,作为空白组。24 h 后分别以0 (对照组)、0.25、0.5、1、2、4 μmol/L紫草素干预细胞[10],6 h 后以150 mmol/L 葡萄糖及200 μmol/L 皮质酮联合干预细胞,构建体外模拟DD 环境细胞模型[11],18 h 后加入MTT 溶液10 μL 继续培养4 h,去除上清,保留底部紫色结晶,加入Formazan 溶解液110 μL 于摇床上低速振荡,10 min 后采用酶标仪测量各孔在490 nm波长处的吸光值,计算细胞活力。各组均设6 个复孔。
2.3 分组处理及细胞活力检测 将培养5 d 的大鼠胎鼠海马神经元原代培养细胞传代后接种在96 孔板中,随机分为对照组、模型组、紫草素(2 μmol/L) 组、C16-PAF(4 μmol/L) 组[12]、紫草素+C16-PAF(2 μmol/L+4 μmol/L)组,24 h 后以2 μmol/L 紫草素和4 μmol/L C16-PAF 分组干预细胞,6 h 后除对照组外,其他组按“2.2” 项下方法构建体外模拟DD 环境细胞模型,继续培养18 h 后,按“2.2” 项下MTT 法检测各组细胞活力。各组均设6 个复孔。
2.4 细胞损伤情况检测 将培养5 d 的大鼠胎鼠海马神经元原代培养细胞传代后接种在24 孔板,按“2.3” 项下方法分组处理后,去除培养液,以PBS 漂洗细胞后固定,加入尼氏染液进行染色,漂洗后于镜下观察神经元细胞损伤情况。
2.5 细胞凋亡情况检测 将培养5 d 的大鼠胎鼠海马神经元原代培养细胞传代后接种在24 孔板,按“2.3” 项下方法分组处理后,收集各组细胞及其培养液。PBS 重悬细胞,计数后取约含1×106个细胞的细胞悬液,1 000 r/min 离心5 min,洗涤细胞沉淀,依次加入膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC) 10 μL、Binding Buffer 500 μL、碘化丙啶(propidium iodide,PI) 5 μL,混匀后于37.5 ℃避光孵育15 min,1 000 r/min 离心5 min,再次洗涤细胞沉淀,以500 μL PBS 重悬细胞,混匀后上机检测,以流式细胞仪自带的系统分析数据得到细胞凋亡率。各组剩余的细胞悬液1 000 r/min 离心5 min 后保存在液氮中。
2.6 细胞上清液炎性因子TNF-α、IL-6、IL-18 水平检测 取“2.5” 项下收集得到的各组细胞培养液,1 000 r/min离心5 min,采用试剂盒通过ELISA 法检测上清液中炎性因子TNF-α、IL-6、IL-18 水平。
2.7 神经元细胞凋亡相关蛋白及MAPK 信号通路蛋白表达检测 取“2.5” 项下保存在液氮中的各组细胞,加入高效RIPA 裂解液,于冰水浴中裂解2 h,3 000 r/min 离心20 min,采用BCA 试剂盒测定上清液中蛋白总浓度,各组分别取20 μg 总蛋白变性后电泳分离,湿转后采用5%脱脂奶粉溶液封闭蛋白非特异位点,分别以对应兔源p38 MAPK、p-p38 MAPK、caspase-9、Bax、β-actin 一抗(1 ∶1 300) 4 ℃孵育13 h,洗涤后以羊抗兔二抗溶液(1 ∶1 700) 37 ℃孵育1.5 h,洗涤后通过化学发光法显色并拍照,通过Image J 软件定量各蛋白灰度值,计算出各组蛋白条带灰度值与内参β-actin 蛋白条带灰度值的比值。
2.8 统计学分析 通过SPSS 24.0 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,两两之间进一步比较采用SKN-q检验。P<0.05 为差异有统计学意义。
3 结果
3.1 不同浓度紫草素对体外模拟DD 环境大鼠海马神经元细胞活力的影响 不同浓度紫草素可增强体外模拟DD 环境大鼠海马神经元细胞活力,并在一定浓度范围内随浓度升高而作用增强(P<0.05)。当紫草素浓度为2 μmol/L时,进入平台期,其促生长作用会随浓度的继续升高而减小(P<0.05),因此选择2 μmol/L 紫草素进行后续实验,见表1。
表1 不同浓度紫草素对体外模拟DD 环境大鼠海马神经元细胞活力的影响(±s,n=6)
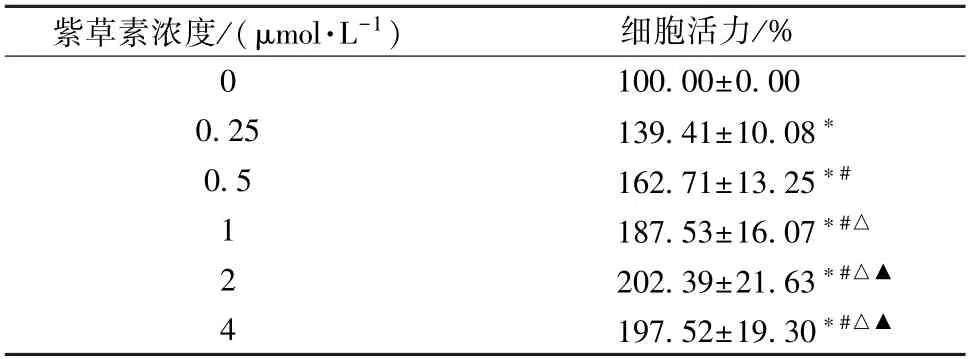
表1 不同浓度紫草素对体外模拟DD 环境大鼠海马神经元细胞活力的影响(±s,n=6)
注:与0 μg/mL 紫草素比较,*P<0.05;与0.25 μg/mL 紫草素比较,# P <0.05;与0.5 μg/mL 紫草素比较,△P <0.05;与1 μg/mL紫草素比较,▲P<0.05。
紫草素浓度/(μmol·L-1)细胞活力/%0 100.00±0.00 0.25139.41±10.08*0.5162.71±13.25*#1 187.53±16.07*#△2 202.39±21.63*#△▲4 197.52±19.30*#△▲
3.2 紫草素对体外模拟DD 环境大鼠海马神经元细胞活力的影响 与对照组比较,模型组细胞活力降低(P<0.05);与模型组比较,紫草素组细胞活力升高(P<0.05),C16-PAF 组细胞活力降低(P<0.05);与紫草素组比较,紫草素+C16-PAF 组细胞活力降低(P<0.05);与C16-PAF 组比较,紫草素+C16-PAF 组细胞活力升高 (P<0.05),见表2。
表2 各组大鼠海马神经元细胞活力比较(±s,n=6)
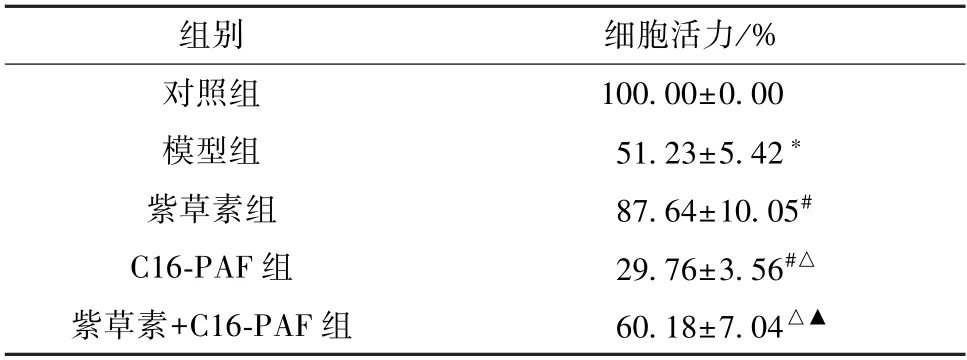
表2 各组大鼠海马神经元细胞活力比较(±s,n=6)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与紫草素组比较,△P<0.05;与C16-PAF 组比较,▲P<0.05。
组别细胞活力/%对照组100.00±0.00模型组51.23±5.42*紫草素组87.64±10.05#C16-PAF 组29.76±3.56#△紫草素+C16-PAF 组60.18±7.04△▲
3.3 紫草素对体外模拟DD 环境大鼠海马神经元细胞损伤的影响 对照组神经元尼氏小体在神经元的树突和胞体中正常分布;与对照组比较,模型组神经元尼氏小体明显减少,甚至消失,细胞呈现明显损伤;与模型组比较,紫草素组神经元尼氏小体有所恢复,神经元损伤均减轻,C16-PAF 组神经元尼氏小体进一步减少,神经元损伤均加重;与紫草素组比较,紫草素+C16-PAF 组神经元尼氏小体进一步减少,神经元损伤均加重,见图1。
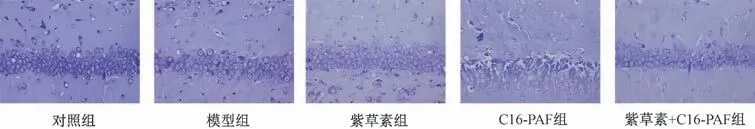
图1 大鼠海马神经元尼氏染色(×200)
3.4 紫草素对体外模拟DD 环境大鼠海马神经元细胞凋亡的影响 与对照组比较,模型组细胞凋亡率升高 (P<0.05);与模型组比较,紫草素组细胞凋亡率降低(P<0.05),C16-PAF 组细胞凋亡率升高(P<0.05);与紫草素组比较,紫草素+C16-PAF 组细胞凋亡率升高(P<0.05);与C16-PAF 组比较,紫草素+C16-PAF 组细胞凋亡率降低(P<0.05),见图2、表3。

图2 各组大鼠海马神经元凋亡情况
表3 各组大鼠海马神经元细胞凋亡率比较(±s,n=6)
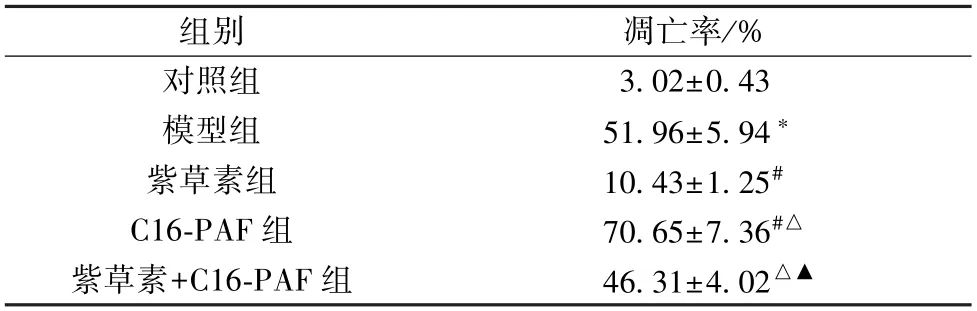
表3 各组大鼠海马神经元细胞凋亡率比较(±s,n=6)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与紫草素组比较,△P<0.05;与C16-PAF 组比较,▲P<0.05。
组别凋亡率/%对照组3.02±0.43模型组51.96±5.94*紫草素组10.43±1.25#C16-PAF 组70.65±7.36#△紫草素+C16-PAF 组46.31±4.02△▲
3.5 紫草素对体外模拟DD 环境大鼠海马神经元细胞TNFα、IL-6、IL-18 水平的影响 与对照组比较,模型组细胞TNF-α、IL-6、IL-18 水平升高(P<0.05);与模型组比较,紫草素组细胞TNF-α、IL-6、IL-18 水平降低(P<0.05),C16-PAF 组细胞TNF-α、IL-6、IL-18 水平升高(P<0.05);与紫草素组比较,紫草素+C16-PAF 组细胞TNF-α、IL-6、IL-18 水平升高(P<0.05);与C16-PAF 组比较,紫草素+C16-PAF 组细胞TNF-α、IL-6、IL-18 水平降低(P<0.05),见表4。
表4 各组大鼠海马神经元细胞TNF-α、IL-6、IL-18 水平比较(ng/mL,±s,n=6)
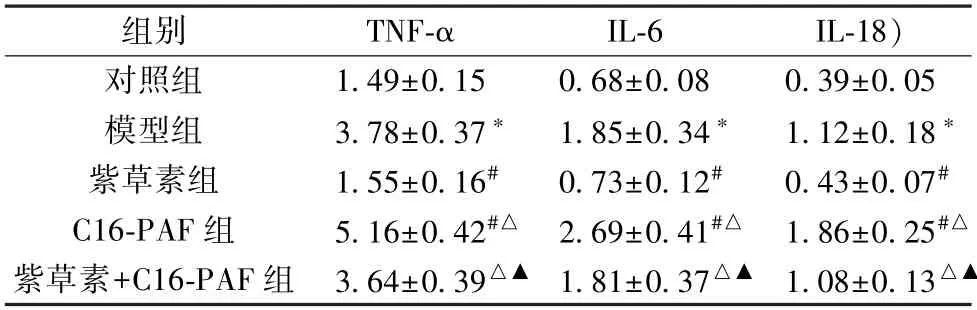
表4 各组大鼠海马神经元细胞TNF-α、IL-6、IL-18 水平比较(ng/mL,±s,n=6)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与紫草素组比较,△P<0.05;与C16-PAF 组比较,▲P<0.05。
组别TNF-αIL-6IL-18)对照组1.49±0.150.68±0.080.39±0.05模型组3.78±0.37*1.85±0.34*1.12±0.18*紫草素组1.55±0.16#0.73±0.12#0.43±0.07#C16-PAF 组5.16±0.42#△ 2.69±0.41#△ 1.86±0.25#△紫草素+C16-PAF 组 3.64±0.39△▲ 1.81±0.37△▲ 1.08±0.13△▲
3.6 紫草素对体外模拟DD 环境大鼠海马神经元细胞凋亡相关蛋白及MAPK 信号通路蛋白表达的影响 与对照组比较,模型组细胞caspase-9、Bax、p-p38 MAPK/p38 MAPK蛋白表达升高(P<0.05);与模型组比较,紫草素组细胞caspase-9、Bax、p-p38 MAPK/p38 MAPK 蛋白表达降低(P<0.05),C16-PAF 组细胞caspase-9、Bax、p-p38 MAPK/p38 MAPK 蛋白表达升高(P<0.05);与紫草素组比较,紫草素+C16-PAF 组细胞caspase-9、Bax、p-p38 MAPK/p38 MAPK 蛋白表达升高(P<0.05);与C16-PAF 组比较,紫草素+C16-PAF 组细胞caspase-9、Bax、p-p38 MAPK/p38 MAPK 蛋白表达降低(P<0.05),见图3、表5。
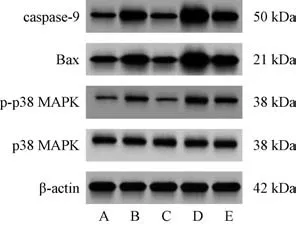
图3 各组大鼠海马神经元细胞凋亡相关蛋白及MAPK 信号通路蛋白印迹图
表5 各组大鼠海马神经元细胞凋亡相关蛋白及MAPK 信号通路蛋白表达比较(±s,n=6)
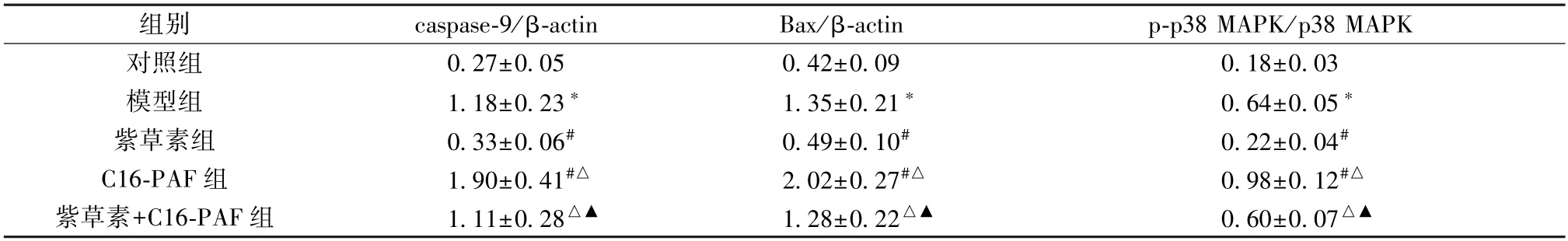
表5 各组大鼠海马神经元细胞凋亡相关蛋白及MAPK 信号通路蛋白表达比较(±s,n=6)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与紫草素组比较,△P<0.05;与C16-PAF 组比较,▲P<0.05。
组别caspase-9/β-actinBax/β-actinp-p38 MAPK/p38 MAPK对照组0.27±0.050.42±0.090.18±0.03模型组1.18±0.23*1.35±0.21*0.64±0.05*紫草素组0.33±0.06#0.49±0.10#0.22±0.04#C16-PAF 组1.90±0.41#△2.02±0.27#△0.98±0.12#△紫草素+C16-PAF 组1.11±0.28△▲1.28±0.22△▲0.60±0.07△▲
4 讨论
近年来,我国糖尿病发病率逐年上升,继发的抑郁症病例数也随之升高,已成为亟需解决的一个社会公共卫生问题[13-14]。本研究以葡萄糖联合皮质酮干预的方法构建模拟DD 环境海马神经元细胞模型,结果显示,体外原代培养的大鼠胎鼠海马神经元以葡萄糖联合皮质酮干预后,炎性细胞因子TNF-α、IL-6、IL-18 大量产生,引发炎症,造成细胞尼氏小体数明显减少,呈现明显损伤,进而诱导细胞凋亡,表明体外模拟DD 环境细胞模型构建成功。
炎症状态加剧可增加糖尿病患者发生抑郁的风险,减弱大脑中炎症和氧化应激可改善糖尿病大鼠抑郁症状,进行抗炎治疗是改善DD 症状的有效手段[15-16]。紫草素是一种有明显抗炎活性的天然化合物,可抑制MAPK 信号活化,拮抗炎症发生发展,改善关节炎、牙髓炎等炎性疾病症状[17-18],并可减轻氧糖剥夺诱导的大鼠原代皮层神经元凋亡[10],因而推测紫草素可能防治DD。本实验以不同浓度紫草素处理体外模拟DD 环境细胞模型,均可增强其细胞活力,当紫草素浓度为2 μmol/L 时进入平台期,故后续实验选择2 μmol/L 紫草素进行。以2 μmol/L 紫草素处理体外模拟DD 环境细胞模型,可降低炎性细胞因子TNF-α、IL-6、IL-18 水平,减弱炎症,减轻细胞损伤,下调凋亡蛋白caspase-9 及Bax 表达,进而抑制凋亡,表明紫草素可通过抗炎作用而改善模拟DD 环境神经元细胞损伤,提升其细胞活力,最终保护细胞免于凋亡,揭示紫草素在DD 的治疗中有很好的应用前景。
MAPK 是一种典型的细胞应激反应元件,参与介导糖尿病相关的牙周炎、焦虑和抑郁等并发症的产生及病情进展,下调p38 MAPK 磷酸化水平可减少活性氧及炎性介质的生成,拮抗炎症的产生及进展[19],改善神经炎症等应激诱导的焦虑和抑郁症状[20]。本实验结果显示,以MAPK 激活剂C16-PAF 处理模拟DD 环境海马神经元细胞模型,可加重神经元细胞炎症损伤,促进其凋亡;而紫草素可降低模拟DD 环境海马神经元细胞中p38 MAPK 的磷酸化水平;以C16-PAF 和紫草素联合处理模拟DD 环境海马神经元细胞,C16-PAF 可减弱紫草素的抗炎活性,拮抗其对模拟DD环境海马神经元细胞凋亡的抑制功效,逆转紫草素对神经元的保护作用,表明MAPK 信号介导紫草素对体外培养的模拟DD 环境海马神经元细胞的保护作用。
综上所述,本实验证实了紫草素可下调MAPK 蛋白磷酸化水平,进而降低炎性细胞因子水平,抵抗炎症反应发生及进展,增强模拟DD 环境海马神经元细胞活力,抑制其凋亡,抑制MAPK 信号激活是紫草素发挥上述药理作用的机制之一。

