补肾活血方调节卵巢储备功能下降大鼠生殖激素水平的实验研究
赵井苓 王娟 萧闵 谢莉 李成银 秦丹梅


〔摘要〕 目的 探討补肾活血方对卵巢储备功能下降(diminished ovarian reserve, DOR)大鼠生殖激素水平及卵巢组织形态的影响。方法 采用Ataya法复制DOR大鼠模型。随机分为6组,每组10只。空白组不予处理;模型组给予蒸馏水;戊酸雌二醇组给予戊酸雌二醇水溶液(90 μg/kg),补肾活血方低、中、高剂量组给予补肾活血方水煎剂(7.875、15.750、31.500 g/kg)。按大鼠体质量1 mL/100 g的容积灌胃,每日1次,共14 d。每天观察并记录各组大鼠一般生理反应。造模结束7 d后,从第8天开始,每日早上9点抓取各组大鼠,行阴道涂片观察。14 d治疗结束后,HE染色光镜下观察卵巢组织的形态,ELISA法检测血清中卵泡刺激素、黄体生成素、雌二醇及抗米勒管激素(anti-Müllerian hormone, AMH)的含量。结果 在增加DOR模型大鼠卵泡计数上,补肾活血方高剂量组优于戊酸雌二醇组(P<0.05),也优于补肾活血方低剂量组(P<0.05);在调节AMH上,补肾活血方高、中剂量组优于戊酸雌二醇组(P<0.05),更优于补肾活血方低剂量组(P<0.01)。结论 补肾活血方可能通过增加DOR模型大鼠卵泡数、提高AMH水平、促进性激素分泌、调节动情周期,进而改善DOR模型大鼠的卵巢储备功能。
〔关键词〕 补肾活血方;卵巢储备功能;卵泡数;动情周期;性激素
〔中图分类号〕R271.9 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.07.010
〔Abstract〕 Objective To explore the effects of Bushen Huoxue Decoction on the levels of reproductive hormones and ovarian tissue morphology in diminished ovarian reserve (DOR) rats. Methods The DOR rat model was established by Ataya method. They were randomly divided into six groups, with 10 rats in each group. Blank group was not treated; model group was given distilled water; estradiol valerate group was given estradiol valerate solution (90 μg/kg); Bushen Huoxue Decoction low, middle and high dose groups were given Bushen Huoxue Decoction (7.875, 15.750, 31.500 g/kg). The rats were fed intragastrically according to the volume of 1 mL/100 g of body weight. The rats were given intragastric administration once a day for 14 days. The general physiological responses of rats were observed and recorded every day. After 7 days of modeling, from day 8, each group of rats was captured at 9 o'clock every morning for vaginal smear observation. After 14 days of treatment, the morphology of ovarian tissue was observed under light microscopy with HE staining, and the content of follicle stimulating hormone, luteinizing hormone, estradiol and anti-Müllerian hormone (AMH) in serum was detected by ELISA. Results In increasing the follicle count of DOR model rats, Bushen Huoxue Decoction high dose group was better than estradiol valerate group (P<0.05), and also better than Bushen Huoxue Decoction low dose group (P<0.05); in the regulation of AMH, the high and medium dose groups of Bushen Huoxue Decoction were better than the estradiol valerate group (P<0.05), and better than the low dose group of Bushen Huoxue Decoction (P<0.01). Conclusion Bushen Huoxue Decoction may increase the number of follicles in DOR model rats, increase the level of AMH, promote the secretion of sex hormones, and regulate the estrous cycle, thereby improving the ovarian reserve of DOR model rats.
〔Keywords〕 Bushen Huoxue Decoction; ovarian reserve function; number of follicles; estrous cycle; sex hormones
卵巢储备功能(ovarian reserve, OR)是指卵巢皮质区卵泡生长、发育、形成卵子、排出卵子以及具有分泌性激素的能力。中医认为卵巢储备功能下降(diminished ovarian reserve, DOR)以肾气亏虚、气滞血瘀等为其主要病因病机,治疗上多以补肾、活血等为原则[1-4]。
本课题组前期开展了补肾活血方的系列临床科研课题[1-2],显示出该方在DOR治疗上的优势,但作用机制尚不清楚。为此,本研究采用Ataya法注射环磷酰胺复制大鼠DOR的模型,观察补肾活血方对大鼠生殖激素水平和卵巢组织形态的影响,探明其作用机制,为临床研究提供科学依据,也为下一步研究有效药物的物质基础奠定基础。
1 材料
1.1 实验动物
SPF级SD雌性大鼠(10周)80只,体质量(200±20) g,购于三峡大学动物实验中心,许可证号:SCXK(鄂)2017-0012,饲养于湖北中医药大学实验动物中心,许可证号:SYXK(鄂)2017-0067。单笼饲养,环境温度(20±2) ℃,相对湿度(60±10)%,通风良好,自然昼夜节律光照,给予足够的水和食物。实验开始前所有大鼠先适应性喂养1周后再进行实验,各项操作均符合动物伦理相关规定。
1.2 药品与试剂
补肾活血方:由炙黄芪15 g,菟丝子20 g,补骨脂15 g,山茱萸10 g,熟地黄10 g,山药20 g,白芍15 g,益母草15 g,当归15 g,丹参10 g,香附10 g,川芎10 g,甘草10 g组成。补肾活血方所有药物由湖北中医药大学黄家湖医院药房提供,根据《医疗机构中药煎药室管理规范》[5]要求煎煮补肾活血方。同法煎煮3份药液,分别将所得药液用旋转蒸发仪进行浓缩,浓缩至相当于原药材0.5、1、2 g/mL,冷却后置于4 ℃冰箱储存备用。
戊酸雌二醇片(法国DELPHARM Lille S.A.S.,批号:492A),以生理盐水配成90 mg/mL,冷却后置于4 ℃冰箱储存备用。
HE染色试剂盒(武汉塞维尔生物科技有限公司,批号:G1001);卵泡刺激素(follicle-stimulatinghormone, FSH)ELISA试剂盒(批号:JYM0597Ra)、黄体生成素(luteinizing hormone, LH)ELISA试剂盒(批号:JYM0623Ra)、雌二醇(estradiol 2, E2)ELISA试剂盒(批号:JYM0608Ra)、抗米勒管激素(anti-Müllerian hormone, AMH)ELISA試剂盒(批号:JYM00083Ra)均购自武汉基因美生物科技有限公司。
1.3 主要实验仪器
离心机(型号:CR21G,日本日立公司);组织脱水机(型号:Excelsior AS,美国赛默飞世尔科技公司);切片机(型号:ZQP-86,上海之信仪器有限公司);电子显微镜(型号:BX60,日本奥林巴斯公司),酶标仪(型号:Multiskan FC,美国Thermo公司)。
2 方法
2.1 动物造模、分组及给药治疗
SD雌性大鼠随机分为正常对照组(空白组)10只、造模组70只。采用Ataya法造模,以90 mg/kg的剂量腹腔注射环磷酰胺生理盐水溶液复制大鼠DOR的模型[6],空白组大鼠同法注射等量的生理盐水,于造模后第2天对各组大鼠进行阴道涂片观察,连续观察5 d,若阴道上皮细胞2个性周期以上仍无动情周期变化或周期延长(>6 d),提示动情周期紊乱,说明造模成功。
最终有68只造模成功,将成功模型大鼠随机选取50只,分为模型组、阳性药物对照组(戊酸雌二醇组),补肾活血方高、中、低剂量组,每组10只。连同空白组10只,编号后进入下一步实验。
给药方式:按大鼠体质量1 mL/100 g的容积灌胃,每日1次,共灌胃14 d。模型组给予相应容积的蒸馏水,戊酸雌二醇组给予相应容积的戊酸雌二醇水溶液(90 mg/kg)。补肾活血方给药剂量根据药物组成,计算总质量为175 g,相当于成人剂量为2.5 g/kg,以200 g左右大鼠为例,换算成大鼠的临床等效剂量为15.75 g/kg,高、中、低剂量组设置分别为2倍、1倍、1/2临床等效剂量,因此,将所制备的受试物浓缩至2、1、0.5 g/mL,进行等体积灌胃,按31.500、15.750、7.875 g/kg的剂量给药。
2.2 指标检测
2.2.1 各组大鼠的一般生理情况比较 每天观察并记录各组大鼠一般生理反应,包括毛发、掉毛情况、精神、活动、饮水量、饮食量、体质量变化情况等。
2.2.2 阴道涂片镜下观察各组大鼠的动情周期 造模结束7 d后,从第8天开始,每日早上9点抓取各组大鼠,行阴道涂片观察。以显微镜观察脱落细胞的变化作为判断大鼠的动情周期的依据。动情周期包括动情前期、动情期、动情后期以及动情间期这4个时期[7],动情前期:大量的有核上皮细胞和少量白细胞;动情期:大量的角质化、大而无规则的无核上皮细胞;动情后期:有核上皮细胞、角质化上皮细胞和白细胞均匀存在;动情间期:大量白细胞和少量角质化上皮细胞,记录大鼠的动情周期变化。计算每组大鼠动情周期率:动情周期率=动物周期正常只数/每组总只数×100%。
2.2.3 HE染色光镜下观察卵巢组织的形态 14 d治疗结束后,用3%戊巴比妥钠溶液以3 mL/kg的剂量麻醉大鼠,腹主动脉取血,分离血清置于-80 ℃冰箱保存待测;之后迅速分离卵巢组织,置于生理盐水冲洗后,置多聚甲醛固定液中浸泡1周。将上述固定后的卵巢组织,经常规石蜡包埋、切片(厚度为0.04 μm)、HE染色后,光镜下观察两个卵巢组织中总卵泡数量,包括卵巢初级卵泡数、成熟卵泡数、总卵泡数。
2.2.4 ELISA法检测血清中FSH、LH、E2及AMH的含量 取上述待测血清,室温复融后,按照ELISA试剂盒步骤操作,检测血清FSH、LH、E2及AMH的含量。
2.3 统计学方法
图片分析采用Image J软件分析,数据结果采用SPSS 20.0软件进行分析,计量数据采用“x±s”表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
3 结果
3.1 各组大鼠的一般生理情况
空白组大鼠毛色光亮、没有出现明显掉毛现象、精神佳、活动可、饮水饮食正常,体质量呈逐渐增长趋势;模型组、补肾活血方低、中、高剂量组及戊酸雌二醇组大鼠初期均出现不同程度的掉毛、精神欠佳、食欲减退、饮水减少等表现,经治疗后一般情况逐渐恢复,其中以补肾活血方中剂量组变化最为明显,更加接近空白组。
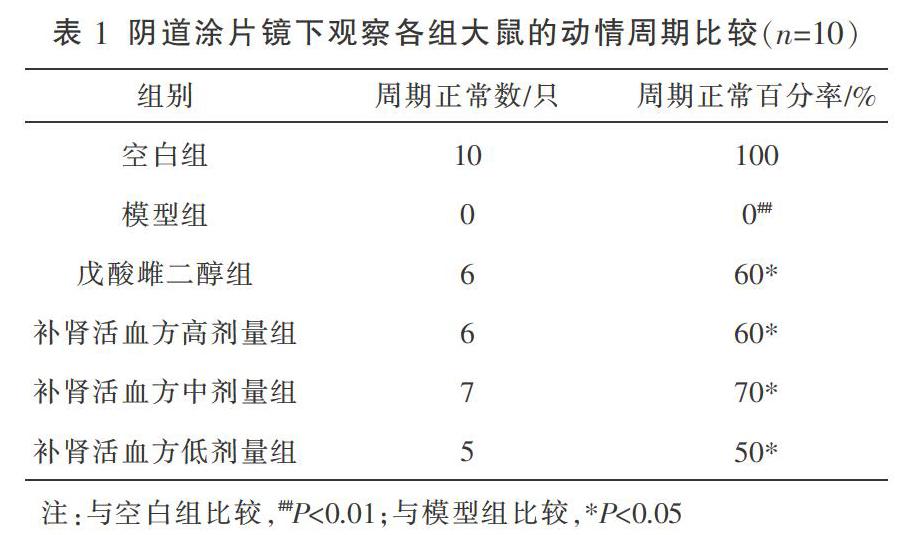
3.2 阴道涂片镜下观察各组大鼠的动情周期
与空白组比较,模型组大鼠动情周期紊乱,差异有显著统计学意义(P<0.01)。与模型组比较,补肾活血方高、中、低剂量组及戊酸雌二醇组均能改善动情周期,差异有统计学意义(P<0.05);补肾活血方低、中、高剂量组与戊酸雌二醇组比较,差异无统计学意义(P>0.05)。见图1、表1。
3.3 HE染色光镜下观察卵巢组织的形态及卵泡计数
HE染色光镜下观察卵巢组织的形态显示:空白组卵巢体积大,可见各级卵泡分布,黄体发育正常,血管丰富;模型组可见卵巢体积缩小,未见黄体,卵泡总数减少,卵泡排列紊乱;补肾活血方高、低剂量组及戊酸雌二醇组可见卵巢略有萎缩,卵泡数略有增多,黄体数量略少,卵母细胞颗粒层数较多,卵泡排列稍有紊乱;补肾活血方中剂量组卵巢体积大小基本正常,各级卵泡数均匀分布,卵母颗粒细胞层次较多。见图2。
与空白组比较,模型组大鼠卵巢组织中原始卵泡数、成熟卵泡数、总卵泡数明显减少,差异有显著统计学意义(P<0.01)。与模型组比较,戊酸雌二醇组、补肾活血方高、中、低剂量组原始卵泡数、成熟卵泡数、总卵泡数增多(P<0.05或P<0.01)。与戊酸雌二醇组比较,补肾活血方高剂量组原始卵泡数、成熟卵泡数、总卵泡数增多(P<0.05)。与补肾活血方高剂量组比较,补肾活血方低剂量组原始卵泡数、成熟卵泡数、总卵泡数较少,差异有统计学意义(P<0.05或P<0.01)。见表2。
3.4 ELISA法检测血清中FSH、LH、E2的含量
与空白组比较,模型组血清FSH、LH含量升高(P<0.01),E2含量降低(P<0.01)。與模型组比较,戊酸雌二醇组、补肾活血方高、中、低剂量组血清FSH、LH含量降低(P<0.05),E2含量升高(P<0.05或P<0.01)。与戊酸雌二醇组比较,补肾活血方高、中、低剂量组在性激素水平上,差异无统计学意义(P>0.05)。见表3。
3.5 ELISA法检测血清中AMH的含量比较
与空白组比较,模型组血清AMH含量降低(P<0.01)。与模型组比较,补肾活血方高、中剂量组及戊酸雌二醇组AMH含量均升高(P<0.01);与补肾活血方低剂量组比较,补肾活血方高、中剂量组AMH含量均升高(P<0.01)。见表4。
4 讨论
DOR是临床上常见的导致女性不孕的原因之一,DOR患者常伴激素水平异常,如FSH、LH升高、E2、AMH下调,这些变化很好地反映了卵巢储备功能,常被用作评估DOR的重要指标[8-9]。FSH以及LH是直接作用卵巢皮层的促性腺激素,间接发挥调节卵巢功能的作用[10]。卵巢功能衰退时,FSH、LH含量升高,卵泡数量和雌激素则会减少,卵泡和卵子的生长发育则会受到遏制[11]。AMH主要由窦前和早期窦状卵泡颗粒细胞表达,并在接下来发育至成熟卵泡或闭锁的阶段逐渐减少,通过抑制颗粒细胞芳香化酶活性、减少LH受体数目等途径调节卵泡生长发育。血AMH水平下降与卵巢储备降低密切相关,低水平AMH 及其在特定时期迅速下降的特征是卵巢储备功能不足的标志[12-13]。本研究采用Ataya法注射环磷酰胺复制大鼠DOR的模型,检测结果显示大鼠血清中FSH、LH水平增高、E2和AMH水平下降、成熟卵泡以及原始卵泡数明显减少,与文献[14-15]研究一致。
中医学认为肾虚血瘀为DOR的最主要病机,其特点为肾虚为本、血瘀为标、本虚标实、虚实夹杂[1-3]。因此,将补肾活血作为治疗DOR的重要治法,贯穿本病发生发展的始终。补肾活血方以炙黄芪、菟丝子补肾为君。臣以熟地黄、山萸肉、山药、补骨脂协助君药补益肝肾,佐以当归、川芎、丹参、白芍、益母草、香附行气活血调经。甘草为使,调和诸药。纵观全方,补肾与活血诸药相配,相辅相成,共奏补肾活血之效。研究[2-3]表明补肾活血方能温肾阳,益肾精,补肾气,养血活血,维持肾-天癸-冲任-胞宫轴稳定,从而达到干预性治疗目的;研究[16]显示补肾活血方可进一步改善患者卵巢组织血液循环、增强卵巢排卵功能,从而改善患者的临床症状,对于肾虚血瘀所致的DOR疗效显著。根据该方的作用机制,补肾活血方可能通过调节肾-天癸-冲任-胞宫轴而改善DOR卵巢储备功能。
本实验研究结果显示,与模型组比较,给予补肾活血方治疗后,大鼠的生理活动基本恢复,紊乱的动情周期得到改善(P<0.01);成熟卵泡数量、总卵泡数量增加,且性激素水平明显改善,如血清FSH、LH含量降低,AMH、E2含量升高(P<0.05或P<0.01)。这些情况的改善与西药戊酸雌二醇疗效相当(P>0.05)。补肾活血方高、中剂量组在调节AMH上优于戊酸雌二醇组(P<0.05),更优于补肾活血方低剂量组(P<0.01)。这也正是我们临床上常见的现象:雌激素在改善患者症状上效果显著,但对增加卵泡数量方面效果有限。通过本研究发现,补肾活血方能够增加DOR模型大鼠卵泡数,改善DOR模型大鼠的激素水平,进而调节动情周期,从而有效改善DOR模型大鼠的卵巢储备功能。
参考文献
[1] 赵井苓,吴献群,李成银.“治未病”思想在治疗肾虚血瘀型卵巢储备功能下降中的运用[J].湖北中医药大学学报,2017,19(2):54-57.
[2] 赵井苓,李成银.吴献群从肾虚血瘀论治卵巢储备功能下降[J].湖北中医药大学学报,2015,17(6):98-100.
[3] 张韞玉,张思敏,刘平安,等.补肾活血方中马钱苷、莫诺苷、芍药苷含量测定及其对免疫性卵巢早衰小鼠的影响[J].湖南中医药大学学报,2020,40(5):540-545.
[4] 宋李丽.补肾活血方对卵巢储备功能低下患者中医症候积分及卵巢功能的影响[J].河南医学研究,2020,29(12):2240-2241.
[5] 黄欣碧,傅 红.中药调剂技术[M].2版.北京:中国医药科技出版社,2017:180-182.
[6] 魏景蕊,袁巾惠,白晶莹,等.评估卵巢储备功能的常用指标对预测卵巢反应性的价值比较[J].生殖医学杂志,2020,29(1):27-32.
[7] 卢 鸽,解子婧,汪 倩,等.针刺对卵巢储备功能减退模型大鼠血清炎性因子及卵巢组织Nrf2/HO-1/NLRP3信号通路的影响[J].中医杂志,2020,61(15):1350-1356.
[8] 徐文君,高 慧,李 杨,等.坤泰胶囊对卵巢早衰大鼠的治疗作用及其机制研究[J].药物评价研究,2017,40(3):314-318.
[9] 陆星星,任豆豆,徐华洲,等.资癸益冲方对卵巢储备功能下降模型大鼠卵巢氧化损伤的影响及其作用机制[J].北京中医药大学学报,2020,43(7):561-568.
[10] ZHANG H H, CHU Y P, ZHOU P, et al. Dehydroepiandrosterone plus climen supplementation shows better effects than dehydroepi?鄄
androsterone alone on infertility patients with diminished ovarian reserve of low-FSH level undergoing in-vitro fertilization cycles: A randomized controlled trial[J]. Reproductive Biology and Endocrinology, 2016, 14: 9.
[11] 杨纪珂,刘雁峰.补肾疏肝法对卵巢储备功能低下大鼠卵巢功能及氧化应激功能影响的研究[J].现代中西医结合杂志,2020,29(8):835-839.
[12] BROER S L, BROEKMANS F J M, LAVEN J S E, et al. Anti-Müllerian hormone: Ovarian reserve testing and its potential clinical implications[J]. Human Reproduction Update, 2014, 20(5): 688-701.
[13] JAMIL Z, FATIMA S S, AHMED K, et al. Anti-Mullerian hormone: Above and beyond conventional ovarian reserve markers[J]. Disease Markers, 2016, 2016: 5246217.
[14] 金 洵,吕 兴,韦艳会,等.不同时间艾灸预处理对卵巢储备功能减退大鼠卵巢功能的影响[J].针刺研究,2019,44(11):817-821.
[15] 卞艳焕,卞艳丽,卫爱武.滋肾养心补血汤对卵巢储备功能低下模型大鼠性激素及排卵功能的影响[J].中医学报,2019,34(3):559-563.
[16] 万凌屹,丁彩飞,俞 佳.补肾活血方治疗肾虚血瘀型卵巢储备功能下降临床观察[J].中华中医药学刊,2018,36(2):432-434.

