八宝丹通过AKT与ERK信号通路抑制乳腺癌4T1细胞增殖
蓝兆 何嘉 陈进晓 沃达 马恩 彭军 朱伟东 任丹妮


〔摘要〕 目的 探讨八宝丹(Babao Dan, BBD)通过AKT与ERK信号通路对小鼠乳腺癌(4T1)细胞增殖的影响。方法 CCK8法检测不同浓度(0.25、0.5、0.75 mg/mL) BBD干预不同时间点(24、48、72 h)的4T1细胞活力;镜下观察无血清对照组、血清组、BBD低剂量组(0.5 mg/mL)、BBD高剂量组(0.75 mg/mL)中4T1细胞的增殖变化;Western blot法检测10%胎牛血清(FBS)刺激不同时间点(0、5、15、30、60、120 min)后4T1细胞中p-AKT、p-ERK的蛋白表达水平,以确认信号通路激活的最佳时间。与此同时,将4T1细胞随机分为6组:对照组、模型组、BBD低剂量组、BBD高剂量组、U0126组(10 μmol/L)和LY294002组(20 μmol/L),采用Western blot法检测p-AKT、p-ERK的蛋白表达水平;最后将对数增长期的4T1细胞随机分为对照组、BBD组、U0126组(ERK信号通路抑制剂)、LY294002组(AKT信号通路抑制剂)、BBD+U0126组、BBD+LY294002组、U0126+LY294002、BBD+U0126+LY294002组8组,通过台盼蓝染色法检测以上各组干预24、48、72 h后对4T1细胞增殖的影响。结果 CCK8法结果表明,与对照组相比,不同浓度BBD干预24、48、72 h后细胞活力均显著下降,差异具有统计学意义(P<0.001)。镜下观察可见,与无血清对照组相比,血清组细胞形态饱满且生长迅速;与血清组相比,BBD低剂量组以及BBD高剂量组细胞生长缓慢。Western blot结果显示,与0 min比较,10% FBS干预5 min时p-ERK蛋白表达显著升高(P<0.05),同时30 min p-AKT蛋白表达明显上调并且均达到峰值(P<0.05)。与对照组相比,模型组p-ERK、p-AKT蛋白表达均显著上调(P<0.05);与模型组相比,BBD低劑量组、BBD高剂量组p-ERK、p-AKT蛋白表达均显著下调(P<0.05),与U0126组和LY294002组抑制效果相当。台盼蓝染色法结果可见,与对照组相比,BBD组、U0126组以及LY294002组均可显著抑制4T1细胞增殖(P<0.001),其中BBD+U0126+LY294002组与U0126+LY294002组抑制效果相似,均可发挥显著增殖抑制作用(P<0.001),且24、48、72 h结果一致。结论 BBD可显著抑制4T1细胞增殖,其机制可能与抑制AKT与ERK信号通路表达有关。
〔关键词〕 八宝丹;乳腺癌;细胞增殖;ERK;AKT;磷酸化
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.07.009
〔Abstract〕 Objective To investigate the effect of Babao Dan (BBD) on the proliferation of mouse breast cancer 4T1 cells through AKT and ERK signaling pathways. Methods CCK8 assay was used to detect the 4T1 cells viability treated with different concentrations BBD (0, 0.25, 0.5, 0.75 mg/mL) in different time points (24, 48, 72 hours); the proliferation of 4T1 cells in serum-free control group, serum group, low-dose BBD group (0.5 mg/mL) and high-dose BBD group (0.75 mg/mL) were observed under microscope. Western blot was used to detect the activation of AKT and ERK signaling pathways in 4T1 cells treated with fetal bovine serum at different time points (0, 5, 15, 30, 60, 120 minutes) to confirm the optimal time to activate the signaling pathway. In addition, the cells were divided into 6 groups: control group, model group, BBD low-dose group, BBD high-dose group, U0126 group (10 μmol/L), LY294002 group (20 μmol/L), Western blot was used to detect the protein expression of p-AKT, AKT, p-ERK and ERK. Finally, 4T1 cells in logarithmic growth phase were randomly divided into control group, BBD group, U0126 group (ERK signaling pathway inhibitor), LY294002 group (AKT signaling pathway inhibitor), BBD + U0126 group, BBD + LY294002 group, U0126 + LY294002 group, BBD + U0126 + LY294002 group, the effects of the above groups on the proliferation of 4T1 cells after 24, 48 and 72 hours of intervention were detected by trypan blue staining. Results CCK8 assay showed that compared with control group, the cell viability was significantly reduced treatment with different concentrations of BBD for 24, 48, 72 hours, the differences were statistically significant (P<0.001); microscopic observation showed that compared with the serum-free control group, the cells in the serum group were full in shape and grew rapidly, compared with the serum group, the cells in the BBD low-dose group and the BBD high-dose group grew slowly. Western blot showed that, compared with 0 minute, the protein expression of p-ERK was significantly increased at 5 minutes treated with 10% fetal bovine serum (P<0.05), and the protein expression of p-AKT was significantly increased and reached the peak value at 30 minutes simultaneously (P<0.05); compared with model group, the protein expression of p-ERK and p-AKT was significantly decreased in BBD low-dose group and BBD high-dose group (P<0.05), which was equivalent to U0126 group and LY294002 group. Trypan blue staining showed that compared with the control group, BBD group, U0126 group and LY294002 group could significantly inhibit the proliferation of 4T1 cells (P<0.001), and BBD+U0126+ LY294002 group and U0126+ LY294002 group had similar inhibitory effect, and they could play a significant inhibitory effect on proliferation (P<0.001), the results were consistent at 24, 48 and 72 hours. Conclusion BBD can inhibit the proliferation of mouse breast cancer cells 4T1, its mechanism may be related to the inhibition of the expression of AKT and ERK signaling pathways.
〔Keywords〕 Babao Dan; breast cancer; cell proliferation; ERK; AKT; phosphorylation
乳腺癌是世界上最常见的女性高发癌症,疾病呈现快速增长趋势,多趋于年轻化[1],发病率在全球范围逐步攀升,晚期乳腺癌致死率高[2]。恶性肿瘤是在多种病理因素作用之下产生的,主要表现为细胞异常增殖[3],其中,AKT信号通路是人类癌症最常见的信号通路之一,调控着细胞异常增殖以及肿瘤发生发展的关键环节[4]。在PI3K信号通路中,AKT的磷酸化过程发生在通路上游,能够活化下游诸多分子,促进乳腺癌的发生发展[5]。此外,ERK 1/2是丝裂原活化蛋白激酶超家族成员,主要介导细胞增殖与分裂,在癌症研究中已成为重要的干预靶点[6-7],过往研究[8-10]表明,在乳腺癌发展过程中,抑制ERK的磷酸化可以有效地抑制乳腺癌的增殖和转移,而且AKT与ERK信号通路在调控肿瘤细胞增殖和转移方面具有协同作用。中医学辨证论治恶性肿瘤历史悠久,有着至关重要的地位,八宝丹作为清热解毒、活血止痛的典型传统中药名方,已被证实在治疗胰腺癌、非小细胞肺癌等恶性肿瘤疾病中均能发挥良好疗效[11-12]。乳腺癌发病机制复杂,并且八宝丹针对抑制乳腺癌细胞增殖的机制研究尚无报道,故本实验拟通过体外细胞实验从AKT与ERK信号通路探讨八宝丹抑制乳腺癌细胞增殖的作用機制,以此提供理论基础与实验支持。
1 材料与方法
1.1 主要试剂
DMEM高糖培养基(批号:SH30022.01)、0.25%胰蛋白酶(Trypsin)(批号:25200072)、胎牛血清(批号:10091148)均购自美国Gibco公司;青霉素和链霉素混合液(批号:SV30010)、磷酸盐缓冲液(PBS)(批号:SH30256.01B)均购自美国Hyclone公司;八宝丹(厦门中药厂股份有限公司,生产批号:190530);ERK1/2(批号:4695S)、Phospho-p44/42 MAPK(ERK1/20)(批号:4370S)、AKT(批号:4691S)均购自美国 Cell Signaling Technology公司;Phspho-AKT抗体(批号:66444-1-Ig)、GAPDH抗体(批号:60004-1-Ig)均购自武汉三鹰生物技术有限公司;SDS-PAGE蛋白上样缓冲液(5×)(批号:P0286-15 ml)、NP-40裂解液(批号:P0013F)、BCA蛋白定量试剂盒(批号:P0011)、CCK8试剂盒(批号:C0038)均购自上海碧云天生物技术有限公司;PVDF膜(批号:ISEQ00010)、ECL化学发光试剂盒(批号:WBKLS0500)均购自美国Millipore公司;蛋白酶抑制剂(批号:HY-K0010)、磷酸酶抑制剂(批号:HY-K0021)均购自美国MCE公司;二甲基亚砜(DMSO)(批号 A100231-0500)、台盼蓝(批号 C0040-50)均购自北京索莱宝科技有限公司。
1.2 仪器
CO2培养箱(美国Thermo Fisher公司,型号:3111);超净工作台(苏州净化设备公司,型号:SW-CJ-1C);80 ℃超低温冰箱(德国Eppendorf公司,型号:F570);光学倒置显微镜(德国Leica仪器有限公司,型号:DM IL LED);Count Star BioMed全自动细胞计数仪(美国Life公司,型号:IC1000);酶标仪(德国Tecan公司,型号:Infinite M 200);小型垂直电泳槽(型号:1658001)、小型转印转膜仪(型号:1703930)、超高灵敏化学发光成像仪器(型号:170-8265)均购自美国伯乐公司。
1.3 细胞株
小鼠乳腺癌细胞4T1(来源于Dr. FR Miller实验室)培养于10%胎牛血清和含1%双抗(青霉素、链霉素各100 U/mL)的DMEM高糖培养基中,在37 ℃、5% CO2细胞培养箱中培养。
1.4 八宝丹溶液的制备
八宝丹充分溶解于PBS配制成25 mg/mL的药液,使用超声仪器助溶1 h,高压灭菌待药液彻底混匀后,将药液分装于-20 ℃冰箱储存备用。
1.5 CCK8法检测细胞活力
取对数生长期的4T1细胞以1×104个/mL细胞密度接种于96孔板中,每孔细胞悬液为100 μL,不同药物浓度均设置6个实验复孔,待次日细胞贴壁后分别使用浓度0.25、0.5、0.75 mg/mL的BBD药液进行干预,在药物干预24、48、72 h后加入CCK8试剂,并于波长为450 nm处检测吸光度(A值)。
细胞活力=不同BBD浓度组A值/对照组A值×100%
1.6 细胞形态观察
4T1细胞按照2×105个/mL密度接种于35 mm细胞培养皿中,待次日细胞贴壁后,将细胞随机分为无血清对照组、血清组、BBD低剂量组、BBD高剂量组,共4个组。无血清对照组细胞无血清培养24 h,其余三组均有血清培养24 h后,其中BBD低剂量组加入0.5 mg/mL的BBD,BBD高剂量组则加入0.75 mg/mL的BBD培养24 h,用倒置显微镜观察细胞形态并采集图像。
1.7 Western blot法检测10%胎牛血清(FBS)、BBD、U0126以及LY294002对4T1细胞中p-AKT、p-ERK蛋白表达的影响
按照“1.6”项方法接种细胞后,采用10% FBS干预不同时间点(0、5、15、30、60、120 min)4T1细胞中p-AKT、p-ERK蛋白表达,以此确认信号通路激活时间点,根据时间点进行后续造模实验。随后,另外设置对照组、模型组、BBD低剂量组(0.5 mg/mL)、BBD高剂量组(0.75 mg/mL)、U0126(ERK信号通路抑制剂;使用浓度:10 μmol/L)、LY294002组(AKT信号通路抑制剂;使用浓度:20 μmol/L),当细胞培养密度达60%左右时,各组细胞均饥饿24 h,随后使用BBD、U0126、LY294002分别干预24 h后,根据胎牛血清激活信号通路的具体时间点刺激,干预结束后统一收集细胞,使用NP40裂解液提取细胞总蛋白,BCA定量法测定蛋白浓度,在各组蛋白样本均加入1/4体积的SDS-PAGE蛋白上样缓冲液(5×),在100 ℃金属浴中变性10 min后,采用SDS-PAGE电泳法进行凝胶电泳,电泳结束后将凝胶上蛋白转移至0.22 μm PVDF膜上,然后用5%脱脂奶粉封闭2 h后剪裁对应分子量的蛋白指标,对应孵育一抗p-AKT(1∶1 000)、AKT(1∶1 000)、p-ERK(1∶1 000)、ERK(1∶1 000)和GAPDH(1∶5 000)均放置于4 ℃冷库摇床孵育过夜,最后采用辣根过氧化物酶标记的二抗(1∶5 000)室温下孵育1 h后,进行蛋白显影成像分析。
1.8 台盼蓝染色法检测细胞增殖能力
按照“1.6”项方法接种细胞后,将4T1细胞随机分为对照组(未加入BBD,但加入等体积的PBS)、BBD组(仅加入0.5 mg/mL BBD药液)、U0126组(仅加入10 μmol/L U0126通路抑制剂)、LY294002组(仅加入20 μmol/L LY294002通路抑制剂)、BBD+U0126组(同时加入0.5 mg/mL BBD以及10 μmol/L U0126通路抑制剂)、BBD+LY294002组(同时加入0.5 mg/mL BBD以及20 μmol/L LY294002通路抑制剂)、U0126+LY294002组(同时加入10 μmol/L U0126通路抑制剂以及20 μmol/L LY294002通路抑制剂)、BBD+U0126+LY294002组(同时加入0.5 mg/mL BBD、10 μmol/L U0126通路抑制剂以及20 μmol/L LY294002通路抑制剂),通过镜下拍照观察并记录细胞生长与形态变化,随后使用胰酶消化细胞,收集不同组别细胞,加入完全培养基终止消化,重悬并混匀细胞,与0.2 %台盼蓝按照1∶1比例混合打匀后加入计数板孔中,操作全自动细胞计数仪计算活细胞总数。
1.9 统计学分析
采用SPSS 22.0 软件进行统计分析,对各组实验数据满足正态分布以及方差齐性时,采用单因素方差分析及LSD检验;不满足正态分布及方差齐性时采用秩和检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 BBD对4T1细胞活力的影响
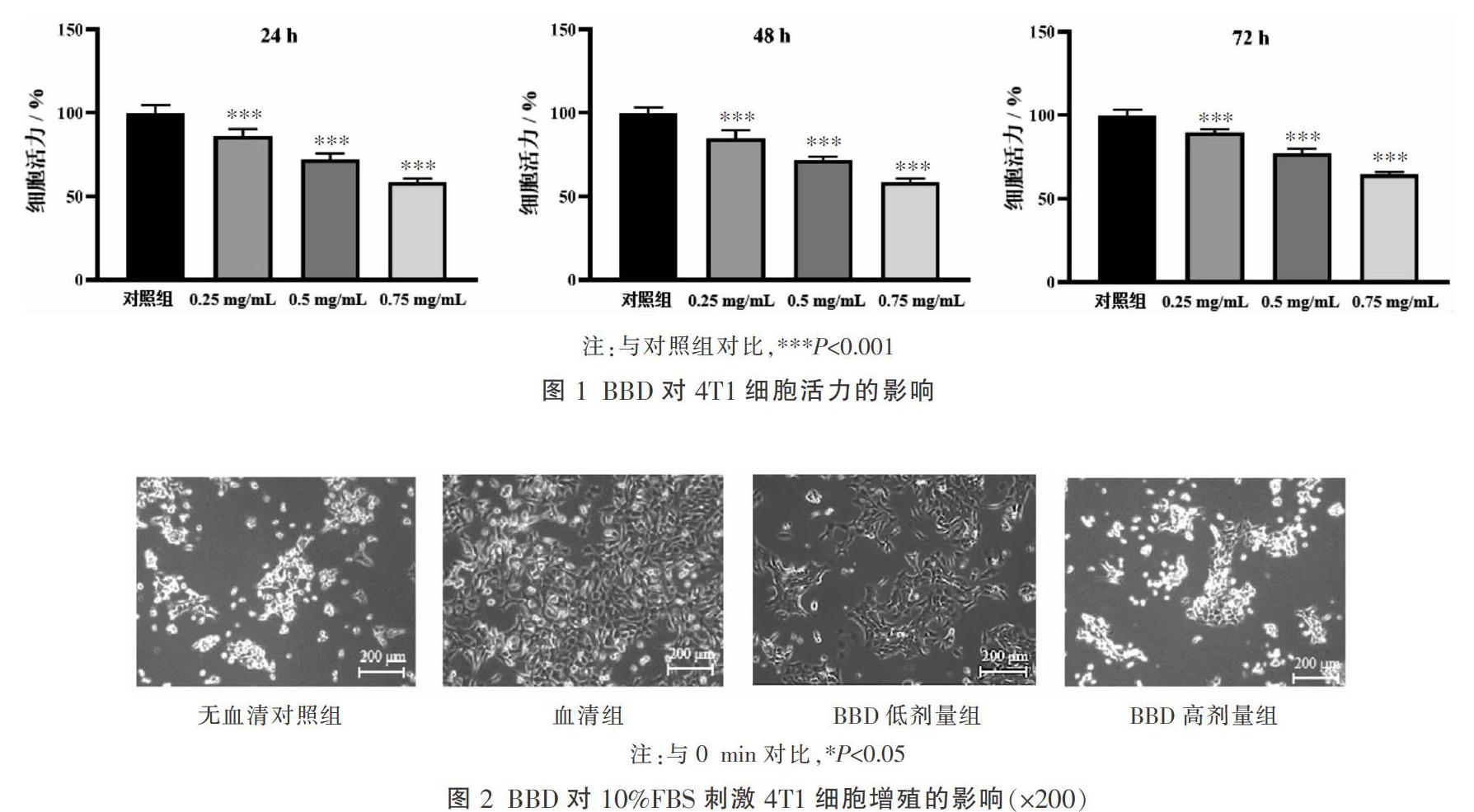
与对照组比较,不同浓度(0.25、0.5、0.75 mg/mL)的BBD干预24、48、72 h均能显著抑制4T1细胞活力(P<0.001),差异有统计学意义。见图1。
2.2 BBD对10% FBS刺激4T1细胞增殖的影响
倒置显微镜下观察可见,与无血清对照组相比,血清组细胞生长迅速;与血清组相比,BBD低剂量组以及 BBD高剂量组细胞生长缓慢。见图2。
2.3 10% FBS对4T1细胞中p-AKT、p-ERK蛋白表达的影响
Western blot结果显示,10% FBS干预5 min以及30 min均可显著上调4T1细胞ERK和AKT磷酸化蛋白表达,且磷酸化蛋白表达均达到峰值,差异有统计学意义(P<0.05)。见图3。
2.4 BBD、U0126以及LY294002对4T1细胞中p-AKT、p-ERK蛋白表达的影响
与对照组对比,模型组p-ERK和p-AKT可见显著上调,差异有统计学意义(P<0.05);然而BBD低剂量、BBD高剂量组p-AKT、p-ERK蛋白表达均可见明显下调,差异有统计学意义(P<0.05),与U0126组以及LY294002抑制效果相当。见图4。
2.5 BBD与U0126、LY294002对4T1细胞增殖的影响
与对照组比较,BBD组、U0126组以及LY294002组均可显著抑制4T1细胞增殖,差异有统计学意义(P<0.001),并且BBD+U0126+LY294002组与U0126+LY294002组抑制效果相似,均可发挥显著增殖抑制作用,差异有统计学意义(P<0.001),且24、48、72 h结果一致。见图5-7。
3 讨论
乳腺癌是女性最常见的恶性肿瘤之一,现代医学主要治疗手段为手术治疗、内分泌治疗、放化疗等,临床表现多为乳痛伴有肿块,乳头凹陷呈“橘皮样变”,并可见溢血等[13]。中医学中乳腺癌的病名为“乳岩”,从脏腑经络学说辨证角度认识到情志因素为重要发病诱因,肝郁气滞、气郁痰结、经络不通为主要病机[14],针对乳岩病因病机特点,宜多采用疏肝解郁、驱邪抗癌、注重调补肝脾的治疗原则[15]。现代研究[16]表明,中药及其成分在抑制乳腺癌的生长增殖、抑制癌细胞迁移等方面发挥抗癌优势,从而降低肿瘤复发与转移发生。本研究通过CCK8法结果证实,BBD能够显著抑制小鼠乳腺癌细胞4T1的生长,且在24、48、72 h不同时间点的抑制效果确切。
八宝丹作为我国保密传统名药复方,主要成分有天然牛黄、蛇胆、羚羊角、珍珠、三七和天然麝香等,由于中药复方存在多靶点的特点,具体疗效是在多个活性成分交互作用之下产生,而非单一成份发挥作用。八宝丹中主要成分麝香辛温走窜,能活血化瘀、消肿止痛,研究[17]表明麝香酮可阻止新生血管形成从而抑制肿瘤增殖与转移;羚羊角性寒味咸,具有凉血解毒、解热镇静作用,现代药理研究[18]证实,其可改善癌性发热和发挥抗炎作用;三七具有活血化瘀、通脉活络之功,三七皂苷作为中药三七有效成分,已有研究[19]证实三七皂苷能显著抑制乳腺癌细胞增殖、改善肿瘤微环境、提高机体免疫力,从而有效防治乳腺肿瘤疾病;牛黄多主清热解毒、活血散结,现代医学认为牛黄具有良好的抗炎、抗氧化、抗肿瘤等作用,多运用于乳癌、疮痈肿毒等症[20],研究[21]发现牛黄对多种肿瘤均存在治疗作用,经典复方西黄丸实验中发现,伴随着药物用量增多,调节性T细胞数量降低,可显著抑制乳腺癌小鼠细胞增殖生长。诸药合用共奏清利湿热、活血解毒之功,驱邪扶正,调整阴阳,对恶性肿瘤疾病有良好治疗效果,诸多研究[22-24]结果表明,八宝丹不仅能有效抑制肿瘤细胞增殖迁移,而且能辅助提升化疗药物的敏感性,进一步佐证八宝丹防治恶性肿瘤的疗效优势。
肿瘤的发生发展过程中的生长代谢需要提供大量营养物质,其中生长因子对肿瘤细胞增殖的意义尤其重要,胎牛血清中富含多种生长因子,包括蛋白质、多肽以及激素等成分,其中发挥作用的蛋白质为白蛋白与球蛋白,多肽被认为可能是血清中促细胞增殖的重要因子,具有促进上皮细胞以及成纤维细胞增殖的作用,而激素可以促使细胞大量摄取葡萄糖以及氨基酸,进而实现细胞黏附以及分裂增殖作用[25]。故此我们通过Western blot法证实,FBS能诱导ERK以及AKT的磷酸化,分别于5 min 和30 min激活AKT和ERK信号通路并达到峰值,从而提示信号转导通路的异常改变在乳腺癌发生发展中也有着重要意义。其中AKT通路通过活化下游诸多分子,可促进乳腺癌疾病的发生发展[26],而且抑制AKT磷酸化过程能够对阻断信号转导、抑制细胞增殖发挥关键作用,研究[27]发现,乳腺癌中检测到Ser473磷酸化的AKT以及基因扩增与过表达。AKT作為通路核心蛋白,活化的AKT发生磷酸化激活多种下游底物,这一过程在肿瘤发展和细胞恶变中起着重要作用[28],已有实验[29]证实固本抑瘤II号方可通过抑制PI3K/AKT/mTOR信号通路促进凋亡与自噬,从而抑制乳腺癌细胞的生长与增殖。而针对ERK通路的研究,多聚焦于参与调控肿瘤细胞增殖当中[30],ERK1/2多以非活性形式存在于胞质当中,受到理化因素刺激后磷酸化被活化转位进入胞核,参与细胞生长发育与分裂等过程,也在细胞增殖、恶性转化一系列病理变化过程中发挥重要作用[31]。乳腺癌细胞增殖与ERK1/2有着密切的关系[32],细胞外信号调节激酶一旦被激活,可以磷酸化一系列的胞质蛋白,激活转录因子启动细胞增殖,在乳腺癌等多种癌组织中,ERK1/2的激活可促进肿瘤细胞增殖[33]。相关研究[34]发现全反式维甲酸处理乳腺癌细胞系SKBR-3后,ERK磷酸化水平降低,导致细胞周期阻滞于G0/G1期,从而抑制乳腺癌细胞生长。为了进一步研究BBD通过AKT和ERK信号通路对小鼠乳腺癌细胞4T1增殖的影响,我们通过台盼蓝染色法以及Western blot法证实,BBD能通过抑制AKT和ERK信号通路的激活,从而抑制小鼠乳腺癌细胞4T1增殖。
AKT与ERK信号通路均參与细胞增殖与蛋白质合成,在不同肿瘤疾病中极其活跃,影响下游细胞周期调节蛋白等效应分子活性,在癌症发生发展中发挥重要意义[35-36]。研究[37-40]证明,在乳腺癌的治疗中,两条途径的双重抑制效果显著优于一条途径的疗效,因此,有效抑制AKT以及ERK信号通路转导从而抑制乳腺癌细胞增殖对于中医药防治乳腺癌具有研究意义,本实验从AKT与ERK信号通路阐述八宝丹抑制乳腺癌细胞增殖的内在机制,为临床辅助治疗乳腺癌提供实验基础与理论依据。由于乳腺癌具有一个多阶段、多步骤的发病过程,近年来运用通路分子抑制剂以及中医药辅助治疗成为热点,所以仍需要从多层面深入认识发病分子机制,为防治乳腺恶性肿瘤提供新的治疗思路与新出路。
参考文献
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics[J]. CA: a cancer journal for clinicians. 2020, 70(1): 7-30.
[2] MATTIUZZI C, LIPPI G. Cancer statistics: A comparison between World Health Organization (WHO) and global burden of disease (GBD)[J]. European Journal of Public Health, 2020, 30(5): 1026-1027.
[3] 隆 霜,沈 宜,谢莹珊,等.乳腺癌MDA-MB-231细胞源Exosomes对内皮细胞增殖的影响及MAPK/ERK和PI3K/Akt信号通路的作用[J].解放军医学杂志,2012,37(11):1054-1058.
[4] DAVIES B R, GREENWOOD H, DUDLEY P, et al. Preclinical pharmacology of AZD5363, an inhibitor of AKT: pharmacodynamics, antitumor activity, and correlation of monotherapy activity with genetic background[J]. Molecular cancer therapeutics. 2012, 11(4): 873-887.
[5] CIRUELOS GIL E M. Targeting the PI3K/AKT/mTOR pathway in estrogen receptor-positive breast cancer[J]. Cancer Treatment Reviews, 2014, 40(7): 862-871.
[6] TIWARI A, IIDA M, KOSNOPFEL C, et al. Blocking Y-Box Binding Protein-1 through Simultaneous Targeting of PI3K and MAPK in Triple Negative Breast Cancers[J]. Cancers, 2020, 12(10): 2795.
[7] HANYU X, LANYUE L, MIAO D, et al. Effect of Ganoderma applanatum polysaccharides on MAPK/ERK pathway affecting autophagy in breast cancer MCF-7 cells[J]. International Journal of Biological Macromolecules, 2020, 146: 353-362.
[8] FRUMAN D A, ROMMEL C. PI3K and cancer: Lessons, challenges and opportunities[J]. Nature Reviews Drug Discovery, 2014, 13(2): 140-156.
[9] JANKU F, YAP T A, MERIC-BERNSTAM F. Targeting the PI3K pathway in cancer: Are we making headway?[J]. Nature Reviews Clinical Oncology, 2018, 15(5): 273-291.
[10] KITAGAWA M, LIAO P J, LEE K H, et al. Dual blockade of the lipid kinase PIP4Ks and mitotic pathways leads to cancer-selective lethality[J]. Nature Communications. 2017, 8(1): 2200.
[11] SONG L B, GAO S, ZHANG A Q, et al. Babaodan Capsule (八宝丹胶囊) combined with Qingyi Huaji Formula (清胰化积方) in advanced pancreatic cancer-a feasibility study[J]. Chinese Journal of Integrative Medicine, 2017, 23(12): 937-942.
[12] WANG Q, LIU Z, DU K, et al. Babaodan inhibits cell growth by inducing autophagy through the PI3K/AKT/mTOR pathway and enhances antitumor effects of cisplatin in NSCLC cells[J]. American journal of translational research, 2019, 11(8): 5272-5283.
[13] 谢 霞.乳腺癌的臨床表现及早期筛查方法[J].临床医药文献电子杂志,2015,2(21):4347-4348.
[14] 郭艳静,刘丽芳.中医中药治疗乳腺癌临床研究进展[J].中华中医药学刊,2012,30(8):1774-1777.
[15] 杨秋莉,王学芬,张向农.古代中医对乳腺癌的认识[J].中国中医基础医学杂志,2010,16(5):437-439.
[16] KANG JX, LIU J, WANG J, et al. The extract of huanglian, a medicinal herb, induces cell growth arrest and apoptosis by upregulation of interferon-beta and TNF-alpha in human breast cancer cells[J]. Carcinogenesis, 2005, 26(11): 1934-1939.
[17] 刘永惠,常 靖,薛陆军,等.麝香酮对血瘀证乳腺癌生长及对VEGF表达的影响[J].西安交通大学学报(医学版),2014,35(4):547-550.
[18] 李伟林,林希伦,戴仁舜,等.联用羚羊角和抗生素治疗癌症化疗患者高热的临床观察[J].中西医结合实用临床急救,1996,3(11):487-488.
[19] 杨 松,洪勇.三七总皂苷与乳腺癌治疗[J].现代肿瘤医学,2018,26(9):1454-1457.
[20] 刘成德,刘 洋,旺建伟.牛黄的药理作用及临床应用概况[J].中医药信息,2006,23(6):14-15.
[21] 苏 亮.西黄丸调节MEKK1/SEK1/JNK1/AP-1通路减少4T1乳腺癌荷瘤小鼠肿瘤微环境Treg细胞数量的抗肿瘤作用研究[D].大连:大连大学,2018.
[22] 周 忠,王和鸣.八宝丹诱导骨肉瘤细胞U-2OS凋亡及其机制的研究[J].中国中医骨伤科杂志,2007,15(5):32-34.
[23] 成 瑜,李洪伦.八宝丹处理肺腺癌细胞A549和SPCA-1对顺铂化疗敏感性的影响[J].滨州医学院学报,2016,39(6):414-417.
[24] 吴 皓,李 鸿,祁 鑫,等.八宝丹对结肠癌荷瘤小鼠的血、脾和骨髓中的髓系抑制性细胞的影响[J].中华中医药杂志,2014,29(2):568-570.
[25] 司徒镇强,吴军正.细胞培养[M].4版.西安:兴界图书出版西安公司出版发行,2001:44.
[26] 韦柳婷,冯 洁,莫书荣.PI3K-Akt信号通路与肿瘤相关性的研究进展[J].肿瘤学杂志,2014,20(4):331-336.
[27] L?譫PEZ-KNOWLES E, O'TOOLE S A, MCNEIL C M, et al. PI3K pathway activation in breast cancer is associated with the basal-like phenotype and cancer-specific mortality[J]. International Journal of Cancer, 2010, 126(5): 1121-1131.
[28] SUN C H, CHANG Y H, PAN C C. Activation of the PI3K/Akt/mTOR pathway correlates with tumour progression and reduced survival in patients with urothelial carcinoma of the urinary bladder[J]. Histopathology, 2011, 58(7): 1054-1063.
[29] 马 丛.固本抑瘤Ⅱ号及拆方对乳腺癌MCF-7细胞自噬及PI3K信号通路干预研究[D].北京:北京中医药大学,2014.
[30] SAMATAR A A, POULIKAKOS P I. Targeting RAS-ERK signalling in cancer: Promises and challenges[J]. Nature Reviews Drug Discovery, 2014, 13(12): 928-942.
[31] 汪宏斌.ERK信号转导途径与乳腺癌细胞增殖及凋亡的关系[D].承德:承德医学院,2007.
[32] 吴向华,陆云飞.MAPK信号传导通路与乳腺癌关系的研究进展[J].广东医学,2010,31(4):526-528.
[33] 张 丰,李 楠.ERK/MAPK信号传导途径在乳腺肿瘤治疗中的意义[J].中国肿瘤生物治疗杂志,2007,14(5):497-500.
[34] WANG B, YAN Y, ZHOU J, et al. A novel all-trans retinoid acid derivatives inhibits the migration of breast cancer cell lines MDA-MB-231 via myosin light chain kinase involving p38-MAPK pathway[J]. Biomedicine & Pharmacotherapy, 2013, 67(5): 357-362.
[35] CHAMBARD J C, LEFLOCH R, POUYSSéGUR J, et al. ERK implication in cell cycle regulation[J]. Biochimica et Biophysica Acta, 2007, 1773(8): 1299-1310.
[36] LIANG J Y, SLINGERLAND J M. Multiple roles of the PI3K/PKB (Akt) pathway in cell cycle progression[J]. Cell Cycle, 2003, 2(4): 339-345.
[37] SHIMIZU T, TOLCHER A W, PAPADOPOULOS K P, et al. The clinical effect of the dual-targeting strategy involving PI3K/AKT/mTOR and RAS/MEK/ERK pathways in patients with advanced cancer[J]. Clinical Cancer Research, 2012, 18(8): 2316-2325.
[38] MANDAL R, BECKER S, STREBHARDT K. Stamping out RAF and MEK1/2 to inhibit the ERK1/2 pathway: An emerging threat to anticancer therapy[J]. Oncogene, 2016, 35(20): 2547-2561.
[39] JOKINEN E, LAURILA N, KOIVUNEN J P. Alternative dosing of dual PI3K and MEK inhibition in cancer therapy[J]. BMC Cancer, 2012, 12: 612.
[40] SAINI K S, LOI S, AZAMBUJA E D, et al. Targeting the PI3K/AKT/mTOR and Raf/MEK/ERK pathways in the treatment of breast cancer[J]. Cancer Treatment Reviews, 2013, 39(8): 935-946.

