隐丹参酮滴丸制备及其体内药动学研究
马 霄,颜国华,王世广,李晓婷,李登云,崔传锋
(1.郑州工业应用技术学院,河南 郑州 451150;2.中国医药工业研究总院有限公司,上海 201203)
隐丹参酮属于二萜醌类化合物,主要存在于丹参等植物中[1],具有抗肿瘤、抗病毒、保肝、抗心绞痛等药理作用[2],对脑卒中、脑缺血、阿尔茨海默病等疾病疗效较强[3-4],并且本身毒性较小[5]。但该成分在水中的溶解度仅为 (0.96±0.05) μg/mL,油水分配系数logP值为1.78[6],虽然在模拟胃液中的稳定性良好,但在模拟肠液中会发生降解[7],导致其口服生物利用度仅约为2%[8]。另外,将中药活性成分制成口服给药制剂时,作用机制明确,易获得现代科学理论支撑,从而为其走向国际市场奠定基础[9]。
目前,隐丹参酮相关制剂有纳米结构脂质载体[10]、固体脂质体[11]、纳米混悬剂[12]、固体分散体[13]等。由于滴丸可增加药物溶解度、溶出度、生物利用度[14-15],并且生产成本低,故本实验制备隐丹参酮滴丸,并考察其体内药动学,以期为临床提供成本低、疗效好的相关制剂。
1 材料
Agilent 1200 型高效液相色谱仪(美国Agilent公司);DW-1 型全自动滴丸机(广州市大祥电子机械设备有限公司);FA2004B 型电子天平[赛多利斯科学仪器(北京) 有限公司];HJ-6A 型磁力搅拌仪(常州德杜仪器有限公司);RC12AD 型智能溶出试验仪(天津市天大天发科技有限公司);MDS-DCY12Q 型氮吹仪(深圳迈德施生物科技有限公司)。
隐丹参酮 (批号 110852-210126,纯度99.0%)、非诺贝特 (批号100733-202006,纯度99.9%) 对照品(中国食品药品检定研究院)。隐丹参酮原料药(批号201017,纯度96.5%,南京普怡生物科技有限公司)。聚乙二醇4000 (PEG 4000,批号20200618,天津市光复精细化工研究所);二甲基硅油 (型号 H201-50,批号20200316,国药集团化学试剂有限公司)。
家兔,体质量1.5~2.0 kg,雌雄兼具,购自河南省动物实验中心,动物生产许可证号SCXK(豫) 2020-0001,实验室适应1 周。
2 方法与结果
2.1 隐丹参酮含量测定
2.1.1 色谱条件 Diamonsil Plus C18色谱柱(4.6 mm×150 mm,5 μm);流动相乙腈-0.02% 磷酸(65 ∶35);体积流量1.0 mL/min;柱温35 ℃;检测波长270 nm;进样量10 μL。
2.1.2 供试品溶液制备 取20 粒本品,置于研钵中研细,取约40 mg 至三角烧瓶中,精密称定,加入70% 乙醇50 mL,称定质量,超声 (功率250 W) 处理20 min,静置20 min,70%乙醇补足减失的质量,过0.45 μm 微孔滤膜,精密量取2 mL续滤液至50 mL 量瓶中,流动相定容至刻度,即得。
2.1.3 线性关系考察 精密称取对照品24.40 mg,置于100 mL 量瓶中,乙腈超声溶解后稀释定容,得244 μg/mL 贮备液,流动相依次稀释至12.2、6.1、2.03、0.61、0.061、0.030 5 μg/mL,在“2.1.1” 项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y) 进行回归,得方程为Y=64.847 1X+30.816 2 (r=0.999 8),在0.030 5~12.2 μg/mL 范围内线性关系良好。
2.1.4 方法学考察 取“2.1.2” 项下供试品溶液适量,于0、2、4、8、16、24 h 在“2.1.1” 项色谱条件下进样测定,测得隐丹参酮含量RSD 为0.44%,表明溶液在24 h 内稳定性良好。取0.030 5、2.03、12.2 μg/mL 对照品溶液适量,在“2.1.1” 项色谱条件下进样测定6 次,测得隐丹参酮含量RSD 分别为0.82%、0.57%、0.20%,表明仪器精密度良好。取同一批滴丸,按“2.1.2”项下方法制备6 份供试品溶液,在“2.1.1” 项色谱条件下进样测定,测得隐丹参酮含量RSD 为1.49%,表明该方法重复性良好。精密称取9 份滴丸粉末,每份约20 mg,置于三角瓶中,分为高、中、低3 组,分别加入贮备液15、10、15 mL,按“2.1.2” 项下方法制备供试品溶液,在“2.1.1”项色谱条件下进样测定,测得隐丹参酮平均加样回收率分别为100.26%、101.12%、99.81%,RSD分别为0.59%、0.73%、0.92%。
2.2 滴丸制备及质量评价 参考文献 [15]报道。
2.2.1 制备过程 采用熔融法,称取原料药粉末(过100 目筛)、基质适量,置于滴丸试验机中,在75 ℃下加热熔融,搅拌(转速200 r/min) 30 min 至熔融液完全溶解澄清,冷凝液选择二甲基硅油,调节其滴距后以一定滴速滴制(滴口内径2.5 mm,外径4.0 mm),收集,搽拭干净,即得。每组均滴制300 丸。
2.2.2 评价方法 挑选外观圆整光滑的滴丸,计算成型率,公式为成型率=(外观圆整光滑滴丸数/总滴丸数) ×100%。取滴丸20 粒,精密称定质量,计算平均丸重W平均,再依次称定每个滴丸质量Wi,计算质量差异,公式为质量差异=[(Wi-W平均)/W平均] ×100%。
2.3 处方工艺优化 采用单因素试验。
2.3.1 PEG 4000 与PEG 6000 比例 PEG 4000、PEG 6000 均是滴丸制剂常用基质[16],课题组前期发现采用前者制得的熔融液黏度较低,液滴大小不均匀,滴速较快,难以控制;后者制得的熔融液黏度较高,滴速较慢,即单用两者均会影响滴丸成型率、质量差异[16],故本实验选择其混合物作为基质。固定基质与隐丹参酮比例6 ∶1,冷凝温度12 ℃,滴速35 滴/min,滴距7 cm,测定成型率、质量差异,结果见图1。由此可知,PEG 4000 与PEG 6000 比例为1 ∶1 时成型率较高,质量差异较小,可能是由于在该比例下基质熔点、熔融液黏度适中,滴速易于控制,熔融液滴大小均匀。
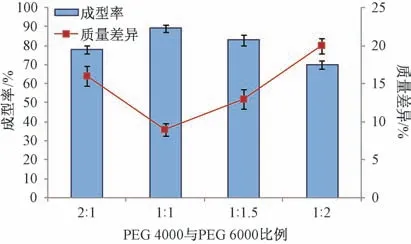
图1 PEG 4000 与PEG 6000 比例对成型率、质量差异的影响(n=3)Fig.1 Effects of PEG 4000-PEG 6000 ratio on forming rate and weight difference (n=3)
2.3.2 基质与药物比例 固定PEG 4000 与PEG 6000 比例1 ∶1,冷凝温度12 ℃,滴速35 滴/min,滴距7 cm,测定成型率、质量差异,结果见图2。由此可知,随着基质用量增加,成型率先升高后趋稳,而质量差异先降低后趋稳,可能是由于两者比例影响了熔融液黏度所致;为7 ∶1、8 ∶1 时成型率较高,质量差异较小,为了减少辅料用量,提高制剂载药量,最终选择7 ∶1。另外,隐丹参酮在PEG 4000 与PEG 6000 比例为1 ∶1 熔融液中的溶解度为0.35 g/g,表明基质与药物比例为7 ∶1 时后者可完全溶于前者中。
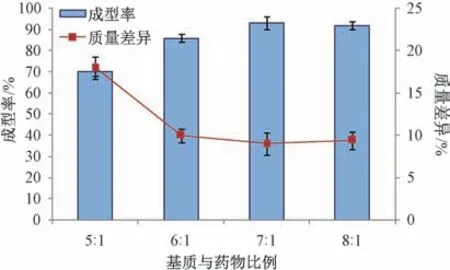
图2 基质与药物比例对成型率、质量差异的影响(n=3)Fig.2 Effects of matrix-drug ratio on forming rate and weight difference (n=3)
2.3.3 冷凝温度 固定PEG 4000 与PEG 6000 比例1 ∶1,基质与药物比例7 ∶1,滴速35 滴/min,滴距7 cm,测定成型率、质量差异,结果见图3。由此可知,冷凝温度过低时滴丸冷凝较快,易出现拖尾现象,导致成型率较低,质量差异较大;冷凝温度过高时滴丸冷凝较慢,下沉至滴丸机底部后撞击使其变形,导致成型率降低,但进一步升温对滴丸质量影响不大,最终选择12 ℃。
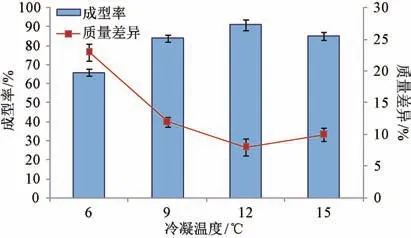
图3 冷凝温度对成型率、质量差异的影响(n=3)Fig.3 Effects of condensate temperature on forming rate and weight difference (n=3)
2.3.4 滴速 固定PEG 4000 与PEG 6000 比例1 ∶1,基质与药物比例7 ∶1,冷凝温度12 ℃,滴距7 cm,测定成型率、质量差异,结果见图4。由此可知,滴速过慢,熔融态液滴变大,质量差异较大;滴速过快,滴丸容易粘连[17],成型率较低,质量差异也较大;为30、35 滴/min 时成型率均大于90%,质量差异均小于10%,考虑到制备效率,最终选择35 滴/min。
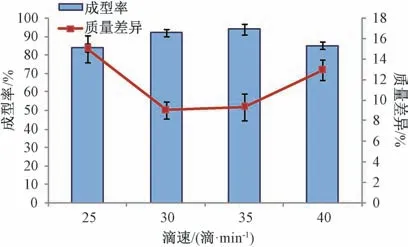
图4 滴速对成型率、质量差异的影响(n=3)Fig.4 Effects of dropping speed on forming rate and weight difference (n=3)
2.3.5 滴距 固定PEG 4000 与PEG 6000 比例1 ∶1,基质与药物比例7 ∶1,冷凝温度12 ℃,滴速35 滴/min,测定成型率、质量差异,结果见图5。由此可知,滴距过小时熔融态液滴进入冷凝液的时间较短,未完全收缩成规则球形,导致成型率较低;滴距过大时熔融态液滴撞击冷凝液面后易导致形变,进而影响成型率;为7 cm 时成型率、质量差异均较理想。
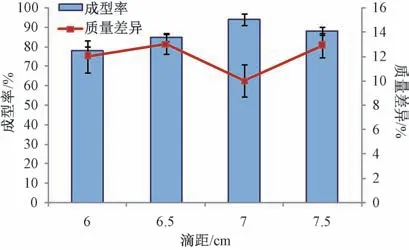
图5 滴距对成型率、质量差异的影响(n=3)Fig.5 Effects of dropping distance on forming rate and weight difference (n=3)
2.4 验证试验 根据“2.3” 项下结果,确定最优处方工艺为PEG 4000 与PEG 6000 比例1 ∶1,基质与药物比例7 ∶1,滴速35 滴/min,冷凝温度12 ℃,滴距7 cm。按上述优化工艺平行制备3 批样品,进行验证试验,测得平均成型率为(94.86±1.18)%,质量差异为(8.89±0.72)%,表明该工艺重复性良好。
2.5 溶散时限检查 取6 粒滴丸,设定筛网孔径为2.0 mm (20 粒滴丸平均直径为3.98 mm),采用加挡板法测得平均溶散时限为(7.1±0.2) min。
2.6 溶解度测定 取过量原料药、物理混合物(原料药+空白基质,比例同滴丸)、滴丸至蒸馏水中,25 ℃水浴中磁力搅拌(800 r/min) 2 d,取上层混悬液,过0.45 μm 微孔滤膜,取续滤液,在“2.1.1” 项色谱条件下进样测定。结果,三者溶解度分别为 (0.96±0.05)、(1.07±0.06)、(38.93±2.96) μg/mL,即滴丸可将原料药溶解度提高至40.55 倍。
2.7 扫描电镜分析 取原料药、空白基质(PEG 4000 与PEG 6000 比例1 ∶1,仅简单混合)、物理混合物(原料药+空白基质,比例同滴丸,研细)、滴丸粉末适量,喷金60 s 后在扫描电镜上观察形态,结果见图6。由此可知,原料药呈长方体晶体形态(图6A),空白基质呈片状形态(图6B),物理混合物中原料药、空白基质仅是简单混合(图6C),滴丸中未发现原料药长方体晶体形态(图6D),表明原料药在滴丸中的存在形式发生了改变。

图6 各样品扫描电镜图Fig.6 Scanning electron microscope images of various samples
2.8 晶型分析 设定扫描速度为6°/min,扫描范围(2θ) 为3°~45°,Cu-Kα 靶。取原料药、空白基质(PEG 4000 与PEG 6000 比例1 ∶1,仅简单混合)、物理混合物(原料药+空白基质,比例同滴丸)、滴丸粉末适量,置于玻璃槽后进行X 射线粉末衍射扫描,结果见图7。由此可知,原料药在7.5°、8.8°、12.6°、25.3°等处出现特征晶型峰;物理混合物图谱中上述特征晶型峰仍可见,但强度下降,表明原料药晶型状态未改变;滴丸图谱中上述特征晶型峰均消失,仅发现空白基质特征衍射峰,表明原料药转变为无定形状态。
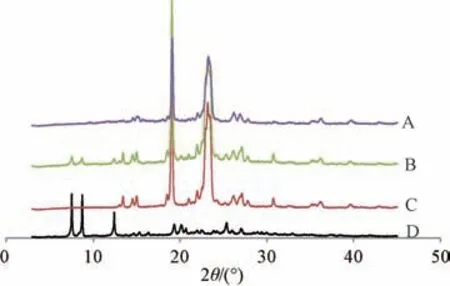
图7 各样品X 射线粉末衍射图Fig.7 X-ray powder diffraction patterns for various samples
2.9 体外溶出度研究 前期发现,隐丹参酮在1.5%SDS 溶液中的溶解度为8.74 μg/mL。取原料药、物理混合物(比例同滴丸)、滴丸适量(均含2 mg 隐丹参酮),置于转篮中,设定溶出介质为900 mL 0.5%SDS 溶液,溶出仪介质温度、转篮转速分别为(37±1)℃、100 r/min,于10、15、30、45、60、90、120、180 min 各取样3 mL,并补充空白介质5 mL,0.45 μm 微孔滤膜过滤,在“2.1.1” 项色谱条件下进样测定,结果见图8。由此可知,原料药、物理混合物180 min 内累积溶出度分别为27.46%、29.11%,表明基质对原料药具有一定促溶作用,但效果不明显,而滴丸45 min内累积溶出度即达94.74%。
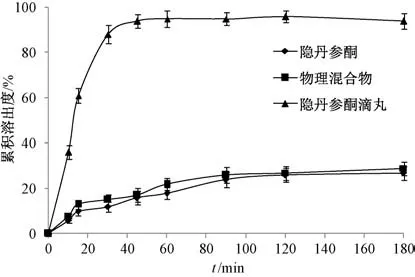
图8 隐丹参酮体外释药曲线(n=6)Fig.8 In vitro drug release curves for cryptotanshinone (n=6)
2.10 稳定性考察 取滴丸适量,密封后置于温度40 ℃、相对湿度75% 的恒温恒湿箱中,于0、1、2、3、6 个月后取出,测定水分、质量差异、溶散时限。结果见表1。由此可知,滴丸在加速条件下放置6 个月后外观、水分、重量差异、溶散时限仍符合2020 年版《中国药典》 丸剂项下要求。
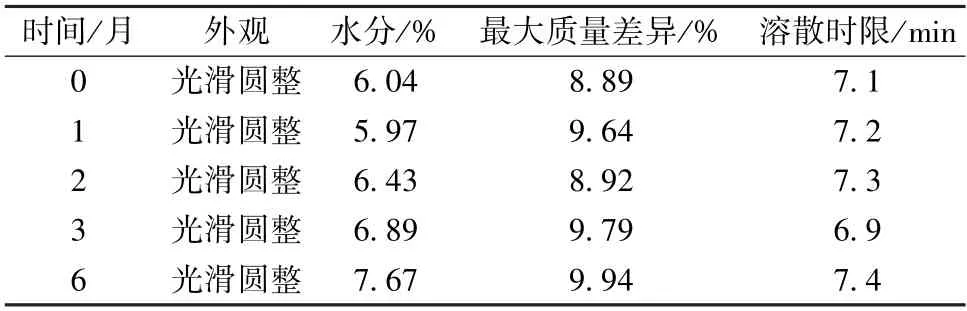
表1 稳定性考察结果(n=3)Tab.1 Results of stability investigation (n=3)
2.11 体内药动学研究
2.11.1 分组、给药与采血 18 只家兔随机分为隐丹参酮组、物理混合物组(药物与基质比例同滴丸)、隐丹参酮滴丸组,禁食过夜,将原料药、物理混合物分散于0.5%CMC-Na 溶液中进行灌胃给药,滴丸使用温水送服,剂量均为40 mg/kg(以隐丹参酮计),乙醚麻醉后隐丹参酮组、物理混合物组家兔于0、0.167、0.25、0.5、1、1.5、2、2.5、3、4、6、8 h 采血,隐丹参酮滴丸组家兔增加12 h 采血点,采血量均约为0.5 mL,引流至肝素浸润离心管中,涡旋5 s,4 000 r/min 离心3 min,取上层血浆密封,在-20 ℃下冷冻保存。
2.11.2 血浆样品处理 参考文献[18] 报道,精密吸取100 μL 血浆样品,加入内标溶液(取非诺贝特对照品适量,甲醇制成质量浓度为500 ng/mL,即得) 50 μL、乙腈1 mL,涡旋30 s,12 000 r/min 离心10 min,取上层有机相,45 ℃氮气吹干得残渣,100 μL 乙腈复溶。
2.11.3 线性关系考察 取1 000 ng/mL 对照品溶液适量,甲醇依次稀释至500、250、100、50、25 ng/mL,精密取0.5 mL,45 ℃氮气吹干,加入0.5 mL 空白血浆,涡旋30 s 后按“2.11.2” 项下方法处理,即得血浆对照品溶液,在“2.1.1” 项色谱条件下进样测定。以对照品质量浓度为横坐标(X),隐丹参酮、内标峰面积比值为纵坐标(Y) 进行回归,得方程为Y=0.002 3X+0.082 7 (r=0.995 6),在25~1 000 ng/mL 范围内线性关系良好。
2.11.4 方法学考察 取25、500、1 000 ng/mL血浆对照品溶液适量,同一天内在“2.1.1” 项色谱条件下进样测定6 次,测得隐丹参酮峰面积RSD分别为4.12%、3.05%、3.22%,表明该方法日内精密度良好;同法连续测定6 d,每天1 次,测得隐丹参酮峰面积RSD 分别为7.62%、5.47%、4.98% (n=6),表明该方法日间精密度良好。取给药8 h 后血浆样品适量,室温(温度25 ℃,相对湿度55%) 下于0、2、4、8、12、24 h 在“2.1.1” 项色谱条件下进样测定,测得隐丹参酮、内标峰面积比值RSD 为8.48% (n=6),表明样品在24 h 内稳定性良好。空白血浆配制隐丹参酮质量浓度分别为25、250、1 000 ng/mL 的血浆样品,按“2.11.2” 项下方法处理,在“2.1.1” 项色谱条件下各进样测定3 次,测得隐丹参酮平均加样回收率分别为90.10%、95.72%、94.22%,RSD 分别为3.84%、7.15%、5.29%。
2.11.5 结果分析 血药浓度-时间曲线见图9,再采用3P97 程序统计矩模型计算主要药动学参数,结果见表2。由此可知,与原料药比较,物理混合物tmax、t1/2、Cmax、AUC0~t无明显变化(P>0.05),表明基质对隐丹参酮药动学基本无影响,促吸收作用有限;与原料药、物理混合物比较,滴丸tmax缩短(P<0.05),Cmax、AUC0~t、AUC0~∞升高(P<0.01),相对生物利用度与原料药相比增加至2.70 倍。
表2 隐丹参酮主要药动学参数(±s,n=6)Tab.2 Main pharmacokinetic parameters for cryptotanshinone (±s,n=6)
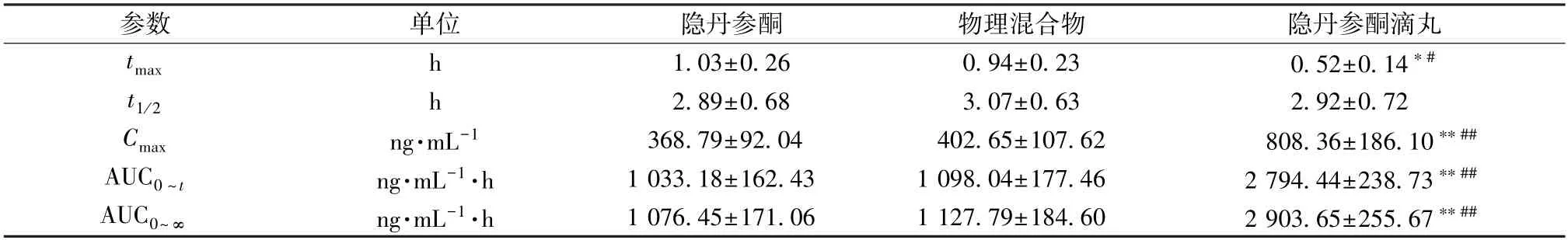
表2 隐丹参酮主要药动学参数(±s,n=6)Tab.2 Main pharmacokinetic parameters for cryptotanshinone (±s,n=6)
注:与隐丹参酮比较,*P<0.05,**P<0.01;与物理混合物比较,#P<0.05,##P<0.01。
参数单位隐丹参酮物理混合物隐丹参酮滴丸tmaxh1.03±0.260.94±0.230.52±0.14*#t1/2h2.89±0.683.07±0.632.92±0.72 Cmaxng·mL-1368.79±92.04402.65±107.62808.36±186.10**##AUC0 ~tng·mL-1·h1 033.18±162.431 098.04±177.462 794.44±238.73**##AUC0~∞ng·mL-1·h1 076.45±171.061 127.79±184.602 903.65±255.67**##
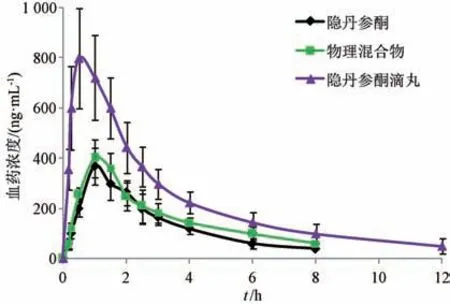
图9 隐丹参酮血药浓度-时间曲线(n=6)Fig.9 Plasma concentration-time curves for cryptotanshinone (n=6)
3 讨论
固体分散体易吸潮[19],可能会影响药物稳定性及药效,故需经压片、填充胶囊等过程才能供临床使用。纳米混悬剂[12]、固体脂质纳米粒[11]等纳米制剂对设备要求较高,固化成粉末时需大量冻干保护剂,导致制剂载药量较低,并且在储存过程中或口服进入胃肠道后会发生粒径增长情况[20-21],可能导致促吸收作用减弱。滴丸工艺简便,质量易控,适合目前我国中药企业实际生产水平,故本实验将隐丹参酮制成滴丸,以期为临床提供一种可靠实用、价格低廉、安全有效的口服制剂。
晶型分析、扫描电镜结果表明,隐丹参酮以无定形状态存在于滴丸中,有利于溶解度、溶出速率、溶出度的提高;滴丸45 min 内累积溶出度达94.74%,可为改善药物吸收奠定基础。体内药动学研究结果表明,滴丸tmax缩短,可能与药物溶出速率较快有关;Cmax增加至2.19 倍,可能是由于隐丹参酮累积溶出度升高所致;相对生物利用度提高至2.70 倍,可能是因为滴丸提高了隐丹参酮溶解度、溶出速率、溶出度,解决了其吸收瓶颈[22],并且原料药在滴丸中以无定形状态存在,往往具有更高的生物利用度[15,23]。今后,需对隐丹参酮滴丸不良反应、药效等方面进行评价,以期为该制剂提供更完整的研究资料。

