姜黄素重建肠道微生态环境改善溃疡性结肠炎小鼠机制研究
邹俊 李俊杰 程芳芳 汪浙炯
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性炎症性疾病,在亚洲的发病率高于克罗恩病(crohn’sdisease,CD),不断增加的发病率给卫生保健系统带来重大挑战[1]。肠道菌群紊乱、短链脂肪酸(SCFAs)等代谢产物异常,以及免疫系统障碍等的相互作用影响UC的发生和发展[2]。30%~50%的UC患者疾病局限于直肠或乙状结肠(远端结肠炎),20%~30%为左侧结肠炎,20%为全结肠炎。在远端结肠炎患者中,25%~50%随着时间的推移发展为更广泛的疾病形式,甚至结直肠癌[3]。目前UC的临床治疗药物使用存在易耐药及复发等问题[4],需寻找安全有效的药物。姜黄素是一种广泛存在于天然草药中的多酚,具有抗炎、抗痛、抗氧化和抗肿瘤的作用[5-6]。临床研究发现姜黄素对轻度至中度UC治疗具有良好的安全性[7]。姜黄素经过肠道内细菌酶的修饰,重塑肠道微生物结构组成,影响炎性细胞因子的表达[8],促进黏膜损伤修复[9]。本研究通过观察小鼠结肠组织形态学、肠道微生物组成和多样性、粪便代谢组学以及结肠内促炎因子和抑炎因子的表达量变化及进行相关性分析,探索姜黄素是否通过重塑肠道微生物环境治疗UC小鼠的潜在机制。
1 材料与方法
1.1 实验动物 6周龄雄性C57BL/6小鼠30只,购买及饲养于浙江中医药大学实验中心,环境温度24℃±2℃、湿度55%±10%、光照/黑暗周期为12 h,小鼠自由饮用食物和水。
1.2 主要试剂与仪器 葡聚糖硫酸钠(DSS,36,000~50,000 Da,MP Biomedicals,美国);姜黄素(Sigma-Aldrich,美国);粪便基因组RNA提取试剂盒[天根生化科技(北京)有限公司];Bruker 600-MHz AVANCE Ⅲ核磁共振检测仪(Bruker,德国);ELISA试剂盒购自上海泛柯实业有限公司。
1.3 UC模型建立及姜黄素干预 适养1周后,小鼠随机分为三组(n=10/组):空白对照组(CON)、DSS诱导结肠炎组(DSS)和姜黄素治疗组(DSS+CUR)。DSS组和DSS+CUR组小鼠连续8 d自由饮用2%的DSS溶液,DSS+CUR组小鼠灌胃姜黄素剂量为100 mg/(kg·d),DSS组给予等剂量磷酸盐缓冲液。
1.4 疾病活动指数(Disease activity index,DAI)评估 每天根据小鼠体质量、粪便粘稠度和有无血便,计算DAI。评分标准:0=无体质量减轻,粪便中无隐血,粪便稠度正常;1=体质量减轻为总体质量的1%~5%;2=体质量减轻为总体质量的>5%~10%,粪便隐血阳性,粪便稀薄;3=体质量减轻为总体质量的>10%~20%;4=体质量减轻>总体质量的20%,严重出血和腹泻。
1.5 结肠黏膜损伤指数(colonic mucosa damageindex,CMDI)评估 肉眼观察结肠病变组织肠黏膜形态,并参考文献进行结肠黏膜大体形态损伤指数评分[10]。
1.6 结肠组织病理学观察 小鼠结肠组织用4%多聚甲醛固定,酒精梯度脱水、石蜡包埋,用苏木素-伊红(Hematoxylin-eosin,HE)染色结肠组织切片,通过光学显微镜观察结肠组织形态。
1.7 16S rDNA 扩增子测序和分析 使用E.Z.N.A.®StoolDNAKit(TIANGEN,中国)提取粪便的DNA。原始数据由Cutadapt1.9过滤及FLASH1.2.8处理。使用DADA2和QIIME2构建操作分类单位(OTU)并进行去噪处理。通过SILVA和NT-16S数据库进行注释和分析。
1.8 1H-NMR代谢组学检测和分析 解冻100 mg粪便,与0.8 mL的PBS(内含的重水99.8%和0.05 mM的3-三甲基硅基丙酸钠-d4)混合,裂解、离心后收集500μL上清液用Bruker600-MHzAVANCEⅢ核磁共振检测仪进行分析。用MestReNova14.2(MestrelabResearchSL,西班牙)以TSP的化学位移δ0.00为标准对谱图进行校正并进行相位、基线调整。模型验证使用SIMCA14.2。
1.9 小鼠结肠组织中细胞因子表达水平检测 用ELISA检测试剂盒测定结肠组织中IL-10、IL-6、IL-17和IL-23表达水平,检测方法严格按照试剂盒说明书进行。
1.10 统计学方法 采用GraphPad Prism 9.0软件进行。计量资料以()表示,各组间比较采用单因素方差分析,两两比较采用Bonferroni检验。Wilcoxon和Kruskal-Wallis秩和检验用于非正态分布数据分析。P<0.05表示差异有统计学意义。
2 结果
2.1 姜黄素对于UC小鼠疾病活动指数的影响 如图1所示,DSS组小鼠的DAI评分从第4天开始明显高于CON组(P<0.0001)。姜黄素干预第4天开始,DSS+CUR小鼠的腹泻、血便症状及体质量下降情况较DSS组明显改善(P<0.05)。但整体DAI评分较CON组差异无统计学意义(P>0.05)。

图1 姜黄素对于UC小鼠疾病活动指数的影响。与DSS模型组比较,****P<0.0001;与姜黄素治疗组比较,#P<0.05,####P<0.0001
2.2 小鼠结肠长度变化和结肠组织大体形态损伤指数 DSS组小鼠的结肠长度较CON组明显缩短(P<0.0001),姜黄素治疗后小鼠的结肠长度显著长于DSS组(P<0.05)。DSS组小鼠结肠壁显著变薄,部分黏膜脱落,多发糜烂、溃疡和出血点。DSS+CUR组小鼠的结肠少许糜烂、溃疡灶,结肠大体形态较DSS组明显改善,CMDI较DSS显著下降(P<0.01)。见表1。
表1 各组小鼠结肠长度及CMDI评分[(),分]
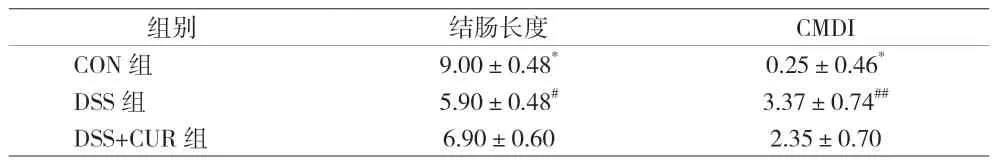
表1 各组小鼠结肠长度及CMDI评分[(),分]
注:与DSS组比较,*P<0.0001;与DSS+CUR组比较,#P<0.05,##P<0.01
组别结肠长度CMDI CON组9.00±0.48*0.25±0.46*DSS组5.90±0.48#3.37±0.74##DSS+CUR组6.90±0.602.35±0.70
2.3 姜黄素治疗对于UC小鼠结肠黏膜损伤修复作用 CON组小鼠结肠各层结构清晰。DSS组小鼠的黏膜变薄,腺管数量变少,腺体结构不规则,隐窝消失,固有层内炎性细胞浸润明显。姜黄素改善了小鼠结肠黏膜结构和炎性细胞浸润,促进了黏膜损伤的修复(图2)。

图2 各组小鼠的结肠HE染色(×20)
2.4 姜黄素治疗调节小鼠肠道微生物群的组成 在属水平,DSS+CUR组小鼠肠道的Muribaculaceae_unclassified、Muribaculum和阿克曼菌(Akkermansia)的相对丰度较DSS组显著上调(P<0.05),Lachnospiraceae_NK4A136_ group、拟杆菌属(Bacteroides)和瘤胃球菌属(Ruminococcus)等菌属相对丰度有所上升(P>0.05),见图3。
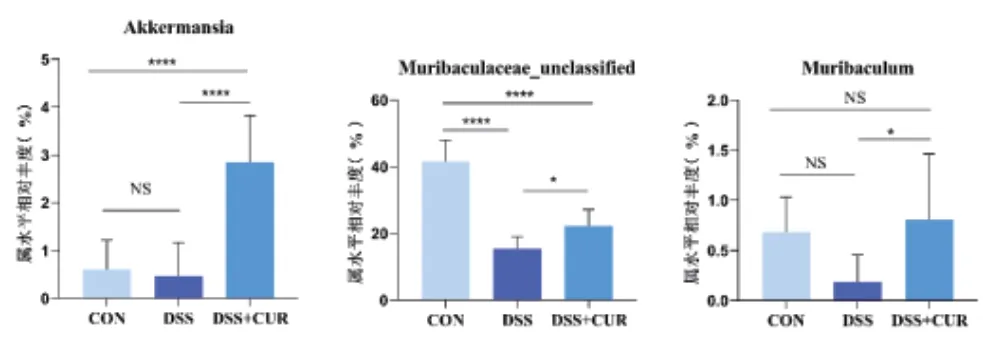
图3 各组肠道菌群属水平相对丰度
2.5 姜黄素对小鼠粪便代谢产物的影响 查阅HMDB数据库及相关文献鉴定出小鼠粪便代谢产物一共有45种。PLS-DA散点图显示三组之间有明显的分离(图4),DSS组与CON组的距离差异较大,而DSS+CUR组与CON组距离较近,表明DSS+CUR组的代谢产物较DSS组更接近于CON组。在此基础上构建预测模型,CONVS. DSS:R2=0.961,Q2=0.857;DSSVS. DSS + CUR:R2=0.957,Q2=0.727,表明该模型可用于进一步数据分析。通过PLS-DA结合多变量统计分析中VIP>1及对其峰面积进行独立样本t检验来鉴定差异性代谢产物。在CON组VS. DSS组与DSSVS. DSS + CUR组之间鉴定出8种共同调控的代谢物,丙酸盐、丁酸盐、色氨酸和甜菜碱含量经姜黄素治疗后显著上调,而β-葡萄糖、3-羟基苯乙酸盐、天冬门氨酸和牛磺酸则显著下降(图5)。
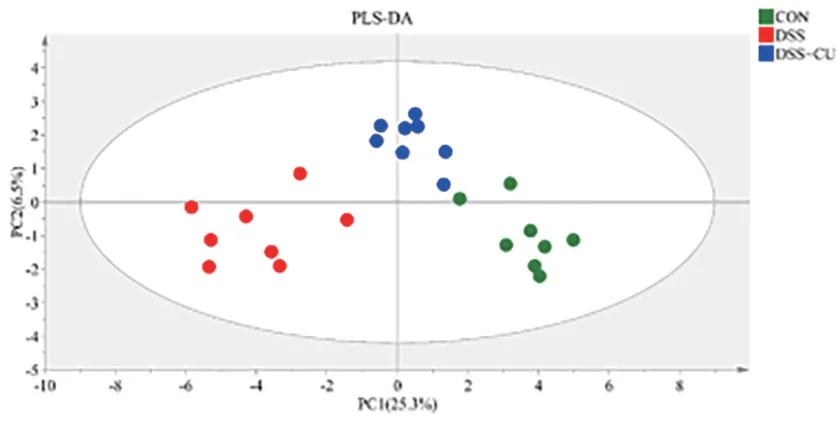
图4 PLS-DA散点图
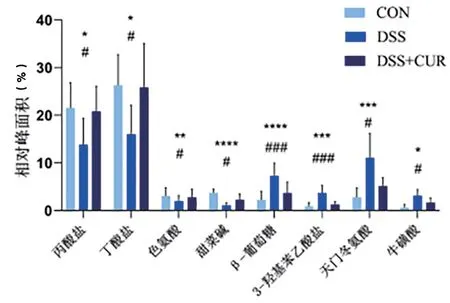
图5 三组间共同调控代谢产物。注:与DSS组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.0001;与DSS+CUR组比较,#P<0.05,####P<0.0001
2.6 姜黄素对于小鼠结肠IL-10、IL-6、IL-17和IL-23表达的影响 与CON组相比,DSS组结肠促炎因子IL-6、IL-17和IL-23表达水平升高(P<0.0001),抑炎因子IL-10表达降低(P<0.0001)。经姜黄素治疗后结肠组织中IL-6、IL-17和IL-23表达量下降(P<0.05),IL-10表达升高(P<0.0001)(见表2)。
表2 各组小鼠结肠IL-10、IL-6、IL-17和IL-23的表达[(),pg/mL]

表2 各组小鼠结肠IL-10、IL-6、IL-17和IL-23的表达[(),pg/mL]
注:与DSS组比较,*P<0.001,**P<0.0001;与DSS+CUR组比较,#P<0.05,##P<0.01,###P<0.0001;与CON组比较,▲P<0.001,▲▲P<0.0001
组别IL-10IL-6IL-17IL-23 CON组180.10±12.80**66.75±11.93**15.23±4.09*12.25±2.19**DSS组49.20±9.32###274.90±15.63###24.29±6.28##33.10±8.45#DSS+CUR组125.30±6.21▲▲137.10±9.33▲▲17.25±4.1324.63±4.78▲
3 讨论
肠道微生物群及其代谢产物、免疫因素所构成的微生态环境可能是UC治疗机制的基本要素。本研究发现姜黄素干预后阿克曼菌相对丰度增加。阿克曼菌是一种降解粘液的细菌,可以维持粘液层的生理厚度,保护其免受有毒物质和病原菌的侵害。阿克曼菌从粘液中产生乙酸,促进其他产SCFAs菌属的生长[11]。姜黄素对肠道糖酵解/葡萄糖生成途径的富集,可能得益于阿克曼菌改善和保持糖耐量稳定的作用。人类肠道微生物中阿克曼菌属比例丰富,意味着姜黄素提高其丰度的有益效果也可能适用于人类IBD患者。SCFAs是由不可消化的碳水化合物经肠道菌群发酵而成,主要由乙酸、丙酸和丁酸组成,不仅为肠道上皮细胞提供了丰富的能量,还作为肝细胞的能量底物,可能诱发整体有益的代谢效应[12]。一项生理模拟研究发现,SCFAs可能进一步加剧T细胞介导的急性炎症,导致肝功能衰竭和肠道屏障破坏,其治疗作用主要取决于CD4+T细胞的激活状态[13]。但整体上,SCFA对IBD小鼠的代谢和能量平衡产生了有益的影响。
此外,肠道内氨基酸代谢浓度的增加和其代谢途径的富集与维持细胞形态和功能相关。色氨酸有助于保护肠黏膜上皮的完整性,可作为治疗溃疡性结肠炎的一种有前途的预防剂[14]。甜菜碱对内质网应激和细胞凋亡的缓解是其抗炎作用的关键,在IBD小鼠中抑制了促炎症细胞因子的表达,增强了肠黏膜屏障功能[15]。
改善Treg/Th17细胞失衡是治疗UC潜在策略。Th17细胞主要分泌IL-17A、IL-17F等细胞因子。IL-6可通过STAT3磷酸化,促使CD4+T细胞分化为Th17细胞,分泌IL-17,进一步触发T细胞和其他免疫细胞产生趋化因子、细胞粘附分子和其他细胞因子,导致肠道免疫系统持续活化。而Treg细胞则抑制免疫反应,主要分泌IL-10,具有免疫调节作用的细胞因子,可以对抗IL-2、肿瘤坏死因子-α、干扰素-γ等促炎因子,平衡炎症反应,IL-10表达缺陷与IBD的发病机制有关[16]。姜黄素可能通过调节Treg/Th17途径的平衡来改善DSS诱导的小鼠结肠炎。
综上所述,姜黄素对UC小鼠的治疗作用机制可能通过重塑和稳定的肠道微生态环境,包括调节肠道内菌群的组成,尤其增加了如阿克曼菌、Muribaculaceae_unclassified和Muribaculum这些益生菌的相对丰度;增加了SCFAs、色氨酸和甜菜碱等代谢产物的浓度;以及调节肠道内促炎因子和抑炎因子的免疫失衡,从而改善UC小鼠的肠黏膜损伤而发挥治疗作用。

