幽门螺杆菌对慢性阻塞性肺疾病大鼠气道黏膜炎症的影响*
张梦丽,戈改真,丁瑞峰,王乐乐,忻晓霞,王兆霞
(1.包头医学院,内蒙古 包头 014010;包头医学院第一附属医院 2.呼吸二科,3.消化科,内蒙古 包头 014010)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种异质性肺疾病,以慢性呼吸道症状(呼吸困难、咳嗽、咳痰)为特征,是由于气道异常(支气管炎、细支气管炎)和/或肺泡异常(肺气肿)导致的持续性、通常是进行性的气流阻塞[1]。大约全世界一半的人口均存在幽门螺杆菌(Helicobacter pylori,Hp)感染,其与胃炎、胃溃疡、胃癌等消化系统疾病密切相关,被认为是一级致癌物。目前研究表明,Hp除与胃肠道疾病有关,还与胃肠外多系统疾病相关,包括呼吸系统疾病、血液系统疾病、心血管系统疾病、神经系统疾病等[2]。Hp感染与COPD疾病有关,但是其机制并未阐明。COPD发病机制至今未完全明确,氧化应激、炎症反应被认为与该病的发展密切相关。本研究拟观察Hp对COPD大鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)炎症因子白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-8(Interleukin-8,IL-8)和肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)的影响,探讨Hp是否会加重气道炎症,从而影响COPD疾病的发生、发展,以及Hp影响COPD的可能机制。
1 材料与方法
1.1 菌株、试剂及动物
1.1.1 Hp菌株 采用国际统一的悉尼菌株1(SS1)标准菌株(山东大学提供)。
1.1.2 主要试剂 脂多糖(美国Sigma公司,货号:L2880),IL-6(批号:20221206E7)、IL-8(批号:20221206C2)、TNF-α(批号:202212053V)酶联免疫吸附试验试剂盒(江苏宝莱生物科技有限公司),香烟(云烟牌,焦油量11 mg,烟气烟碱量1.1 mg),水合氯醛(北京伊塔生物科技有限公司,货号:YT0533)。
1.1.3 实验动物 SPF级雄性Wistar大鼠25只,8周龄,体重(240±10)g [北京斯贝福生物技术有限公司提供,实验动物生产许可证号:SCXK(京)2019-0010,实验动物使用许可证号:SYXK(京)2019-0030]。饲养温度为22~24 ℃,相对湿度为35%~45%,昼夜时间均等,自由进食水。本实验严格参照动物实验伦理要求相关规定进行,且获得医院伦理委员会审批同意[批号:包医伦审动物2021第(041)号]。
1.2 仪器与设备
C-400大鼠烟熏箱(上海晟廷生物科技有限公司)、AniRes2005肺功能仪(北京贝兰博科技有限公司)、RT-6100酶标仪(美国Rayto公司)。
1.3 实验方法
1.3.1 分组 25只大鼠随机分为Hp+ COPD组11只,COPD组11只,空白对照组3只。
1.3.2 复制COPD大鼠模型 所有大鼠适应性喂养1周,将Hp+COPD组与COPD组大鼠置于烟熏箱内,每次10支烟,上下午各1次,每次烟熏1 h。第1、14天用10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉大鼠后,在动物喉镜辅助下暴露声带,可视下灌入1 mg/mL 脂多糖溶液200 μL,旋转大鼠,使LPS溶液均匀散布于两肺。空白对照组在第1、14天气管内滴注生理盐水200 μL,其余时间不做任何处理。
1.3.3 COPD大鼠观察指标 模型复制后4周,随机选取COPD组大鼠3只和空白对照组大鼠3只,腹腔麻醉后剪开颈部皮肤,暴露气管,连接小动物肺功能仪检测肺功能,记录用力肺活量(forced vital capacity,FVC)、0.3秒用力呼气容积(forced expiratory volume in 0.3 second,FEV0.3)、0.3秒用力呼气容积与用力肺活量比值(FEV0.3/FVC)、呼气流量峰值(peak expiratory flow,PEF)。
1.3.4 复制Hp大鼠模型 将-80 ℃ Hp国际标准菌株SS1复苏后,经尿素酶、脲酶、革兰染色验证后,接种于平板培养基上,置于37 ℃微需氧环境培养72 h,每24 h换气1次。用生理盐水配置成1×1011CFU/L的Hp菌液备用。Hp+COPD组大鼠禁食水12 h,用5 g/L NaHCO3做灌胃预处理,预处理后禁食不禁水6 h,经口灌注1×1011CFU/L的Hp菌液1.5 mL,灌胃结束后禁食水4 h,隔天灌胃1次,连续灌胃5次。COPD组大鼠经相同预处理后灌胃同等剂量的生理盐水。
1.3.5 Hp模型的检测 模型复制后4周,随机选取3只Hp+COPD组大鼠,取胃窦部黏膜行细菌学涂片检测及快速尿素酶试验。
1.3.6 收集大鼠BALF 将Hp+COPD组与COPD组各剩余8只大鼠麻醉后打开胸腔,结扎右主支气管,在4、5气软骨之间行一2 mm横切口,将外径约1.8 mm的大鼠气管插管进入气道约2 cm,灌注4 mL生理盐水进入左肺,轻揉左肺,缓慢回抽,重复3次,收集BALF,回收率约为80%,3 000 r/min离心 5 min,收集上清液置于-80 ℃冰箱冷冻保存。
1.4 统计学方法
数据分析采用SPSS 20.0统计软件。计量资料以均数标准差(±s)表示,比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 空白对照组和COPD组大鼠的肺功能
空白对照组和COPD组大鼠的PEF、FEV0.3和FEV0.3/FVC比较,经t检验,差异均有统计学意义(P<0.05);COPD组PEF、FEV0.3和FEV0.3/FVC均降低,提示COPD模型复制成功。见表1。
表1 空白对照组与COPD组大鼠肺功能比较(n=8,±s)

表1 空白对照组与COPD组大鼠肺功能比较(n=8,±s)
组别空白对照组COPD组t 值P 值PEF/(mL/min)51.45±2.43 42.17±2.92-4.229 0.013 FEV0.3/mL 12.64±0.31 3.56±1.36-11.240 0.000 FEV0.3/FVC/%78.92±1.16 41.44±7.64-8.402 0.001
2.2 Hp+COPD组大鼠胃黏膜组织检查结果
将Hp+COPD组大鼠胃窦部黏膜面分为两部分,一部分贴于载玻片上进行涂片,革兰染色后镜检,可检测出红色短杆状菌体(见图1A);另一部分进行快速尿素酶试验,出现红色提示结果呈阳性(见图1B)。2种结果均为阳性,提示Hp+COPD组大鼠幽门螺杆菌定植模型复制成功。
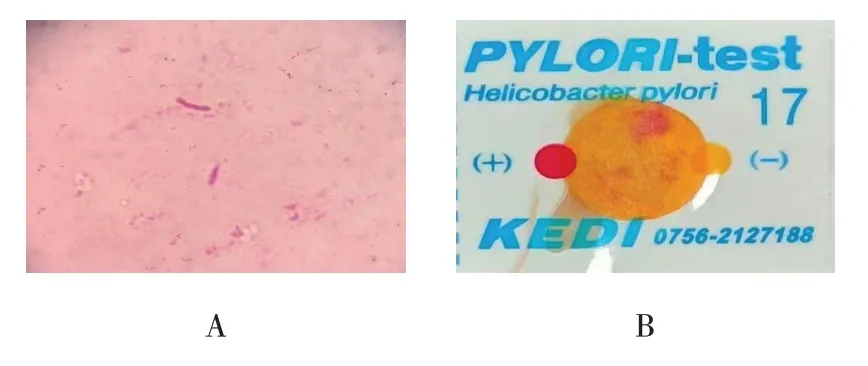
图1 幽门螺杆菌涂片及快速尿素酶试验结果
2.3 Hp+COPD组与COPD组大鼠炎症因子比较
Hp+COPD组与COPD组大鼠BALF的IL-6、IL-8、TNF-α水平比较,经t检验,差异均有统计学意义(P<0.05);Hp+COPD组的IL-6、IL-8、TNF-α水平均高于COPD组。见表2。
表2 Hp+COPD组与COPD组大鼠炎症因子水平比较(n=8,pg/mL,±s)
表2 Hp+COPD组与COPD组大鼠炎症因子水平比较(n=8,pg/mL,±s)
组别Hp+COPD组COPD组t 值P 值IL-6 87.51±7.66 51.20±14.13 6.387 0.000 IL-8 188.73±6.83 103.33±15.36 14.367 0.000 TNF-α 227.78±33.16 150.40±19.82 5.666 0.000
3 讨论
1983年Hp在胃黏膜中被首次分离发现,并证实与胃炎、消化系统溃疡、胃癌等疾病密切相关,越来越多的研究证明Hp感染与胃肠外疾病也密切相关,也包括呼吸系统疾病。其中,Hp和COPD的相关性更是引起了医务人员的重视。COPD患者Hp感染率及血清抗体阳性率较对照组增高,Hp感染可能促进稳定期COPD患者病情的进展[3],加重急性加重期COPD患者的肺功能和凝血功能障碍,Hp感染与COPD严重程度有关[4]。根除Hp可以改善肺功能,减少COPD急性发作次数[5]。但是Hp感染影响COPD的机制并不清楚。IL-6作为一种炎症因子,与大量肺内和肺外炎症性疾病相关,参与COPD气道及肺实质的炎症反应、气流受限及气道重塑[6]。IL-8可趋化、激活中性粒细胞,导致中性粒细胞变形,释放各种蛋白酶,生成氧自由基,致使气道上皮细胞损伤、脱落,进而导致气道内炎症反应,被证明是COPD急性加重和进展的原因之一[7]。TNF-α是炎症反应中首先出现的炎症因子,可激活淋巴细胞、中性粒细胞,影响核因子κB细胞通路,启动、扩大炎症级联反应,并且可通过上调基质金属蛋白酶-2和基质金属蛋白酶-9,导致肺气肿变化[8]。本研究结果显示,Hp感染使COPD大鼠BALF的炎症因子IL-6、IL-8、TNF-α水平升高,加重COPD大鼠气道炎症,这提示Hp可通过加重气道炎症而促进COPD疾病进展。但Hp加重COPD大鼠气道炎症的机制并不清楚,笔者分析可能如下所述。
Hp及其毒素误吸。SAMAREH-FEKRI等[9]在肺癌患者的BALF中检测出Hp DNA。ARISMENDI等[10]对小鼠经口气管内灌注Hp悬液,结果显示,小鼠肺组织炎症标志物TNF-α、IL-8、IL-1β、基质金属蛋白酶-9表达增多;病理检测提示肺结构破坏、肺纤维化,且肺纤维化随着时间逐渐加重,但是Hp DNA经PCR检测,强度逐渐减弱,至30 d为阴性。也有研究证明Hp在胃以外的很多部位包括眼睛、皮肤、胆囊定植,但是目前并没有研究直接从支气管肺组织中分离培养得到Hp。另外,Hp能够产生多种酶,包括尿素酶、过氧化氢酶、蛋白酶、磷脂酶等,并释放促炎症反应介质,吸入Hp及Hp外毒素能够引起支气管系统的组织损伤[11]。Hp空泡细胞毒素A(VacA)被证实存在于人肺中[12],可能通过核因子κB信号传导促进IL-1β、TNF-α、IL-6和IL-8的产生,诱导内皮细胞凋亡,导致肺损伤[13]。而COPD患者因为急性加重及呼吸科药物的使用更容易发生胃食管反流。总之,目前研究不支持Hp在肺组织内直接定植,但是可以解释Hp及其毒素通过吸入或误吸直接损伤肺组织并导致慢性炎症。
局部炎症因子或Hp产物进入循环。Hp定植于胃黏膜上皮细胞,释放毒素或直接损害黏膜屏障,引起炎症与免疫反应,导致患者胃液及循环中促炎细胞因子IL-1β、TNF-α、IL-8和IL-6水平升高,炎症因子进入循环,引起胃肠外疾病[14]。另外Hp根据菌株不同分泌不同的外膜囊泡,作为携带物质黏附素、毒力因子(CagA、VacA、脲酶、OipA)、代谢蛋白、磷脂、遗传物质等的功能载体,释放到胃环境或者通过胃黏膜易位到组织中的免疫细胞甚至循环,间接诱导全身效应[15]。Hp外膜囊泡在体外可以诱导IL-1β、IL-6、IL-8和TNF-α产生,且Hp外膜囊泡穿透胃上皮细胞能力高于细菌。宿主细胞在感染病原体或可溶性物质后,分泌细胞外囊泡[16]。外泌体是直径40~160 nm的细胞外囊泡,相对较小的尺寸和统一的形状使外泌体能够成功地逃脱单核吞噬细胞系统的清除,保护其携带物质免受降解,并被远离其释放的细胞选择性地吸收,通过抗原呈递、免疫激活、免疫抑制、免疫耐受发挥免疫调节作用。外泌体作为CagA载体能够突破肠屏障进入循环,将CagA输送到远处的器官和组织[17]。肠屏障功能障碍时脂多糖阳性的细菌外膜囊泡存在于血浆中,诱导免疫激活[18]。COPD大鼠有肠黏膜屏障结构改变和功能障碍,Hp又可破坏上皮屏障功能,使Hp相关的外膜囊泡、细胞外囊泡、炎症因子等更容易突破肠屏障进入循环。Hp毒力因子的这种易位方式可以阐明Hp产物参与局部和全身炎症的进展。综上,Hp可能通过局部炎症或者可溶性物质进入循环,导致胃肠外疾病与症状。
Hp可能导致患者微量元素的降低。Hp由于在消化道长期定植引起慢性感染,破坏上皮细胞,干扰胃分泌、酸化功能,而影响微量元素(铁、锌、叶酸、维生素B12等)的吸收[19-20]。锌作为多种酶及酶的激活因子,是免疫调节的关键元素。锌可通过调节T细胞功能、抑制IKK活性和随后的核因子κB信号通路及伴随的促炎细胞因子基因的表达(如IL-1和TNF-α)而发挥抗炎作用[21]。锌对黏膜有保护作用,锌还可以降低人体的炎症反应与氧化应激[22]。叶酸和维生素B12是真核细胞一碳代谢中必不可少的辅助因子,维生素B12中的Corrin环清除氰化物离子和活性氧。叶酸和维生素B12缺乏与脑、脉管系统、免疫系统、肝脏和胃肠道的炎症和损伤加重有关。当叶酸和维生素B12缺乏时,巨噬细胞促炎症细胞因子IL-1β和TNF-α表达明显上调,而补充叶酸和维生素B12则明显减少其表达,补充叶酸和维生素B12患者的血清TNF-α水平较对照组显著降低[23]。这些研究表明Hp可能通过影响微量元素的吸收而影响机体局部及全身炎症水平,从而促进COPD病情进展。
Hp感染导致肠道菌群失调而影响机体炎症状态。Hp感染与根除均可引起肠道菌群失调[24]。而肠道微生物又与机体炎症密切相关,肠道菌群可以通过Toll样受体、核因子κB和髓系分化因子88等多种途径调节炎症反应[25]。肠道菌群变化与血清炎症指标C反应蛋白、IL-6、TNF-α显著相关,且与双歧杆菌、乳酸杆菌呈负相关,与大肠杆菌、肠球菌呈正相关[26]。所以Hp可能通过影响肠道菌群而影响机体炎症反应。
综上所述,Hp可以导致COPD大鼠气道炎症因子水平升高,从而参与COPD发生、进展,这可能与Hp及其毒素误吸、局部炎症因子或Hp产物进入循环、微量元素降低、菌群失调相关,根除Hp可能使COPD患者受益。

