细胞角蛋白19片段21-1、转移相关基因1、切除修复交叉互补基因1在肺癌中的应用价值
张 杰,刘永昌,刘 浩
(山东省烟台市烟台山医院,山东 烟台 264001)
肺癌是全球面临的重大公共卫生问题,具有较高死亡率,患者预后较差,根据世界卫生组织的预测,中国2025年肺癌死亡人数将达到100万[1]。肺癌中,有八成及以上为非小细胞肺癌(non-small cell lung cancer, NSCLC)。研究发现[2],NSCLC发生、发展机制涉及多种基因改变。转移相关基因1(metastasis-associated gene 1, MTA1)通过信号转导,调控一系列与浸润转移相关的蛋白,参与多种恶性肿瘤的发展及侵袭过程[3]。切除修复交叉互补基因1(ERCC1)具有核苷酸切除修复功能,参与脱氧核糖核酸(deoxyribonucleic acid, DNA)损伤识别及DNA链切割过程,恶性肿瘤增殖引起DNA损伤,ERCC1表达随之升高[4]。细胞角蛋白19片段21-1(cytokeratin 19 fragments antigen 21-1, CYFRA21-1)作为细胞骨架成分,参与肿瘤细胞异常分裂过程,在正常组织或良性肿瘤组织中几乎不表达,但在上皮组织来源的恶性肿瘤细胞中表达显著升高[5]。本研究分析CYFRA21-1、MTA1、ERCC1检测在肺癌患者术前分期及淋巴结转移中的评估价值,现报道如下。
1 资料与方法
1.1 一般资料收集2019年1月至2021年12月我院96例NSCLC患者临床资料。纳入标准:①行择期胸腔镜肺癌根治术,经病理检查确诊;②符合美国国家癌症网络2018年发布的第5版临床实践指南NSCLC诊疗标准[6];③病理标本、病历数据完整。排除标准:①根治术前行抗肿瘤治疗;②根治术前存在急慢性感染;③非原发性NSCLC或合并肝细胞癌等其他恶性肿瘤;④合并强直性脊柱炎等免疫系统疾病;⑤伴心、肾等主要脏器功能不全。
1.2 方法取术中切除的NSCLC患者癌组织及距手术切缘>2 cm的癌旁组织,固定液使用pH 7.4的10%福尔马林,常规制作石蜡切片(4 μm);采用EnVision两步法(免疫组化)检测CYFRA21-1、MTA1、ERCC-1表达情况,常规脱蜡、梯度水化,微波修复3次,10 min/次,3%过氧化氢中封闭内源过氧化物10 min;分别滴加一抗兔抗人CYFRA21-1多克隆抗体(上海圻明生物科技,稀释浓度1∶1000)、鼠抗人MTA1单克隆抗体(中国中杉金桥,1∶150)、鼠抗人ERCC-1单克隆抗体(英国Abcam,1∶50),低温孵育12 h(4 ℃),滴加二抗(丹麦Dako,EnVisionTM试剂盒,生物素标记),室温孵育40 min,使用德国Sigma-Aldrich公司的二氨基联苯胺(Diaminobenzidine, DAB)显色90 s,并使用该公司生产的苏木精复染,梯度酒精脱水(无水乙醇至70%乙醇,30 s/梯度),常规透明、封片。使用双盲法(由两名工作年限≥5年的病理医师完成)阅片,高倍镜(×200)下随机观察5次,每次计数100个细胞,以阳性细胞比率+染色强度评估表达强度[7],阳性细胞比率分别计分0分(<10%)、1分(10%~30%)、2分(31%~50%)、3分(51%~75%)、4分(>75%);染色强度分别计分0分(无色)、1分(淡黄)、2分(棕黄)、3分(棕褐),2项相加的总分≥3分即为表达阳性,表达强度根据总分判断,3分为+,4~5分为++,6~7分为+++。
1.3 观察指标①NSCLC癌组织与癌旁组织CYFRA21-1、MTA1、ERCC-1表达情况;②NSCLC不同临床病理特征者癌组织CYFRA21-1、MTA1、ERCC-1表达情况;③NSCLC癌组织CYFRA21-1、MTA1、ERCC-1表达强度与病理特征的关联性分析。
1.4 统计学方法采用SPSS 23.0软件分析数据。计数资料以例数(%)表示,组间比较采用χ2检验;等级资料比较采用秩和检验;相关性分析采用Spearman秩相关分析。检验水准α=0.05。
2 结果
2.1 不同组织CYFRA21-1、MTA1、ERCC-1表达情况癌组织CYFRA21-1、MTA1、ERCC-1表达阳性率均高于癌旁组织(P<0.05)。见表1。

表1 癌组织与癌旁组织表达阳性率比较 [n(%)]
2.2 不同临床病理特征者癌组织CYFRA21-1、MTA1、ERCC-1表达阳性率比较淋巴结转移者癌组织MTA1、ERCC-1阳性率高于未淋巴结转移者(χ2=8.118、5.674,P<0.05),TNM分期Ⅲ~Ⅳ期者癌组织CYFRA21-1、MTA1、ERCC-1阳性率高于Ⅰ~Ⅱ期者(χ2=9.192、4.358、8.802,P<0.05)。见表2。
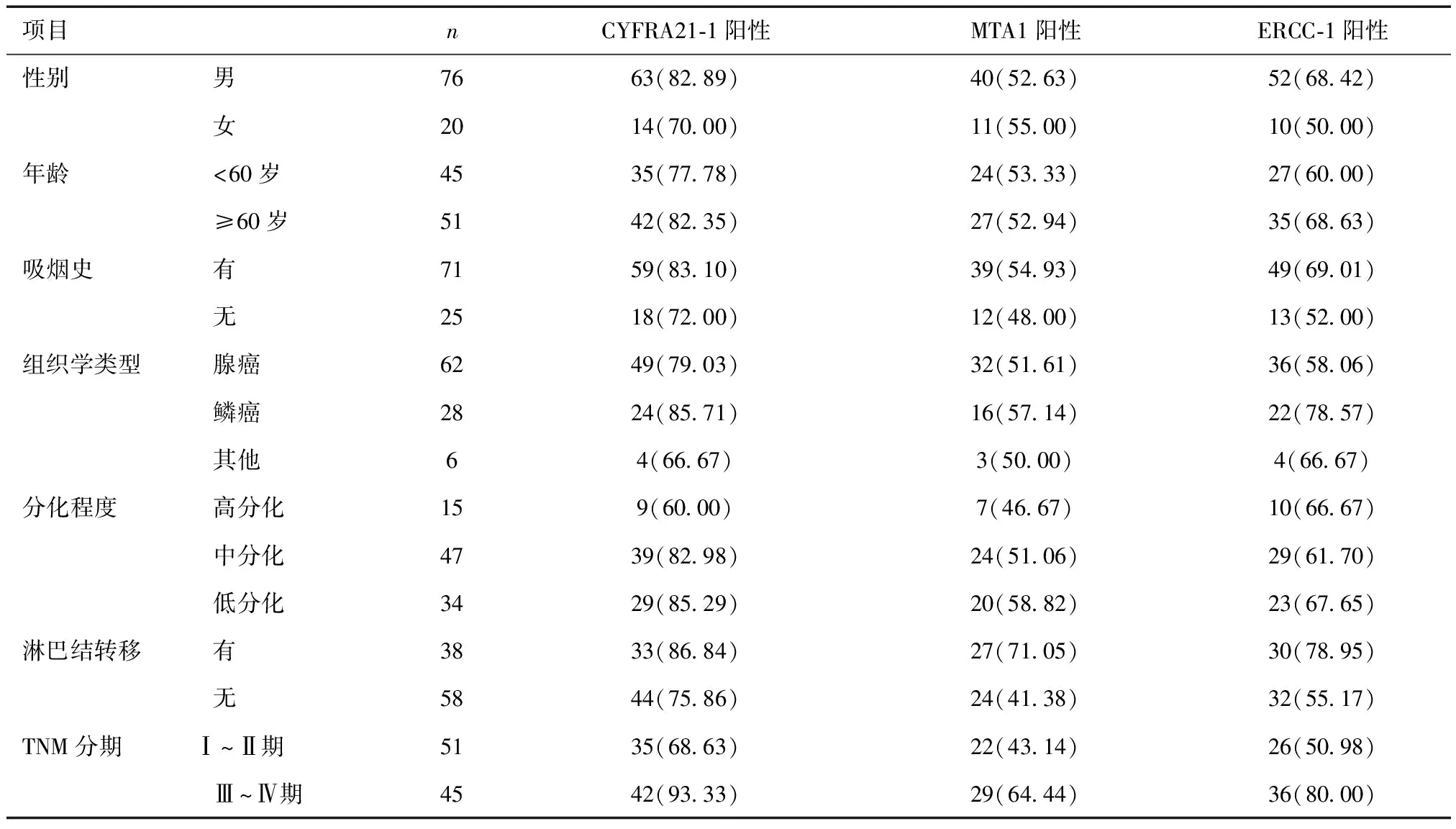
表2 不同临床病理特征者表达阳性率比较 [n(%)]
2.3 癌组织CYFRA21-1、MTA1、ERCC-1表达与NSCLC临床病理特征的关联性分析淋巴结转移者癌组织MTA1、ERCC-1表达强度显著高于未淋巴结转移者(Z=3.590、2.560,P<0.05),TNM分期Ⅲ~Ⅳ期者癌组织CYFRA21-1、MTA1、ERCC-1表达强度显著高于Ⅰ~Ⅱ期者(Z=3.424、2.484、3.163,P<0.05)。见表3。Spearman秩相关分析显示,NSCLC淋巴结转移与癌组织MTA1、ERCC-1表达强度呈正相关(r=0.496、0.442,P<0.001),TNM分期与癌组织CYFRA21-1、MTA1、ERCC-1表达强度呈正相关(r=0.690、0.558、0.594,P<0.001)。

表3 淋巴结转移、TNM分期不同者癌组织中CYFRA21-1、MTA1、ERCC-1表达强度比较 [n(%)]
3 讨论
MTA1基因在人染色体的定位由Nawa等经荧光原位杂交法发现,其位于14q32.3,且其互补DNA编码蛋白包含独立阅读开放框,为其基因转录的调节作用奠定基础,MTA1蛋白定位于细胞核内,无跨膜或膜相关功能,近年研究显示[8],MTA1蛋白异常表达在多种恶性肿瘤中可见。杨昕等[9]研究发现,MTA1在NSCLC患者中的表达率为79.07%,且MTA1高表达者预后不良风险更高。还有研究指出[10],MTA1高表达可能对血管内皮生长因子的表达有上调作用,从而加速肿瘤血管生成,为肿瘤细胞的侵袭及转移创造良好环境,下调MTA1的表达,可抑制肿瘤进展。本研究中,NSCLC患者癌组织MTA1表达阳性率明显高于癌旁组织,提示MTA1表达升高可能参与NSCLC的发生、发展。不仅如此,淋巴结转移及TNM高分期者癌组织MTA1阳性率及表达强度更高,且淋巴结转移及TNM分期与均MTA1表达强度呈正显著相关,提示MTA1的表达上调可能参与了NSCLC的侵袭及转移。然而,MTA1促进恶性肿瘤增殖的具体作用机制尚未阐明,本研究结果仅表明MTA1可能是NSCLC治疗的新靶点,还需后续基于分子生物学对其作用机制作进一步探究。
ERCC-1为DNA损伤修复基因,ERCC-1基因敲除的小鼠表现为细胞周期停滞、细胞,且由于是高度单链DNA核酸内切酶,在表达出特定蛋白时才具有DNA损伤修复功能,近年研究发现[11],ERCC-1表达异常与肺癌的发生有关。另外,ERCC-1基因被发现与铂类药物耐药机制密切相关,因ERCC-1可参与核苷酸切除修复,铂类化疗药物引起DNA损伤后,ERCC-1高表达者可迅速修复细胞分裂周期中的DNA损伤,导致化疗无效,即引起铂类药物耐药,故检测ERCC-1的表达水平对指导临床化疗具有重要意义[12]。本研究中,相较于癌旁组织,癌组织ERCC-1表达阳性率明显升高,且其表达强度与淋巴结转移及TNM分期呈明显正相关,考虑与NSCLC肿瘤细胞大量增殖、转移时,可引起更多的细胞DNA损伤,机体ERCC-1表达随之上调有关。
CYFRA21-1作为细胞重要的骨架蛋白,其表达异常可增加细胞异型性,促进肿瘤向周围邻近组织侵袭,甚至转移[13]。Cheng等[14]指出,CYFRA21-1可参与肺癌、乳腺癌等多种恶性肿瘤的发生,其血清检测目前常用于恶性肿瘤的早筛。本研究中,癌组织CYFRA21-1表达阳性率较癌旁组织明显升高,其表达强度与NSCLC临床分期呈明显正相关,与分化程度、淋巴结转移情况等无明显关联性,与目前研究发现有所不同[15]。该结果一方面与本研究纳入样本量不足,导致检验效能偏低有关;另一方面,NSCLC肿瘤细胞的恶性与侵袭能力与多种基因表达有关,单一CYFRA21-1的表达情况不能全面评估其侵袭能力,故其与淋巴结转移的相关性较差。
综上所述,CYFRA21-1、MTA1、ERCC-1可能均参与了NSCLC的发生、发展,检测三者的癌组织表达水平对判断NSCLC侵袭及转移能力有积极作用,可指导临床治疗。

