CT 增强联合外周血炎症指标诺模图术前诊断肾透明细胞癌WHO/ISUP 分级
刘厚军 黄国权 张虎 徐家军 谢闵 刘欢
肾细胞 癌(renal cell carcinoma,RCC)临床常见[1],肾透明 细胞癌(clear cell RCC,CCRCC)占RCC 70%~80%[2],是最常见亚型。2016 年世界卫生组织(World Health Organization,WHO)/国际泌尿病理学会(International Society Of Urological Pathology,ISUP)推荐采用新的分级系统进行病理分级[3],该系统可重复性好,更加客观,与临床预后分层相关性更强[3,4],治疗前准确诊断,对治疗决策实施和预后判断意义重大。
CT 增强是肾肿瘤一线影像学检查方法,在肿瘤诊断、RCC 分期中价值较高、运用广泛[5]。CT 征象、CT 定量参数值如包膜不完整、瘤内血管、肿瘤大小、实质期CT 净增值等在WHO/ISUP 高、低级别CCRCC 中存在差异[6,7]。外周血中性粒细胞、淋巴细胞和血小板参与全身炎症反应,基于三者的衍生炎症指标和WHO/ISUP 分级类似,与RCC 预后相关[8,9]。有证据显示[10],中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)与RCC较高的T 分期和肿瘤坏死相关,NLR 和公认的预后标志物结合,可提高预后判断的准确性。最近一项涉及6887 名RCC 患者的研究显示[11],系统免疫炎症指数(systemic immune-inflammation index,SII)水平高,RCC 患者总 体生存率低(HR:1.45,P <0.001)、病理分级高(RR:1.54,P=0.004)、肿瘤分期高(RR:1.67,P=0.045)。CT 增强、外周血炎症指标均与RCC 病理分级相关。本研究收集经手术病理证实的144 例CCRCC 患者资料,探讨术前CT增强联合外周血炎症指标诊断CCRCC WHO/ISUP分级的价值,并构建诺模图,旨在找寻更加直观实用的诊断方法。
1 资料与方法
1.1 一般资料
回顾性搜集2017 年2 月—2023 年2 月于皖南医学院第二附属医院和芜湖市第二人民医院行手术治疗的144 例CCRCC 患者资料。纳入标准:1) 术前均行CT 增强和外周血常规检查,资料完整;2)术前未行穿刺活检或针对性治疗;3)术后诊断为CCRCC,并行WHO/ISUP 分级。排除标准:1)合并其他恶性肿瘤,遗传或多发性CCRCC;2)肿瘤实性成分少,无法进行准确测量;3)合并急慢性炎症、血液或免疫系统疾病。登记患者年龄、性别、肿瘤发生部位。病理科医师根据WHO/ISUP 分级标准分析CCRCC 根治术后组织切片,并做出最终病理分级(1~4 级)的诊断,本研究根据术后病理将1~2 级划为低级别组(106 例);3~4 级归为高级别组(38 例)。
1.2 检查方法
使用GE Light Speed 16 排、GE Optima 680E 64排、Philips Brilliance 128-iCT 或Philips Brilliance 256-iCT 扫描仪完成检查。患者仰卧,头先进,双臂上举,扫描前行呼吸训练,扫描范围从胸11 椎体下缘至腰1 椎体下缘,若肿瘤超出所扫区域则需进行加扫。采用自动管电流调控技术(Z-DOM),设定管电流基准值120 mAs,层厚5 mm,层间距5 mm,依次进行平扫、增强扫描,增强采用双筒高压注射器,按1.0 mL/kg 体重向肘静脉留置针内以流率2.5~3.5 mL/s 注入非离子型对比剂(碘浓度280~320 mg I/mL),再追加生理盐水30 mL。肾皮质期延迟25~40 s,肾实质期延迟70~90 s。
1.3 图像分析与数据获取
两名10 年以上影像诊断经验的放射科医师采用盲法阅片,经协商达成一致意见。观察内容包括:1)形态:圆形或椭圆形被认定为形态规则,边缘分叶视为形态不规则;2)边缘:肿瘤与肾脏或肾周脂肪交界面不清晰,或肿瘤包膜连续性中断视为边缘模糊;3)瘤内血管;4)瘤周血管;5)癌栓;6)出血;7)坏死;8)钙化。在PACS 工作站进行数据测量,测量肿瘤前后径、左右径、上下径;平扫、皮质期、实质期肿瘤实性部分CT 值;皮质期、实质期患侧肾脏的皮质CT 值。测量时需综合多时相图像,肿瘤实性部分兴趣区(region of interest,ROI)尽量放大,并避开坏死、出血、钙化、边缘及血管等;ROI 在平扫、皮质期和实质期放置于相同部位。若观测者间测量值变异小于10%,则将平均值视作最终结果;变异大于等于10%,则判定观测者间存在分歧,两位医生需重新达成共识[12]。各测量值公式如下:
外周血常规检查于术前1 周内完成,记录每位患者中性粒细胞、淋巴细胞、血小板计数,并计算NLR、血小板/淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)和SII。
1.4 统计学分析
采用SPSS 23.0、R(4.1.2)软件进行统计分析。计数资料采用χ2检验。定量资料先行正态性检验,正态分布指标以表示,采用独立样本t 检验进行组间比较;非正态分布指标以M50(P25,P75)表示,组间比较采用秩和检验。多因素Logistic 回归筛选独立预测因子并构建联合模型;采用受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under curve,AUC)评估各独立预测因子和联合模型效能;DeLong 检验用于比较联合模型与各独立预测因子AUC 值间的差异。校准曲线评价模型校准度;5 折交叉验证评估模型稳定性;决策曲线评估模型临床净获益。P<0.05 视为差异有统计学意义。
2 结果
2.1 高低级别CCRCC 观测指标单因素分析
CCRCCWHO/ISUP 1 级24 例,2 级82 例,3 级33 例,4 级5 例(图1、2)。高级别与低级别组间观测指标:大小、边缘模糊、皮质期CT 值、皮质期净增值、皮质期强化率、实质期CT 值、实质期净增值、实质期强化率、NLR、SII 间有统计学差异(P<0.05)(表1)。
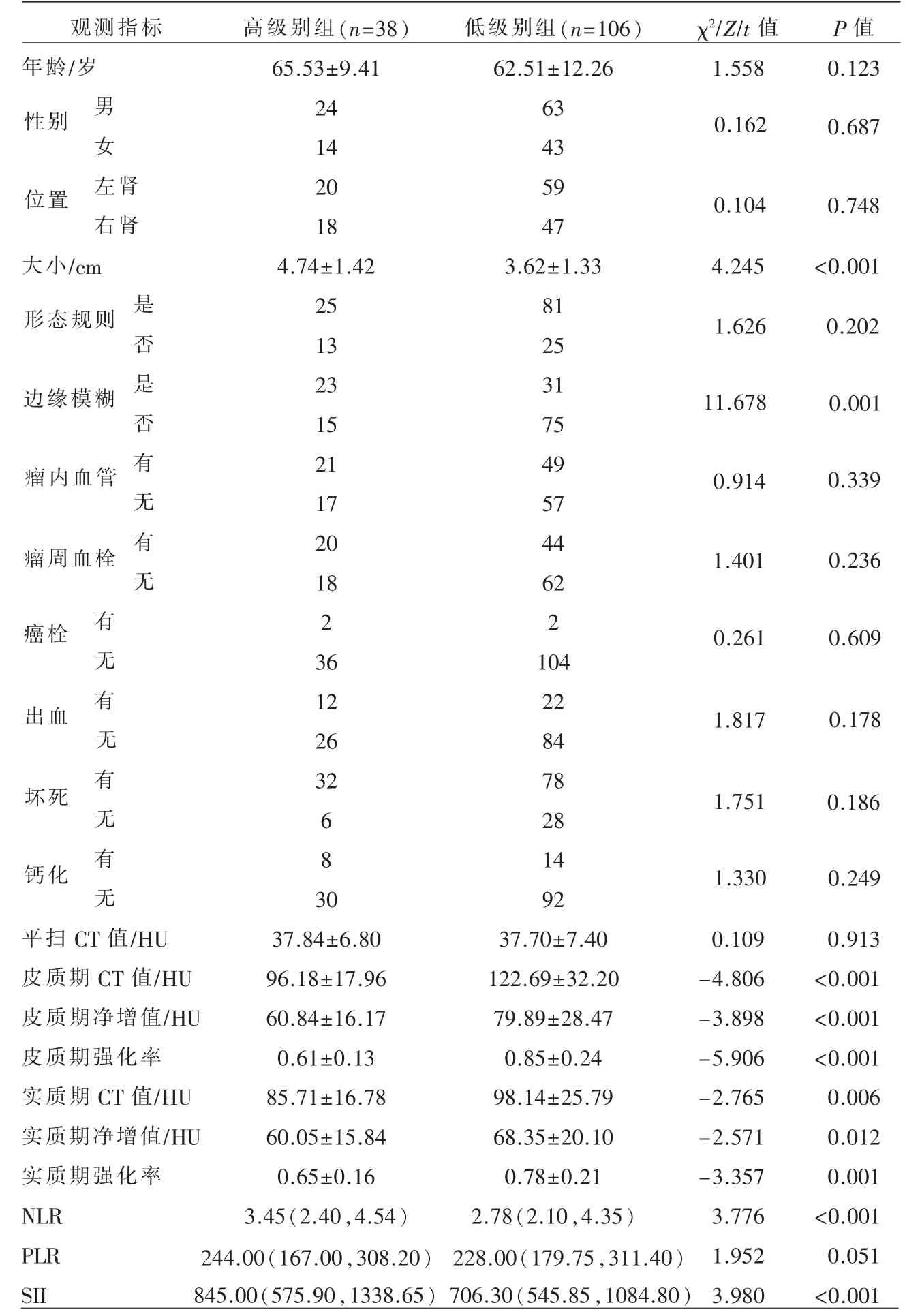
表1 高级别和低级别CCRCC 观测指标组间比较
2.2 高低级别CCRCC 多因素Logistic 回归分析
CCRCC WHO/ISUP 分级为因变量,自变量为CT 增强、外周血炎症指标有统计差异的观测指标(P<0.05);多因素Logistic 回归分析共筛选出4 个独立预测因子,分别是大小(OR=1.681,95%CI:1.160~2.435,P=0.006)、边缘模糊(OR=5.549,95%CI:1.805~17.063,P=0.003)、皮质期强化率(OR=2.577,95%CI:1.624~4.084,P<0.001)、SII(OR=1.189,95%CI:1.066~1.325,P=0.002)。
2.3 模型构建和诊断效能分析
构建独立预测因子:大小、边缘模糊、皮质期强化率和SII 单独诊断模型和联合诊断模型(图3a),绘制诺模图(图3b),诺模图AUC 为0.910(95%CI:0.862~0.958,P<0.001),诊断效能优于各单变量(均P<0.05)(表2)。校准曲线表现出了较高的校准度(图3c)。5 折交叉验证(图4)平均AUC 为0.896,与诺模图AUC 值基本相符。决策-曲线分析:预测概率在0~1 时临床有获益(图5)。

表2 独立预测因子和诺模图诊断效能分析
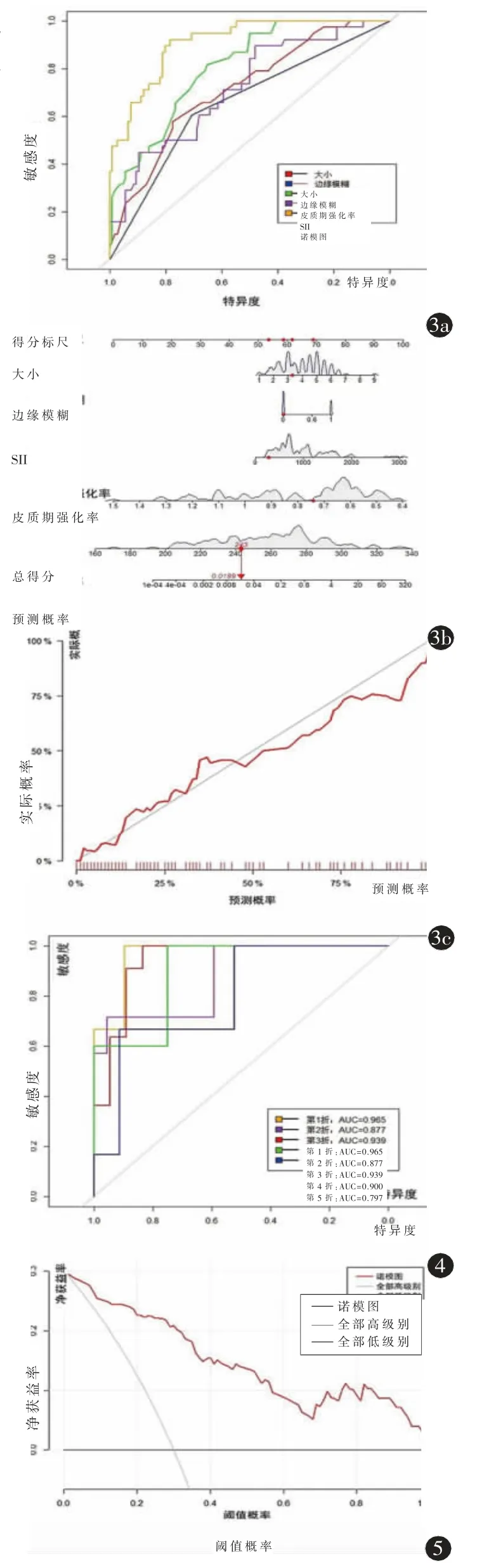
图3 诺模图的构建。a)大小、边缘模糊、皮质期强化率、SII 及诺模图术前诊断CCRCC WHO/ISUP 分级的ROC 曲线;b)预测模型诺模图,该图展示第42 位患者,总得分243,诺模图诊断其高级别CCRCC 概率为1.89%,实际该患者是低级别CCRCC,诊断结果与实际符合;c)诺模图校准曲线。图4 5折交叉验证。平均AUC 为0.896。图5 决策-曲线。预测概率在0~1 时临床有获益。
3 讨论
WHO/ISUP 低级别和高级别CCRCC 治疗策略和预后存在显著差异,术前正确诊断可指导临床决策,意义重大。研究表明,高级别CCRCC 具有更强的生物学攻击性,更差的生存率和更高的术后复发风险[13]。本研究结果表明,CT 增强、外周血炎症指标可用于术前诊断CCRCC WHO/ISUP分级;大小、边缘模糊、皮质期强化率和SII 是该分级的独立预测因子。诺模图可将结果可视化,在疾病诊断、严重程度评估、预后判断等方面有大量工作总结[14-16]。本研究采用CT 增强和外周血炎症指标构建CCRCC WHO/ISUP 分级的术前诊断模型,诺模图AUC 为0.910,诊断效能优于各单变量(均P<0.05),敏感度达92.1%,临床价值较高,稳定性良好,有明确临床获益。
肿瘤大小是肿瘤治疗评估重要指标之一,实体肿瘤的影像学径线测量结果较为可靠。研究表明[17],高级别CCRCC 最大径(63.21 mm)明显大于低级别(42.35 mm)(P<0.01)。本研究采用肿瘤平均直径(即大小)进行高低级别CCRCC 组间比较,也得到一致结论,笔者分析认为,CCRCC 分级高,一般恶性度更高,生长更快,体积更大,大小可定量反映侵袭性CCRCC 快速生长的生物学特点。
大多数CCRCC 膨胀性缓慢生长,肿瘤和周围组织交界面可产生炎症反应,导致纤维结缔组织增生,形成假包膜,假包膜不仅能限制CCRCC生长、扩散;还可为CCRCC 手术切除提供重要组织学标志。众所周知,CT 增强假包膜直接显示率不足,王佳妮等[18]研究发现,CT 增强在自身免疫性胰腺炎中假包膜显示率为57.58%,MRI 为77.14%。边缘模糊间接反映CCRCC 生长突破假包膜限制,或CCRCC 浸润性快速生长,未形成假包膜,上述种种均提示CCRCC 高侵袭。Xv 等[6]研究结果表明,包膜不完整(OR=4.57,P <0.001)为CCRCC 高分级独立预测因子,与本研究变量边缘模糊(OR=5.549,P=0.003)得出的结论基本一致。
CT 增强定量参数可反映肾脏和CCRCC 血供特点,并间接反映CCRCC 微血管密度(microvessel density,MVD)[19],一般而言,肿瘤血管性越强血供越丰富,CT 增强越显著。本研究中,CCRCC 高分级组CT 增强定量参数低于低级别组(均P<0.05),分析原因可能是高级别CCRCC 中存在更多的组织坏死,这些坏死区内肿瘤MVD 降低,血管性降低,血供减少,在CT 增强中呈相对低强化。Yi 等[7]研究发现高级别CCRCC 实质期净增值小于低级别组(38.76 比49.66,P=0.001),与本研究类似。本研究结果表明,皮质期强化率(OR=2.577,P<0.001)是诊断CCRCC 分级的最佳定量参数,AUC 为0.806,可能原因为患肾皮质和CCRCC 血供一致,利用肾皮质增强代表碘负荷参考可纠正CCRCC 增强的固有偏差。Zhu 等[12]在CCRCC Fuhrman 分级研究中证实,皮质期强化率优于其他CT 定量参数,诊断该分级的AUC 最大,(AUC 为0.926),与本研究结果基本一致。
炎症反应在炎-癌转化、肿瘤进展、侵袭转移等时期均发挥重要作用。肿瘤形成、生长过程中,大量炎症细胞及其释放物(炎性因子)浸润肿瘤间质,同时多伴有外周血炎症指标一系列改变[20]。本研究发现,SII(OR=1.189,P=0.002)是CCRCC 高分级的独立预测因子,原因可能为:1)血管内皮生长因子、白介素-18、基质金属蛋白酶等中性粒细胞分泌物可直接作用于肿瘤细胞,促进其生长[8],CCRCC 侵袭性越高,上述物质需求量越大,进而导致中性粒细胞数量升高;2)血小板产生的细胞因子不仅可促进肿瘤血管生成,还可降低自然杀伤细胞活性,导致肿瘤细胞清除减缓[21],最终使肿瘤快速生长、侵袭;3)淋巴细胞释放的细胞因子可诱导肿瘤细胞凋亡,还可启动人体免疫应答,从而抑制肿瘤增殖、生长[22]。中性粒细胞和血小板增多,淋巴细胞减少,上述外周血细胞计数共同变化,导致SII 值增大,SII 和NLR、PLR 均可代表人体全身炎症反应,SII综合了3 个指标的变化,被认为是较可靠的炎症指标定量参数。Tang 等[23]比较了NLR、PLR、SII 等炎症指标与RCC 术后总生存率的关系,结果发现SII表现出最佳预测性能,与本研究诊断CCRCC WHO/ISUP 分级的结果类似。
本研究的不足:1)虽然病例来自两个中心,样本量仍偏少,CCRCC 高级别占比低,可能造成选择偏倚;2)未纳入其他亚型RCC,CT 增强、外周血炎症指标与其他亚型RCC 组织病理学间的关系还需进一步深入研究。
总之,基于CT 增强、外周血炎症指标构建的诺模图可用于术前诊断CCRCC WHO/ISUP 分级,并能将结果可视化,对CCRCC 治疗决策有重要参考价值。