非小细胞肺癌患者免疫相关不良事件与患者疗效和预后的相关性
余德旺,靳红领,王炎,董嘉兴
[南阳南石医院(河南大学附属南石医院) 胸外科,河南 南阳 473000]
肺癌在全球所有恶性肿瘤中的发病率和死亡率最高,其中80%~85%被诊断为非小细胞肺癌(non-small cell lung cancer,NSCLC)。研究证明,以程序性死亡受体1(programmed death-1,PD-1)/程序性死亡受体配体1(programmed death-ligand 1,PD-L1)抑制剂为代表的免疫检查点抑制剂(immune checkpoint inhibitors,ICI)可为NSCLC患者提供长期生存和持久临床获益[1],然而,仅在少数患者(10%~30%)中观察到生存获益[2]。因此,确定ICI的主要获益人群和预后指标至关重要。研究显示,PD-L1表达[3-4]、肿瘤突变负荷(tumor mutation burden,TMB)[5]、主要组织相容性复合体(major histocompatibility complex,MHC)分子表达[6]、微卫星不稳定性高(microsatellite instability-high,MSI-H)[7]与ICI获益之间存在关联,是目前临床最常用的疗效预测标志物,但不足以进行最佳选择。探索其他经济实用因素来预测ICI治疗的疗效和预后具有重要价值。
随着ICI的广泛使用和治疗适应证的不断拓展,ICI诱导的免疫系统激活可导致自身耐受性丧失,表现为自身免疫性炎症和各种组织器官功能障碍,发生免疫相关不良事件(immune related adverse events,irAEs)[8]。接受PD-1/PD-L1抑制剂单药治疗的NSCLC患者irAEs发生率为33.1%[9]。目前研究发现,irAEs的出现提示抗肿瘤效果好,且与患者的病情控制及生存期延长之间存在潜在关联[10-11]。发生irAEs是否表明肿瘤对ICI的反应更佳仍然存在争议。本研究回顾性分析接受ICI单药治疗的96例NSCLC患者中irAEs的发生情况,旨在探讨ICI的irAEs能否成为预后评估和疗效预测指标,为临床决策提供一些指导。
1 对象与方法
1.1 研究对象
收集2019年5月至2022年5月在南阳南石医院(河南大学附属南石医院)接受ICI治疗的96例NSCLC患者临床资料。入组标准:(1)经病理学确诊NSCLC;(2)肺癌TNM分期为Ⅲb~Ⅳ期,无手术指征;(3)至少接受过1剂ICI治疗;(4)至少存在1个符合实体瘤疗效评价标准的可评价病灶;(5)病史资料记录较完善。排除标准:(1)其他部分重要器官严重异常、活动性自身免疫性疾病;(2)有药物过敏史;(3)ICIs联合其他治疗;(4)合并第二原发肿瘤。本研究经医院医学伦理委员会批准进行。
1.2 诊断标准
1.2.1客观疗效
使用实体瘤反应评估标准1.1版[12]评估对治疗的最佳客观反应。综合疗效评价分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD),客观缓解率(overall response rate,ORR)为CR与PR之和占总病例数的百分数;疾病控制率(disease control rate,DCR)为PR、CR及SD之和占总病例数的百分数。
1.2.2irAEs
采用美国国家癌症研究所不良事件通用术语标准(CTCAE)4.0版评估irAEs[13],如皮肤毒性、内分泌毒性、免疫相关肝炎、腹泻/结肠炎、胰腺毒性、肺炎、骨关节与肌毒性、神经毒性、血液毒性、肾脏毒性、心脏毒性及眼毒性等。
1.3 治疗方法
派姆单抗或纳武利尤单抗按照药品说明书规定的常规用量用法使用,每14 d用药1次,直至患者不耐受或病情进展。综合疗效CR、PR为对ICI治疗有应答,否则为无。
1.4 分析方法
根据irAEs发生情况将患者分为irAEs组和非irAEs组,发生irAE患者根据irAEs数目分为单一irAEs组和多重irAEs组。记录患者一般临床资料,包括年龄、性别、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分、吸烟状态、肿瘤组织学类型、治疗线数、治疗药物等。对96例患者以电话或门诊复查的方式进行随访,统计患者的CR、PR、SD、PD、ORR、DCR、无进展生存时间(progression-free survival,PFS)和总生存时间(overall survival,OS),直至患者死亡、失访。
1.5 统计学方法
数据应用SPSS 20.0统计软件进行分析。irAEs组和非irAEs组、应答组和无应答组间的对比应用χ2检验或Fisher精确概率法。采用Kaplan-Meier法估计生存率和绘制生存曲线,生存分析运用Landmark分析。log-rank检验用于比较两组患者之间生存率的差异。应用Cox回归分析影响预后的因素。P<0.05为差异有统计学意义。
2 结果
2.1 irAEs组和非irAEs组临床资料
irAEs组和非irAEs组年龄、性别、体重指数(body mass index, BMI)、吸烟史、组织学类型、治疗药物、治疗线数比较,差异无统计学意义(P>0.05)。见表1。

表1 irAEs组和非irAEs组患者临床资料比较[n(%)]
2.2 疗效及ORR、DCR
96例患者中,发生irAEs患者31例,irAEs发生率为32.3%(31/96),irAEs组ORR、DCR高于非irAEs组(P<0.05)。见表2。
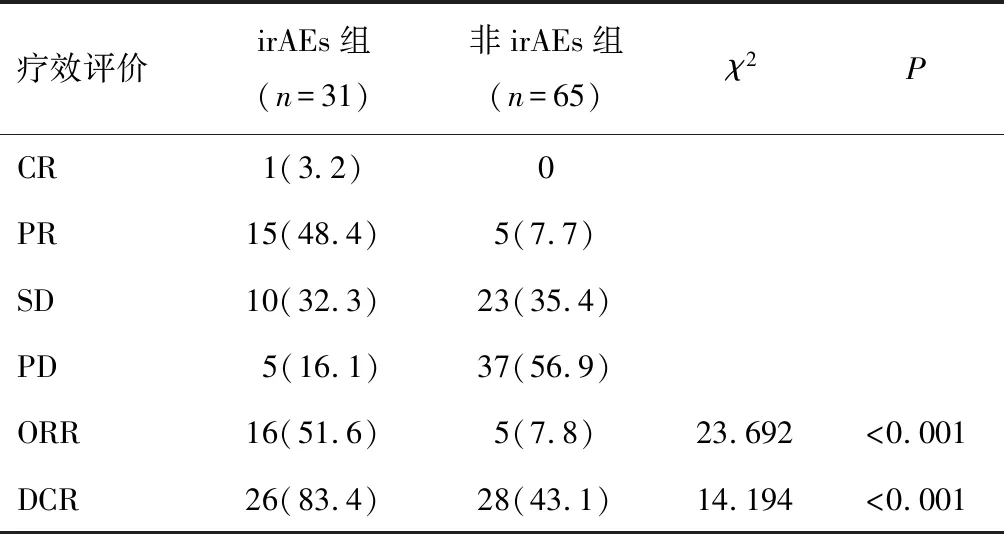
表2 irAEs组和非irAEs组患者的疗效及ORR、DCR比较
2.3 发生irAEs患者和未发生irAEs患者的PFS和OS
发生irAEs患者和未发生irAEs患者的PFS分别为8.9个月(95% CI:7.3~10.5)和2.1个月(95% CI:1.6~2.7)。发生irAEs患者和未发生irAEs患者的OS分别为26.4个月(95% CI:23.5~29.2)和8.7个月(95% CI:7.5~10.0)。发生irAEs患者的PFS和OS长于未发生irAEs的患者(P<0.001)。
2.4 影响irAEs患者预后的单因素和多因素分析
单因素分析显示,ECOG评分(0~1分)、组织学类型、发生irAEs是PFS的影响因素,年龄、ECOG评分(0~1分)、免疫治疗线数、发生irAEs是OS的影响因素(P<0.05)。见表3。多变量分析显示,ECOG评分(0~1分)、发生irAEs是PFS的独立保护因素(HR=2.67,95% CI:1.86~3.71,P=0.018;HR=0.32,95% CI:0.16~0.76,P<0.001),也是OS的独立保护因素(HR=2.52,95% CI:1.29~4.83,P=0.032;HR=3.86,95% CI:2.47~6.25,P<0.001)。
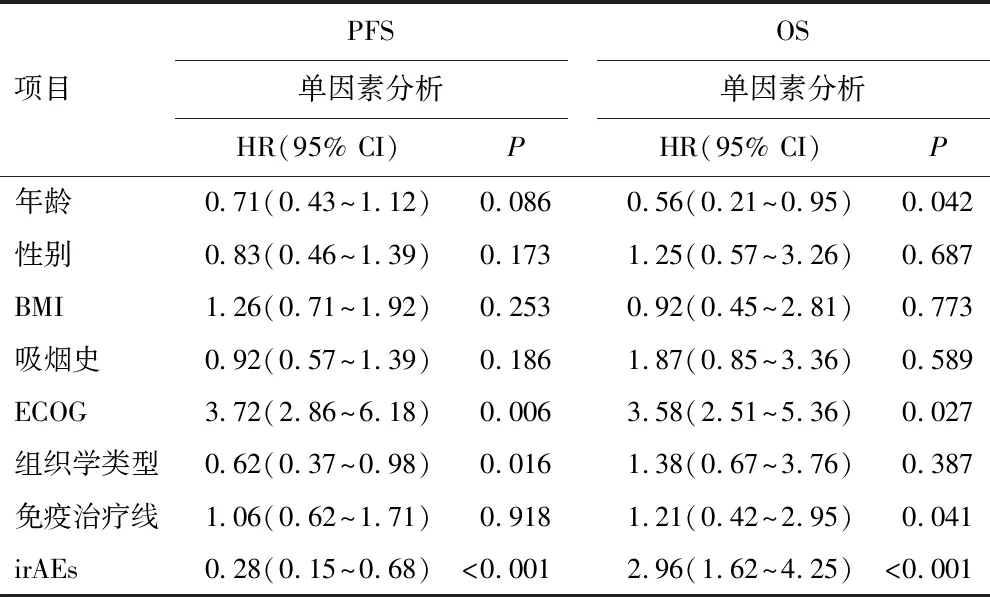
表3 影响irAEs患者预后的单因素和多因素分析
2.5 多重irAEs组和单一irAEs组患者资料
多重irAEs组16例(51.6%),单一irAEs组15例(48.4%)。多重irAEs组应答率高于单一irAEs组(P<0.05)。见表4。

表4 多重irAEs组和单一irAEs组患者资料比较[n(%)]
2.6 多重irAEs组和单一irAEs组患者的PFS和OS
多重irAEs组和单一irAEs患者的PFS分别为8.6个月(95% CI:6.9~10.3)和2.2个月(95% CI:1.5~2.8),多重irAEs组和单一irAEs患者的OS分别为29.6个月(95% CI:27.8~31.4)和19.0个月(95% CI:15.3~24.6)。多重irAEs组患者的PFS和OS长于单一irAEs患者(P<0.05)。
3 讨论
越来越多的文献表明,irAEs的发生可预测各种实体瘤的PD-1和抗PD-L1抗体反应,与未发生irAEs的患者相比,发生irAEs的患者在PFS、OS和总反应率方面表现出显著改善,在黑色素瘤[14]、食管鳞状细胞癌[15]和尿路上皮癌[16]中均有数据支持这一结论。本文研究显示,NSCLC患者irAEs发生率为32.3%,与既往研究结果[9]相符。在接受ICI治疗的NSCLC患者中,与未发生irAEs的患者相比,发生irAEs的患者ORR、DCR更好,irAEs发生与良好预后具有相关性[17]。伴有或不伴有irAEs的NSCLC患者的PFS和OS存在差异,出现irAEs的患者PFS和OS时间更长,irAEs与ICI治疗的更高的ORR、DRR与更长的PFS和OS相关,提示irAEs的出现与有效的抗肿瘤反应及生存率之间存在密切关联,irAEs的发生与ICI的临床受益可能相关,在使用ICI进行免疫治疗期间发生的irAEs可能是晚期NSCLC患者临床获益的预测性替代标志物。T细胞的激活最终会引起抗肿瘤反应,irAEs的发展表明对肿瘤和健康组织的强烈免疫反应,从而预测更好的治疗反应[18-19]。Xu等[20]研究显示,接受抗PD-1抗体治疗的肝细胞癌患者中,irAEs组中位PFS、中位OS长于非irAEs组,低级别的irAEs可以更好预测HCC患者的ICI治疗效率。Grangon等[21]比较了合并irAEs患者与未合并irAEs患者的OS、PFS、ORR和DCR,与未合并irAEs患者相比,合并irAEs患者ORR和DCR明显更好,OS和PFS更长。上述结论也验证本研究结果。
本研究中多变量分析显示,ECOG评分(0~1分)、发生irAEs是PFS、OS预后的独立保护因素,irAEs的发展有可能预测接受ICI治疗的NSCLC患者的生存结果。Booka等[15]回顾性分析接受纳武利尤单抗治疗的食管鳞状细胞癌患者的数据,多变量分析显示,ECOG PS ≥2 和未发生irAEs是不良预后影响因素。大多数既往研究仅评估了irAEs发展与预后的关联,irAEs发生类别及严重程度与OS和PFS益处相关[11,14,16,20]。与既往研究不同的是,本研究关注 irAEs的数量与抗肿瘤反应之间的关联,结果显示,应答组的多重irAEs发生率高于无应答组,对ICI治疗有反应的患者中多重irAEs的发生率更高,多重irAEs的发生提示机体对ICI治疗具有更好的反应。与单一irAEs相比,多重irAEs的发展与更长的生存期相关,具有多个irAEs的患者的PFS、OS优于具有单个irAEs的患者。ICI本质上会刺激全身免疫反应,irAEs的发生、患者中irAEs的数量都应该与ICI抗肿瘤作用相关,即ICI更强的全身免疫激活诱导多种irAEs和更好的抗肿瘤作用。多种免疫介导的毒性的发展可能反映了持续的抗肿瘤反应。多种irAEs的发展可能是预测疗效和改善预后的标志物。患者是否出现多种irAEs可以反映ICI的疗效与其免疫激活程度之间的关联。发生单一irAEs的患者可能倾向于发生特定irAEs,但irAEs并不能反映ICI治疗后的全身免疫激活强度。另一方面,多种irAEs的发展可能代表ICI诱导的高度全身免疫激活。ICI不仅靶向肿瘤特异性T细胞,还靶向其他T细胞,并可能导致非肿瘤特异性T细胞的意外激活,从而导致多种器官发生irAEs。最近的研究表明,针对肿瘤和正常组织中相关抗原的交叉反应性T细胞可能参与irAEs发病机制,ICI既产生irAEs又产生抗肿瘤功效,irAEs的数目可能是ICI疗效和预后的重要预测指标[22]。
4 结论
本研究结果显示,irAEs具有简单经济、易于动态监测等优点,其发展与临床益处相关,例如更好的治疗反应或更长的生存期。与单一irAEs相比,多重irAEs的发展与更好的抗肿瘤反应和更长的生存期相关。本研究的局限性在于其回顾性和相对较小的样本量,难免产生信息偏倚。此外,大多数患者接受PD-1抑制剂作为二线治疗或以上治疗。因此,基线免疫炎症的程度可能会受到先前治疗的影响,尽管免疫治疗线的数目与临床结果无关。同时,这些回顾性数据受到观察时间偏差的影响,因为更长的治疗时间带来更高的irAEs风险。因此应谨慎解释本研究结果,还需大样本、前瞻性研究和生物标志物分析来验证本结论。

