利用生物信息学鉴定影响卵巢癌预后的TGF-β信号通路相关基因
张晓雪,张会敏,牛亚蒙,梁若鹏,韩丽萍
(郑州大学附属第一医院 a.体检科;b.妇科;c.肝胆胰外科,河南 郑州 450052)
卵巢癌是全球女性因癌症死亡的主要原因之一,其早期临床表现有限,当患者就诊时,疾病往往已经进展到一定程度,且卵巢癌的复发率和化疗耐药性较高[1-2]。此外,卵巢癌发生和发展的细胞和分子机制十分复杂,包括但不限于细胞异质性、表观遗传调控和多个信号通路的串扰。因此,有必要进一步研究其潜在机制,为诊断、预后和靶向治疗提供新的生物标志物。转化生长因子-β(transforming growth factor-β,TGF-β)信号通路是调节细胞行为,如增殖、凋亡、迁移和分化的关键途径。在癌症中,TGF-β信号通路具有双重作用,即在早期通过抑制促进细胞生长基因的表达和促进促凋亡基因的表达发挥抑癌作用[3],在晚期通过触发上皮间质转化(epithelial-mesenchymal transition,EMT)和与MAPKs串扰发挥促癌作用[4]。越来越多的研究聚焦到卵巢癌抗TGF-β疗法。Trabedersen是TGF-β2的反义寡核苷酸,D’Cruz等[5]通过小鼠成瘤实验发现在卵巢癌中联合使用Trabedersen和紫杉醇与单独使用紫杉醇相比,降低了肿瘤负荷,并提高了总体生存率。LY2109761是一种影响TGF-β受体Ⅰ/Ⅱ激酶活性的小分子抑制剂,与顺铂联合使用时,在卵巢癌小鼠模型中可降低耐药性[6-7]。LY2157299是一种针对细胞膜TGF-β受体酪氨酸激酶功能的药物,研究表明其可以减弱卵巢癌细胞系对TGF-β信号传导的反应,并减少卵巢癌患者来源的异种移植模型中的肿瘤负荷和腹水形成[8]。A-83-01特异性靶向TGF-β受体Ⅰ,在OV2944-HM-1癌细胞系的同源小鼠模型中发现,注射A-83-01能够减少肿瘤播散,改善生存[9]。此外,有研究报道TGF-β信号参与结直肠癌[10]、乳腺癌[11]和肺癌[12]肿瘤微环境的重塑。因此,筛选TGF-β信号通路相关基因并研究其在癌症中的作用有望指导癌症患者的治疗。随着高通量测序和生物信息学的发展,可以利用公共数据库对人类疾病进行更深入的挖掘。然而,TGF-β信号通路相关基因对卵巢癌预后和肿瘤微环境的影响尚不清楚。因此,本研究旨在鉴定新的TGF-β信号通路相关基因用于预测卵巢癌患者的预后,并探索它们在卵巢癌肿瘤微环境中的作用。
1 资料与方法
1.1 数据来源
352例卵巢癌患者的转录组数据和临床信息下载于癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer.gov),该群体作为训练集;GSE13876数据集中415例卵巢癌患者的转录组数据和临床信息下载于基因表达集锦(gene expression omnibus,GEO)数据库(https://www.ncbi.nlm.nih.gov/geo/),该群体作为验证集;121个TGF-β信号通路相关基因下载于分子标签数据库(the molecular signatures database,MSigDB)数据库(https://www.gsea-msigdb.org/gsea/msigdb/)。
1.2 一致性聚类分析
基于TGF-β信号通路相关基因的表达,利用R包“Consensus Cluster Plus”对训练集中的卵巢癌患者进行一致性聚类分析,使用累积分布函数和累积分布函数曲线下面积的相对变化确定聚类数量,使用主成分分析评估聚类的效果。同时,通过CIBERSORT算法计算卵巢癌患者的免疫细胞浸润水平(记忆B细胞、初始B细胞、活化树突状细胞、静息树突状细胞、嗜酸性粒细胞、M0巨噬细胞、M1巨噬细胞、M2巨噬细胞、活化肥大细胞、静息肥大细胞、单核细胞、中性粒细胞、活化NK细胞、静息NK细胞、浆细胞、活化CD4+记忆T细胞、静息CD4+记忆T细胞、初始CD4+T细胞、CD8+T细胞、卵泡辅助性T细胞、γδT细胞、调节性T细胞),利用ESTIMATE算法计算卵巢癌患者的免疫评分、基质评分、肿瘤纯度评分,比较不同聚类间卵巢癌患者的肿瘤免疫微环境是否存在差异。
1.3 预后基因的鉴定
利用R包“limma”筛选不同聚类间的差异表达基因,筛选标准为假阳性率(false discovery rate,FDR)<0.01以及|log2FC|>0.585。利用单因素Cox回归分析从差异表达基因中筛选与卵巢癌预后相关的基因,筛选标准为P<0.01。根据预后基因的表达量,将卵巢癌患者分为预后基因高表达组和低表达组,比较高、低表达组间卵巢癌患者的生存差异。
1.4 预后评分系统的建立
利用预后基因进行主成分分析,根据每个基因前2个主成分(PC1和PC2)的得分计算卵巢癌患者的预后评分。随后根据评分中位数将卵巢癌患者分为高、低评分组,比较高、低评分组间卵巢癌患者的生存差异,P<0.05为差异有统计学意义。此外,将预后评分和临床特征纳入多因素Cox回归分析,检测预后评分是否为卵巢癌的独立预后因素。
1.5 预后评分在卵巢癌中的作用
(1)比较不同亚型、有/无淋巴浸润以及不同肿瘤残余病分组之间的预后评分。(2)比较预后评分低分组和高分组之间的免疫、基质、估计评分和肿瘤纯度。(3)比较预后评分低分组和高分组之间免疫检查点的表达。(4)通过CIBERSORT算法比较预后评分低分组和高分组的免疫细胞浸润。(5)进行基因富集分析以探索预后评分低分组与高分组富集的生物功能。(6)通过单样本基因富集分析计算标志性基因集的归一化富集分数(normalize enrichment score,NES),并对每个标志性基因集的富集分数与预后评分进行Spearman相关性分析。
1.6 统计学方法
数据采用R软件(4.1.2版本)进行分析。两组间比较用Wilcoxon检验,多组间比较用Kruskal-Wallis检验,采用Kaplan-Meier曲线和log-rank检验比较生存率,采用Fisher精确概率法比较不同组之间的临床特征。P<0.05为差异有统计学意义。
2 结果
2.1 不同聚类下的卵巢癌患者具有不同的免疫微环境
富集分析结果显示,TGF-β信号通路富集在Ⅲ/Ⅳ期 (图1A、B)。累积分布函数曲线和曲线下面积的相对变化结果表明,在聚类数量K值为2时累积分布函数的曲线最为稳定(图1C),且曲线下面积的相对变化较小(图1D),此外在K值为2时,一致性矩阵边缘清晰(图1E),因此2为一致性聚类分析的最佳K值。根据上述结果,卵巢癌患者被划分为两组(组1和组2),主成分分析结果进一步表明TGF-β信号通路相关基因的表达可将组1和组2的样本分成2类(图1F)。两组间前50个差异表达的TGF- β信号通路相关基因见图2A。此外,两组卵巢癌患者的肿瘤分期(Ⅰ/Ⅱ和Ⅲ/Ⅳ)、肿瘤残余病(无肉眼病变、1~10 mm、11~20 mm、>20 mm)和亚型(间充质型、增殖型、免疫反应型、分化型)的分布差异有统计学意义(图2A)。Kaplan-Meier曲线结果显示,组1生存率高于组2(图2B)。组1的免疫、基质和估计评分低于组2,但肿瘤纯度评分高于组2(图2C)。CIBERSORT结果显示两组间静息树突状细胞、M1巨噬细胞、M2巨噬细胞、活化肥大细胞、中性粒细胞、活化NK细胞、活化CD4+T细胞、静息记忆CD4+T淋巴细胞、CD8+T细胞,卵泡辅助T细胞的水平差异有统计学意义(图2D)。两组间的免疫相关信号通路,例如炎症应答、IL6-JAK-STAT3信号通路、PI3K-AKT-mTOR信号通路以及细胞行为相关标志,例如EMT、细胞凋亡、有丝分裂纺锤体在两组间的富集程度差异有统计学意义(图2E)。

A为TGF-β信号通路基因集在不同肿瘤分化程度中的GSEA分析结果;B为TGF-β信号标志基因集在不同肿瘤分化程度中的GSEA分析结果;C为聚类数量(K)为2、3、4、5时的累积分布函数曲线;D为聚类数量(K)为2~5时累积分布函数曲线下面积的相对变化;E为聚类数量(K)为2时的一致性矩阵;F为聚类数量(K)为2时的主成分分析散点图,其中绿色圆点为组1,橙色圆点为组2。

A为组1和组2患者的临床特征分布热图及两组差异表达前50的TGF-β相关基因的表达热图;B为K-M曲线比较组1和组2患者的生存差异;C为组1和组2的估计、免疫、基质和肿瘤纯度评分;D为组1和组2中免疫细胞的浸润水平;E为组1和组2间差异富集的信号通路热图;nsP>0.05,*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
2.2 卵巢癌中TGF-β信号通路相关预后基因的鉴定
差异表达和功能富集分析结果显示,两组间的差异表达基因主要富集于细胞外基质相关的生物学过程和通路中,例如细胞外基质-受体互作、细胞外基质构成、PI3K-AKT通路等(图3)。进一步通过单因素Cox回归分析,筛选得到10个与卵巢癌患者预后相关的基因,即GMPR、PIEZO1、EMP1、CXCL13、GADD45B、SORCS2、FOSL2、PODN、LYNX1和SLC38A5(图4A)。Kaplan-Meier生存曲线显示高GMPR和高CXCL13表达组卵巢癌患者的生存率高于低GMPR和低CXCL13表达组,而低PIEZO1/EMP1/GADD45B/SORCS2/FOSL2/PODN/LYNX1/SLC38A5表达组卵巢癌患者的生存率高于高PIEZO1/EMP1/GADD45B/SORCS2/FOSL2/PODN/LYNX1/SLC38A5表达组(图4B)。
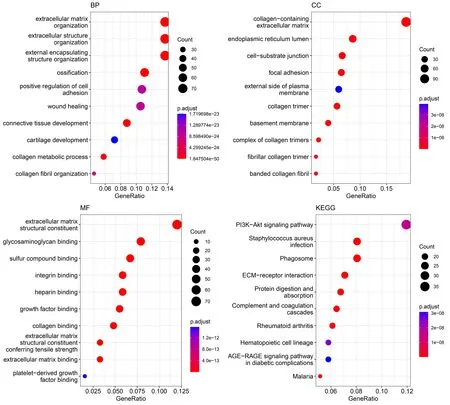
图3 组1和组2差异表达基因的功能富集分析
2.3 预后评分的多因素分析
根据预后基因计算每个卵巢癌患者的预后评分,将卵巢癌患者分为高评分组和低评分组,Kaplan-Meier生存曲线显示训练集和验证集中高评分组患者的生存高于低评分组(图5A、B)。多因素Cox回归分析表明在训练集和验证集中预后评分均是独立预后因素(图5C、D)。为了探讨TGF-β信号通路预后评分影响卵巢癌患者预后的机制,本研究首先分析了预后评分与卵巢癌临床特征之间的关系,结果显示无肉眼可见疾病和无淋巴浸润的患者得分较高(图5E、F)。此外,不同TCGA亚型的患者得分不同,其中增殖亚型得分最高,间充质亚型得分最低(图5G)。

A为Kaplan-Meier曲线分析训练集中高、低预后评分组的生存差异,其中红色曲线为高评分组,蓝色曲线为低评分组;B为Kaplan-Meier曲线分析验证集中高、低预后评分组的生存差异,其中红色曲线为高评分组,蓝色曲线为低评分组;C为训练集中预后评分和临床性状的多因素Cox回归分析;D为验证集中预后评分和临床性状的多因素Cox回归分析;E为不同肿瘤残余病间的预后评分;F为有/无淋巴浸润组间的预后评分;G为不同卵巢癌亚型间的预后评分。
2.4 预后评分与卵巢癌进展和微环境的关系
富集结果显示,免疫相关通路(趋化因子信号通路、PI3L-Akt信号通路、TNF信号通路、Toll样受体信号通路)(图6A)和生物学过程(细胞对趋化因子的反应、白细胞迁移、对趋化素的反应、T细胞迁移)在预后评分低分组中显著富集(图6B)。此外,预后评分低分组和高分组之间的肿瘤免疫环境并不相同,具体表现为低分组的估计、免疫、基质评分较高,肿瘤纯度较低(图6C)。并且7种免疫细胞(活化和静息树突状细胞、静息和活化肥大细胞、中性粒细胞、活化NK细胞、卵泡辅助T细胞)的比率也存在差异(图6D)。在预后评分与肿瘤标志物相关性分析中,预后评分与NF-κB(r=-0.54)、缺氧(r=0.62)、TGF-β信号(r=-0.60)、凋亡(r=-0.54)、肌肉生成(r=-1.54)、心尖连接(r=0.74)、心尖表面(r=-0.64)、EMT(r=0.70)、p53通路(r=-0.53)、紫外线反应下调(r=-0.59)、血管生成(r=0.66)、凝血(r=0.60)、IL2/STAT5信号传导(r=0.54)、KRAS信号传导上调(r=0.65)相关(图6E)。15个免疫检查点(ADORA2A、CD160、CD200R1、CD276、CTLA4、HAVCR2、KIR2DL1、KIR2DL3、KIR3DL1、KIR3DL2、LAIR1、PDCD1、SIRPA、TDO2、TIGIT)的表达在预后评分低分组和高分组间也存在差异(图6F)。

A为KEGG信号通路基因集在高、低评分组中的GSEA分析结果;B为GO-BP基因集在高、低评分组中的GSEA分析结果;C为高、低预后评分组的估计、免疫、基质和肿瘤纯度评分;D为高、低预后评分组免疫细胞的浸润水平;E为预后评分与癌症标志物相关性的热图;F为高、低预后评分组免疫检查点分子表达,其中nsP>0.05,*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
3 讨论
TGF-β信号通路在癌症的发生和发展中扮演着重要角色,但TGF-β信号通路相关基因在卵巢癌中的预后价值尚不清楚。本研究利用TCGA数据库中的卵巢癌患者测序数据,发现同Ⅰ/Ⅱ期患者相比,TGF-β信号通路基因集显著富集到Ⅲ/Ⅳ期患者中,表明TGF-β信号通路相关基因与卵巢癌的进展密切相关。随后,本研究进一步分析了TGF-β信号通路相关基因在卵巢癌中的作用:根据TGF-β信号通路相关基因可以将卵巢癌患者分为两组,这两组患者具有不同的生存期和免疫微环境,表明TGF-β信号通路相关基因在卵巢癌的分子病理中起着重要作用。此外,两组之间的差异表达基因富集到细胞外基质相关的生物功能中,表明TGF-β信号通路相关基因可能通过细胞外基质调节卵巢癌的进展。
通过单变量Cox回归分析,本研究从差异表达基因中选择GMPR、PIEZO1、EMP1、CXCL13、GADD45B、SORCS2、FOSL2、PODN、LYNX1和SLC38A5作为卵巢癌的预后生物标志物。其中,预后基因GMPR和CXCL13是保护因子,PIEZO1、EMP1、GADD45B、SORCS2、FOSL2、PODN、LYNX1和SLC38A5是风险因子。Kaplan-Meier生存曲线结果进一步证实了这一点,即GMPR和CXCL13高表达组患者的生存率高于低表达组,而PIEZO1、EMP1、GADD45B、SORCS2、FOSL2、PODN、LYNX1和SLC38A5高表达组的生存率低于低表达组。GMPR是一种催化GMP脱氨基为IMP并调节细胞内碱基平衡的酶[13]。据报道,GMPR的过表达可促进HL-60白血病细胞的分化[14],并介导MITF基因对黑色素瘤细胞侵袭的抑制作用[15]。PIEZO1编码一种受机械力激活的离子通道。在肝细胞癌中,它通过激活TGF-β信号通路在体外和体内促进EMT[16]。敲低PIEZO1降低了卵巢癌的生长速度,并通过Hippo/YAP信号削弱了肺转移[17]。据报道,EMP1是一种膜蛋白,它通过增加MAPK的表达来调节卵巢癌细胞的侵袭和增殖[18]。CXCL13是肿瘤免疫微环境中的一种重要趋化因子[19],TGF-β可诱导其在免疫细胞中的表达[20]。CXCL13由于在形成免疫激活肿瘤微环境[21]和T细胞治疗[22]方面的功能,在卵巢癌治疗中很有前景。GADD45B调节细胞对TGF-β的应答[23],卵巢癌细胞系中GADD45B的过表达促进了细胞迁移[24]。FOSL2是AP-1转录因子家族的一员,其表达受TGF-β调节,它主要通过与SMAD3互作通过TGF-β信号通路诱导细胞迁移[25]。此外,在卵巢癌中,FOSL2不仅调节细胞凋亡[26],还调节顺铂耐药性[27]。在骨肉瘤细胞中过表达PODN会削弱TGF-β信号通路,进而抑制细胞的增殖、侵袭和迁移[28]。
本研究基于预后基因的表达计算了预后评分,并在2个独立的卵巢癌队列中构建了一个模型,发现该评分与卵巢癌的预后相关,并且通过多因素Cox回归分析发现该预后评分是卵巢癌的独立预后因素,并且该预后评分与卵巢癌的亚型、淋巴浸润、残余病以及标志物密切相关。通过比较预后评分低分组和高分组的特征,发现该预后评分与卵巢癌的进展密切相关,并且可通过多种免疫途径调节卵巢癌。此外,预后评分低分组和高分组的免疫微环境,包括免疫细胞的浸润比率和免疫检查点的表达均存在差异,这表明所选预后基因在卵巢癌肿瘤微环境重塑中的潜在作用。肿瘤微环境显著影响卵巢癌患者的免疫治疗,并最终影响卵巢癌患者的预后。因此,推测上述预后基因可能还通过调控卵巢癌患者对免疫治疗的应答影响卵巢癌患者的预后。
上述结果表明GMPR、PIEZO1、EMP1、CXCL13、GADD45B、SORCS2、FOSL2、PODN、LYNX1和SLC38A5在卵巢癌的发生和发展中具有重要功能,靶向这些预后基因的小分子化合物可能是治疗卵巢癌的候选药物。Liu等[29]通过CMap数据库预测到小分子药物呋喃唑酮和利福平可靶向GMPR。ZY0511能够通过诱导GADD45B基因启动子区H3K4甲基化进而靶向调控GADD45B基因的表达,并抑制肝癌细胞的增殖[30]。Sennoune等[31]发现氯硝柳胺通过阻断SLC38A5介导的大型胞饮作用诱导癌细胞营养匮乏。然而,上述药物能否用于卵巢癌的治疗仍需大量的动物实验和临床试验进行验证。
本研究具有一定的局限性。首先,筛选出的预后基因需要进一步在临床中检验其预测效果;其次,它们是否能够作为卵巢癌治疗的靶点仍需长期的动物实验和临床试验;更重要的是,需要进行体内和体外实验阐明每个预后基因调控卵巢癌免疫微环境的具体分子机制以及在卵巢癌中它们是如何与TGF-β信号通路串扰发挥作用的。
4 结论
本研究在卵巢癌中鉴定了新的TGF-β信号通路相关预后基因,构建了一个与卵巢癌预后相关的新的TGF-β信号通路相关评分,并探讨了TGF-β信号调控卵巢癌的潜在机制,这些发现可能为卵巢癌患者的治疗提供有价值的信息。

