NLRP3、IL-1β与视神经脊髓炎谱系障碍严重程度的相关性
李东瑞,王瑞,崔璨,荆婧,何霞
(郑州大学第一附属医院 神经内科,河南 郑州 450052)
视神经脊髓炎谱系障碍(neuromyelitis optica spectrum disorder,NMOSD)是中枢神经系统(central nervous system,CNS)的自身免疫性炎症性脱髓鞘疾病。NMOSD主要累及部位为视神经和脊髓[1-3],其病变多数可累及脑干和大脑,表现为相应炎症,如视神经炎和脊髓炎及某些脑、脑干综合征,且可多次复发。NMOSD大多是由针对水通道蛋白4(aquaporin-4,AQP-4)的IgG抗体引起,随后发现它是一种AQP-4特异性抗体,存在于中枢神经系统星形胶质细胞足突表面[4]。AQP-4是双向渗透的水通道,阴离子和甘油均不能透过,其大多分布在星形胶质细胞的终足上[5],少部分存在于室管膜细胞膜上,而其余如少突胶质细胞、神经元或脉络膜上皮细胞等并不表达AQP-4蛋白[6]。
在神经系统中,神经元细胞、小胶质细胞、少突胶质细胞、星形胶质细胞和施旺细胞均可以感知周围环境的变化而发挥免疫作用。核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protion 3,NLRP3)炎症小体是CNS中最丰富的一种炎症小体,是多数神经系统疾病神经炎症产生的关键因素之一,也是研究最为广泛的炎症小体[7]。在神经系统中,神经元、少突胶质细胞、小胶质细胞、星形胶质细胞和施旺细胞均可以感知周围环境的变化而发挥免疫作用,CNS中各种炎症小体的表达具有特异性:小胶质细胞主要表达NLRP3、NLRP1和NLRC4[8-9],在大鼠的抑郁模型中,小胶质细胞是NLRP3表达上调后产生白介素-1β(interleukin 1β,IL-1β)的主要细胞[9]。
通过检测NMOSD患者及非炎症性神经系统疾病(noninflammatory neurological disorders,NND)患者脑脊液中NLRP3、IL-1β水平,分析NMOSD组患者脑脊液中NLRP3、IL-1β水平与疾病严重程度的相关性,探寻诊断NMOSD及评估该疾病严重程度的新的潜在生物标志物。
1 资料与方法
1.1 一般资料
收集郑州大学第一附属医院2021年10月至2022年10月AQP-4阳性的NMOSD患者35例,以20名年龄、性别相匹配的NND患者作为对照组。本项目参考临床数据与样本资源库标准操作规程和国际生物和环境知识库学会最佳实践,制定样本收集、储存的标准化操作规范,通过伦理审查(2019-KY-123)。
1.2 纳入与排除标准
1.2.1纳入标准
(1)NMOSD组:①符合NMOSD诊断标准[3],AQP-4为阳性;②>18岁;③处于首次发作。(2)对照组:①同期以头痛为主诉入院的患者,可伴有恶心、全身无力等;②入院后神经系统查体、影像学资料及脑脊液检测指标等均无异常。
1.2.2排除标准
拒绝参与研究;有神经系统肿瘤、脑外伤、脑脓肿、血管疾病、感染者;无法排除其他原因的神经系统疾病。
1.3 数据收集和分组
研究数据主要包括患者年龄、性别等指标。并有2名神经科医生采用扩展致残量表评分(expanded disability status scale,EDSS)[10]对NMOSD组患者入院时疾病严重程度进行评估。
1.4 NLRP3、IL-1β测定
标本取样时间为发病7 d内及任何免疫抑制治疗前,所有合格样本均保存于-80 ℃冰箱内,最后统一从样本库出库。利用酶联免疫吸附试验试剂盒(CSB-E15885h武汉、中国)测定NLRP3水平,利用酶联免疫吸附试验试剂盒(Bender MedSystems GmbH,维也纳,奥地利)测定IL-1β水平。
1.5 统计分析

2 结果
2.1 临床资料
30名NMOSD患者中,NMOSD组患者入院时EDSS评分为(4.41±1.90)分。两组临床资料比较见表1。

表1 各组间一般临床资料及脑脊液比较
2.2 NMOSD主要临床表现及影像学特征
NMSOD组主要临床表现为视力下降、运动障碍、感觉障碍、恶心呕吐、头晕共济失调及大小便障碍,其中视力下降占比42.86%,运动障碍占比45.71%,感觉障碍占比51.42%。NMOSD组患者入院后均于我院行头颅及全脊髓MRI检查,结果显示:共有23名患者有脊髓病变,占65.71%;5名患者视神经病变,占14.29%;8名患者脑干病变,占22.86%;9名患者存在颅内多发病变,占25.71%。
2.3 两组脑脊液NLRP3、IL-1β水平
两组脑脊液中均检测到NLRP3,NMOSD组、对照组水平分别为(1 127.96±394.61)、(679.53±176.81)ng·L-1,NMOSD组脑脊液NLRP3水平高于对照组(t=4.864,P<0.001)。NMOSD组和对照组患者脑脊液中均可以检测到IL-1β,水平依次为(1.42±0.45)、(0.51±0.39)ng·L-1,NMOSD组脑脊液IL-1β水平高于对照组(t=7.772,P<0.001)。
2.4 NMOSD组NLRP3、IL-1β水平与EDSS评分的相关性分析
NMOSD组脑脊液NLRP3水平与EDSS评分呈正相关(r=0.360,P=0.033),IL-1β水平与EDSS评分呈正相关(r=0.359,P=0.034)。见图1。
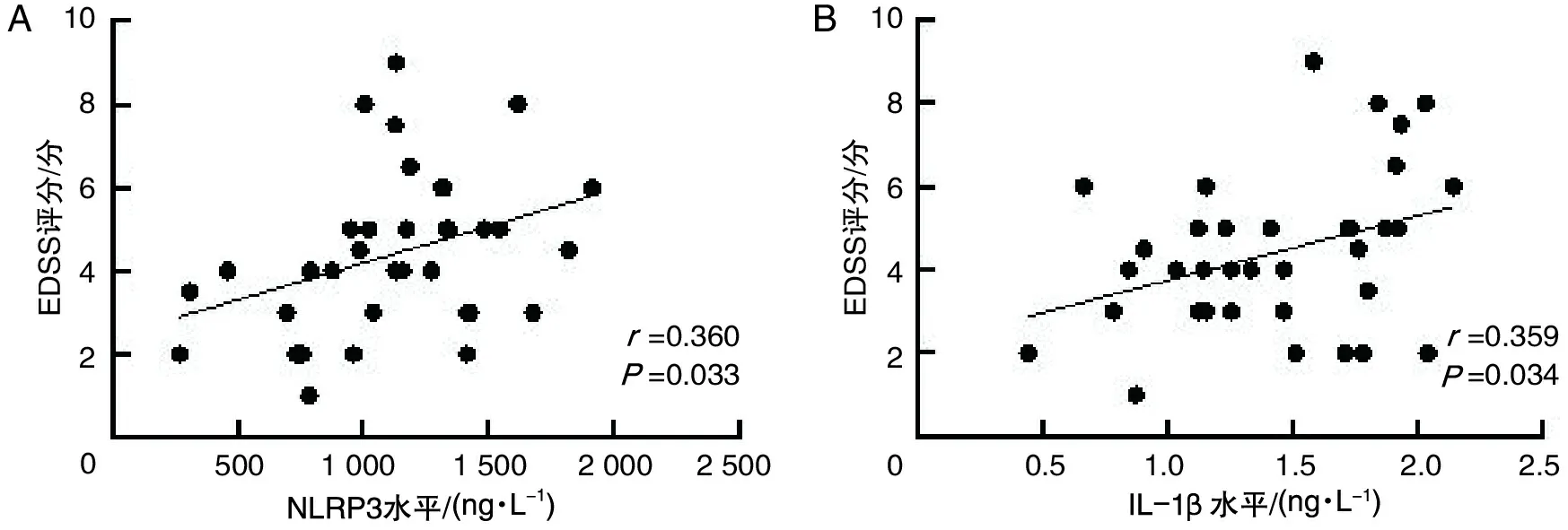
NMOSD为视神经脊髓炎谱系障碍;EDSS为扩展残疾状态量表;NLRP3为核苷酸结合寡聚化结构域样受体蛋白3;IL-1β为白介素-1β;A为NMOSD组脑脊液NLRP3水平与EDSS评分的相关性分析;B为NMOSD组脑脊液IL-1β水平与EDSS评分的相关性分析。
3 讨论
神经免疫炎症反应是多种神经系统疾病产生的重要病因,包括脑血管病、神经系统感染性疾病、神经系统退行性疾病和神经系统自身免疫性疾病等。神经炎症在本质上是固有免疫反应,在正常情况下神经系统可通过此反应对入侵的病原体及宿主的受损细胞作出应答,清除病原体及相关受损细胞,从而促进组织的损伤修复[11]。在病理状态下,免疫炎症受到刺激而过度激活,会引起促炎细胞因子的产生,进一步引起组织损伤,从而导致严重的神经功能障碍[12]。目前,神经系统自身免疫性疾病是由靶向神经元表位的自身抗体引起,多于年轻人群中起病,发病率高且个体之间具有异质性[13],NMOSD和MS便是其中较为常见的两种自身免疫性脱髓鞘疾病。
NMOSD是一种严重的CNS炎症性疾病,其发病大多数是由AQP4-IgG引起。研究发现,AQP-4-IgG阳性的患者中枢神经系统病变特征为血管周围出现大量IgG、IgM和补体的沉积物以及炎症细胞的浸润,包括小胶质细胞、嗜中性粒细胞、嗜酸性粒细胞、B细胞和T细胞[14]。本研究共纳入35例NMOSD患者,所有患者脑脊液或血清AQP-4抗体均为阳性,发病年龄为(45.40±13.42)岁,男女比例为10∶25,男性占比低于对照组。在纳入的患者中,多数以视力下降、感觉及运动障碍为首发症状,少部分出现头晕、共济失调及大小便障碍,病灶多集中于脊髓,可少部分累及脑干及颅内,与既往研究[15]相符合。尽管AQP-4-IgG在NMOSD的发病中起核心作用,但炎症细胞因子也在NMOSD的发生发展中起到十分重要的作用。
炎症小体在颅内存在于神经细胞、小胶质细胞和星形胶质疾病,是一组蛋白复合体。目前较为熟悉的炎症小体有NLRP1、NLRP3和NLRC4,其中NLRP3因其形成和激活特点成为目前研究的重点。目前尚不清楚NLRP3炎症小体如何在鞘内被激活,已知各种外源和内源信号可以通过TLR-4信号通路上调NLRP3基因的转录和翻译[16]。K+流出、Ca2+信号、活性氧、线粒体功能障碍都可以激活NLRP3炎性体[17]。mtDNA由受损的线粒体释放,mtDNA 的细胞外(无细胞)水平反映了线粒体功能障碍的程度。mtDNA已被证明可作为激活人类先天免疫系统的损伤相关分子模式,包括 NLRP3炎症小体[18-19]。有研究表明,NMOSD和MS患者的CSF中无细胞mtDNA水平升高[20-22],这也表明神经炎症的复杂性。NLRP3炎症小体的激活可以催化半胱天冬酶原-1并裂解为半胱天冬酶-1,从而促进原IL-1β和原IL-18转化为活性IL-1β和IL-18,从而加重炎症反应[23-24]。在多发性硬化的动物模型中,观察到IL-1β和IL-18可上调CD4+T细胞的相关趋化因子的受体表达,从而促进Th1和Th17细胞迁移中枢神经系统[25]。Malhotra等[26]在原发-进展型多发性硬化患者脑组织的髓系细胞上检测到NLRP3和IL-1β的表达,和外周单个核细胞中NLRP3和IL-1β的mRNA表达上调相一致。
NLRP3通过激活半胱氨酸蛋白酶-1(Caspase-1)对病原体相关分子模式和损伤相关分子模式做出反应。这反过来又激活促炎因子,如IL-1β和IL-18[27]。IL-1β可诱导辅助性T细胞到中枢神经系统,在那里释放IL-6和IL-17并引发炎症级联反应,导致NMOSD中枢神经系统病变[28]。细胞焦亡(pyroptosis)是一种对免疫至关重要的细胞死亡方式,而焦亡的关键效应物GSDMD(gasdermin D)被Caspase-1激活[29-30],目前仍需要在细胞焦亡方面做进一步的研究。同时已有研究指出在NMOSD的患者脑脊液中的NLRP3和IL-1β、IL-6、IL-17水平高于对照组[31],本项研究与其基本相符。
本研究也有一定的局限性。首先,本研究只是在入院时进行了一次基线检测,未进一步探索NLRP3及IL-1β在该疾病整个过程中的变化规律,同时未进一步追踪患者预后情况。另外,本研究检验的指标相对单一,未与其他炎症小体及相关细胞因子进行相互验证和对比分析。这项研究是一项单一中心临床观察研究,样本量小,偏倚是不可避免的,未来需要多中心、大样本检测。
4 结论
NMOSD是一种涉及星形胶质细胞损伤和炎症因子的自身免疫性疾病。NLRP3、IL-1β可能在炎症过程及发病机制中发挥重要作用。本研究提供了有关NLRP3、IL-1β在NMOSD中的作用的重要证据。NLRP3、IL-1β可作为NMOSD患者严重程度的生物标志物和治疗NMOSD的潜在靶点。

