基于Aβ 学说的抗阿尔茨海默病药物研究进展
劳可静,陈嘉乐,黄梦宇,孙 娅,苟兴春,郭 娜*,刘振彬
(1. 西安医学院 陕西省脑疾病防治重点实验室,陕西 西安 710021;2. 西安医学院 基础与转化医学研究所,陕西 西安 710021;3. 陕西科技大学 食品与生物工程学院,陕西 西安 710021)
阿尔茨海默病(Alzheimer’s disease,AD)是 一种进行性的神经退行性疾病,临床表现主要有记忆、智力减退以及认知障碍,且随着病程的发展最终会导致死亡[1]。 目前全球AD 患者数量众多,阿尔茨海默病已被认为是影响人类尤其是65 岁以上人群健康的关键因素之一[2]。 截至2018 年,全世界共有约5 000 万痴呆患者,到2050 年这一数量预计将突破1.5 亿[1]。
目前临床上使用的抗AD 药物仅有2 类。 一类为增强胆碱能系统功能的胆碱酯酶抑制剂,包括它克林、多奈哌齐、卡巴拉汀、利凡思的明、加兰他敏,见图1。 它克林是第一个上市的抗AD 药物,然而上市后不久就因为肝毒性下架。 另一类是减弱谷氨酸兴奋毒性的N-甲基-D-天门冬氨酸(NMDA)受体拮抗剂,如美金刚。 然而这些药物只能暂时缓解患者的症状,并不能阻止或延缓病情的恶化。

图1 目前临床上使用的抗AD 药物Fig. 1 Anti-AD drugs currently in clinical use
AD 患者大脑中的主要病理学变化包括由淀粉样蛋白(amyloid β-protein,Aβ)聚集形成的淀粉样沉积(senile plaques,SPs)、由过度磷酸化的Tau 蛋白聚集形成的神经纤维缠结 (neuro fibrillary tangles,NFTs)和神经元丢失。 此外,基因突变、小胶质细胞激活以及自由基损伤等多种因素均可诱发AD。目前关于AD 发病机制的假说主要有:Aβ 淀粉样蛋白级联假说、Tau 蛋白假说以及血管源性假说[3]。
尽管AD 发病机制错综复杂,“Aβ 学说”占据主流地位。 “Aβ 学说”认为Aβ 是AD 病程发展的驱动因素,指出Aβ 产生和清除平衡的失调导致了AD的发生。 Aβ 是一种由39~43 个氨基酸形成的多肽,由一种集中在神经元的突触部位膜内在蛋白淀粉样前体蛋白(amyloid precursor protein,APP)水解形成。 APP 是一种集中在神经元突触的膜内蛋白质,其主要降解途径包括淀粉样途径和非淀粉样途径[4]。其中,非淀粉样蛋白途径 (non-amyloidogenic pathway)不产生完整的Aβ,是APP 代谢的主要途径[5]。此途径中APP 经α-分泌酶水解生成可溶性的APP-α (soluble ectodomain of APP-α,sAPPα) 和C端片段α(C-terminal fragment-α,CTF-α)。 淀粉样蛋白途径(amyloidogenic pathway)则是APP 代谢的次要途径,产物为具有毒性的Aβ[6]。 其中,APP 先由β-分泌酶剪切生成可溶性的APP-β(soluble ectodomain of APP-β) 和C 端片段β (C-terminal fragment-β,CTF-β)。 之后,CTF-β 经过γ 分泌酶切割生成不同长度的Aβ 片段。 此途径生成的Aβ 主要有Aβ40 和Aβ42,分别由40 和42 个氨基酸构成,共存于SPs 中。 与Aβ40 相比,Aβ42 的自聚能力更强,更易发生淀粉样聚集[7],最终形成二聚体、寡聚体、纤维和斑块等聚集程度不同的产物,且依赖分子间的疏水作用和静电作用形成的二聚体是寡聚化的关键起点[8]。 研究表明,相比于纤维和斑块形式,寡聚体Aβ 的神经毒性最大,其可导致线粒体钙超载、线粒体膜去极化等线粒体功能障碍。
大量研究表明,Aβ 寡聚体在体内和体外都可以对神经细胞产生毒性作用。Aβ 寡聚体可产生神经毒性作用,并会抑制兴奋性神经递质释放,导致突触障碍,进而导致脑内神经元Tau 蛋白过度磷酸化[9-10]。脑内Aβ 积聚可导致氧自由基代谢紊乱,加剧Aβ 累积,造成脑组织不可逆的损伤[11]。另一方面,Aβ 寡聚体可以激活中枢神经系统中主要的免疫细胞小胶质细胞和星型胶质细胞,活化后可释放多种促炎症细胞因子,引起炎症反应,促进异常氧化应激反应,使神经细胞变性、坏死[12]。
AD 患者的病程发展状况与Aβ 的积累程度密切相关,在AD 患者出现认知障碍前数十年,Aβ 就已开始积累[13],因此Aβ 是AD 治疗的重要靶点。 作者从减少Aβ 产生、增加Aβ 清除、抑制Aβ 与神经元结合和抑制Aβ 聚集4 个方面简要综述目前进入临床的基于Aβ 学说开发的抗AD 药物研究进展,见图2。
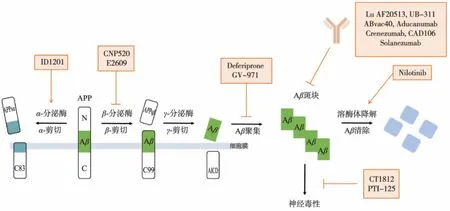
图2 Aβ 代谢通路及基于Aβ 学说的主要药物靶点Fig. 2 Aβ Metabolic pathway and major drug targets based on Aβ theory
1 减少Aβ 产生
1.1 抑制β-分泌酶的产生
β-位点APP 水解酶-1 (β-site APP-cleaving enzyme,BACE-1) 是催化APP 水解生成Aβ 的第一个关键步骤[14],因此抑制BACE-1 是治疗AD 的重要途径之一(见表1)。

表1 基于减少Aβ 产生策略开发的抗AD 药物Table 1 Anti-AD drugs based on reducing Aβ generation strategy
CNP520(见图3)是一种BACE-1 抑制剂,能够减少积聚的Aβ 产生[15],可降低大鼠和狗的脑和脑脊液Aβ,以及APP 转基因小鼠的Aβ 斑块沉积。CNP520 具有良好的血脑屏障通透性,外周副作用少,没有出现相关的视网膜退化、肝毒性或心血管毒性[16]。 CNP520 与血浆蛋白结合率较高,所以血浆中游离的药物浓度较低。 CNP520 能以剂量依赖的方式抑制Aβ 的非淀粉样蛋白途径,降低可溶性APP-β,增加可溶性APP-α。 CNP520 用药后脑脊液中的Aβ 浓度显著降低,且具有剂量依赖性[17],但在临床试验中发现该药可加速认知功能某些指标恶化,该药物的临床研究已终止。
E2609(见图3)是双环氨基二氢噻嗪取代的化合物,该药对BACE1 具有良好的选择性和强大的BACE1 抑制活性,可以显著降低大鼠脑脊液和血浆中Aβ 含量水平[18]。 E2609 血浆半衰期为12~16 h,在多次口服递增剂量研究中,最大安全剂量可达400 mg,此剂量可使患者脑脊液Aβ 水平下降85%。此外,脑脊液中可溶性APPβ 浓度降低,而可溶性APPα 浓度升高[19]。 在临床试验中,E2609 的实验对象表现出良好的耐受性,然而2020 年9 月,日本卫材和美国Biogen 公司共同宣布因结果的风险收益比不佳终止其Ⅲ期临床试验。
1.2 促进α-分泌酶的生成
在非淀粉样蛋白形成途径中,APP 经α-分泌酶切割,生成具有神经保护功能的sAPPα。 因此,提高α-分泌酶可促进APP 非淀粉样途径的水解,从而减少Aβ 的生成[20]。
ID1201(见图3)为川楝子果实乙醇提取物中的活性成分,通过PI3K/Akt 信号通路激活α-分泌酶,升高可溶性APP,降低APPβ 和Aβ 水平。在FAD 小鼠中可降低可溶性Aβ 和淀粉样斑块水平[19,21-22]。 在动物试验中,ID1201 可显著提高FAD 小鼠在水迷宫中的位置和空间能力[23]。 ID1201 目前正在进行Ⅲ期临床试验。
1.3 抑制APP 表达
研究发现在家族性阿尔茨海默病和唐氏综合征患者中,APP 基因高表达[24]。 Posiphen(图3)是APP 的5′-非翻译区 (5′-Untranslated Region,5′-UTR)定向翻译阻滞剂,可通过抑制APP 的合成来降低APP 水平,从而减少Aβ 生成的可能性[25-26]。 该药物在脑中的浓度高于其在血浆中的浓度,其主要代谢产物 (+)-N1,N8-bisnorPosiphen 和 (+)-N1-norPosiphen 以及(-)-phenserine 对乙酰胆碱酯酶有抑制作用,对胆碱能神经功能低下造成的AD 症状也有一定缓解作用[27]。
2 增加Aβ 清除
2.1 免疫疗法
免疫疗法可分为主动免疫疗法和被动免疫疗法[28]。 主动免疫是患者接种Aβ 疫苗,体内产生Aβ抗体,进而清除脑内沉积的Aβ 斑块。 在2000 年,Chenk 等首次使用Aβ42 和佐剂QS-21 制成的疫苗AN1792,尽管试验因发生严重不良反应(无菌性脑膜炎)而终止[29],但由于AN1792 减少了患者脑内Aβ 沉积,人们对开发出安全有效的Aβ 疫苗仍抱有希望。
Lu AF20513 由来自破伤风常规疫苗(TT)的2个外来T 细胞表位(P2、P30)与Aβ42 的3 个B 细胞表位连接而成。在AD 小鼠模型中,LuAF20513 可诱导强烈的T 细胞反应并产生Aβ 抗体,从而减少了Tg2576 小鼠大脑中可溶性与不可溶性的β 的积累,且不会诱导小胶质细胞活化、星形胶质细胞增多或引发脑淀粉样血管病。在轻度AD 患者中,特别是在老年人体内存在记忆性T 辅助细胞的情况下,可以很好诱导有效的抗Aβ 抗体应答,预防自身病理反应性T 细胞反应[27]。
UB-311 由2 个合成的Aβ1-14 靶向肽构成。在转基因小鼠hAPP751 中可诱导产生大量位点特异性Aβ1-10 抗体,从而降低Aβ42 寡聚体、原纤维和斑块负荷的水平。 在AD 患者中,UB-311 可能改善早期阿尔茨海默病患者的认知。 患者注射UB-311后的应答率为100%,患者注射后最常见的不良反应是焦虑、谷丙转氨酶升高和注射部位出现轻微肿胀,基于其良好的安全性和有效性,UB-311 进入了Ⅱ期试验[30](见表2)。
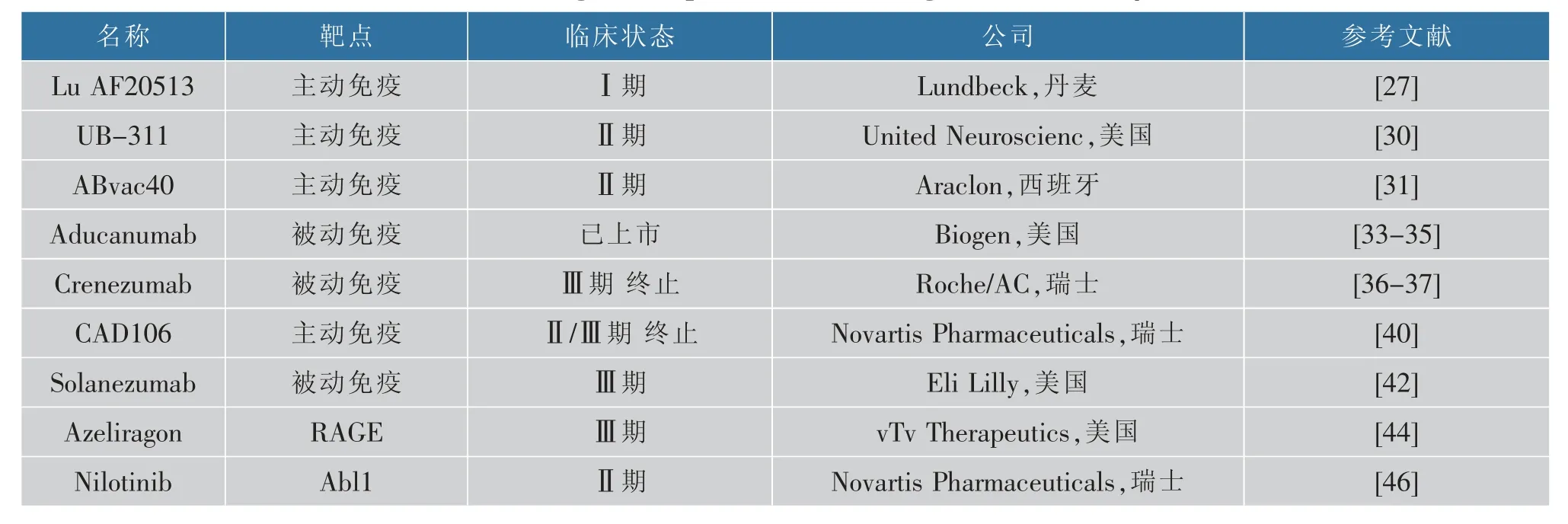
表2 基于增加Aβ 清除策略开发的抗AD 药物Table 2 Anti-AD drugs developed based on strategies to increase Aβ clearance
ABvac40 是一种针对Aβ40 多肽C 末端的活疫苗。 与市面上针对Aβ 的N 末端的定向抗体不同,ABvac40 不结合APP,防止潜在毒性抗原抗体复合物在神经元和其他表达APP 的细胞周围积聚。 I 期临床研究结果表明,ABvac40 可以引发一致而特异性的免疫反应,接受3 剂ABvac40 注射的12 名患者中有11 名产生了特异性抗Aβ40 抗体,减少了脑内Aβ 的产生,同时患者均未检出事件性血管源性水肿、脑腔积液或微出血。 该疫苗表现出了良好的安全性和耐受性,其Ⅱ期临床试验仍在进行中[31]。
与主动免疫疗法不同,被动免疫是以Aβ 为靶点,通过向体内注射Aβ 抗体,识别Aβ 的不同抗原表位来清除脑内沉积的Aβ。 相比于主动免疫,被动免疫虽需反复注射抗体,但在发生严重不良反应时可以及时停止。 因此,被动免疫具有更强的可控性和安全性[32]。
Aducanumab(BIIB037)是一种选择性靶向Aβ的人源单克隆抗体,特异性识别纤维化Aβ 和Aβ 寡聚体[33]。 在1 项为期1 年的双盲、安慰剂对照的Ib期随机试验中,Aducanumab 可以剂量和时间依赖的方式降低脑内Aβ,能部分清除轻度患者的斑块并减缓阿尔兹海默病患者的恶化速度,保护其认知能力[34-35]。 在近年来的2 项Ⅲ期试验的初步数据显示,Aducanumab 没有达到主要终点,但在进一步分析后,Ⅲ期试验EMERGE 结果显示,高剂量可以减少早期AD 患者的认知和功能衰退。 尽管临床试验结果具有颇多争议,上市过程遇到重重阻碍,Aducanumab 在2021 年获得FDA 批准,成为20 年来首个治疗AD 的新药物。
Crenezumab 是一种人源化抗Aβ 的IgG4 单克隆抗体,靶向Aβ16-24 区域[36]。 在体外,Crenezumab可与Aβ 单体和寡聚体结合,保护神经元免受寡聚体诱导的毒性作用。小鼠体内研究表明,Crenezumab在体内选择性结合至含有高浓度的有助于神经元和突触功能障碍的可溶性寡聚Aβ 斑块的核心周围的外围区域[37]。然而在Ⅱ期试验中,未能有效降低淀粉样蛋白负荷,随后进行的Ⅲ期临床试验在2019年被宣告终止[38]。
CAD106 将小Aβ 肽片段Aβ1-6 与包含180 个拷贝的噬菌体Qβ 外壳蛋白的载体偶联,能够诱导免疫反应产生针对Aβ 的特异性抗体,避免Aβ 特异性T 细胞反应。 在小鼠中可诱导产生了特异性抗体,并减少脑内Aβ 含量[39]。 I 期临床研究队列1 中24 例接受CAD106 治疗的患者中有16 例 (67%),队列2 接受治疗的22 例中18 例(82%)出现了符合预先规定的应答阈值的Aβ 抗体应答,且没有出现被认为与研究药物有关的严重不良事件,表明CAD106 在阿尔茨海默病患者中具有较好的安全性和耐受性,但仍需要更大规模的试验和额外的剂量调查来确认其安全性和有效性[40]。 2020 年6 月,其Ⅱ/Ⅲ期临床研究被宣告终止。
Solanezumab 是一种人源单克隆抗体,靶向中央的Aβ13-28 区。 在小鼠中可减少大脑中Aβ 斑块沉积,并且与血浆Aβ 积累密切相关。 Ⅱ期研究显示,使用Solanezumab 治疗12 周后,血浆总Aβ40(淀粉样斑块Aβ 的次要形式)和Aβ42(淀粉样斑块Aβ 的主要形式) 的浓度增加,且在脑脊液CSF 中游离Aβ42 呈剂量依赖性增加,游离Aβ40 呈剂量依赖性降低,原因尚不清楚。 在为期12 周的Ⅱ期临床试验和随后1 年的随访中,Solanezumab 在轻度至中度AD 患者中是安全和可耐受的[41]。在1 项Ⅲ期临床试验,轻度AD 的受试者在为期18 个月的试验中每4周接受400 mg 的Solanezumab 或安慰剂静脉输注,治疗组与安慰剂组之间并未出现认知能力的差异。正在进行的其他Ⅲ期临床试验的结果将有助于确定该药物的临床意义[42]。
2.2 RAGE 拮抗剂
晚期糖基化终产物受体 (receptor of advanced glycation endproducts,RAGE) 属于免疫球蛋白超家族,在中枢和外周多种细胞中均有表达。RAGE 可通过内吞和跨膜作用介导血浆中Aβ 寡聚体进入中枢,并可促进氧化应激和炎症相关基因活化,最终导致多种慢性炎症发生,加速AD 的病理进程[43]。 因此,抑制RAGE 可以促进脑内Aβ 转运及清除。
Azeliragon(TTP488,见图4)是可口服的小分子RAGE 抑制剂,对RAGE 具有高度亲和力和特异性,可能有助于AD 的治疗。 临床研究表明,Azeliragon 可减少AD 小鼠Aβ 斑块的沉积,降低脑内Aβ 浓度,增加血浆Aβ 水平,并降低sAPPβ,增加sAPPα,同时降低炎性细胞因子水平并减缓认知能力下降。 在一项随机、双盲、安慰剂对照的IIb 期试验中,5 mg 给药对AD 患者认知有一定的改善并显示了良好的安全性[44]。 然而Ⅲ期临床试验的结果发现Azeliragon 对患有Ⅱ型糖尿病的AD 病人有一定益处,但与安慰剂相比,给药对AD 的认知并没有改善,因此试验终止。
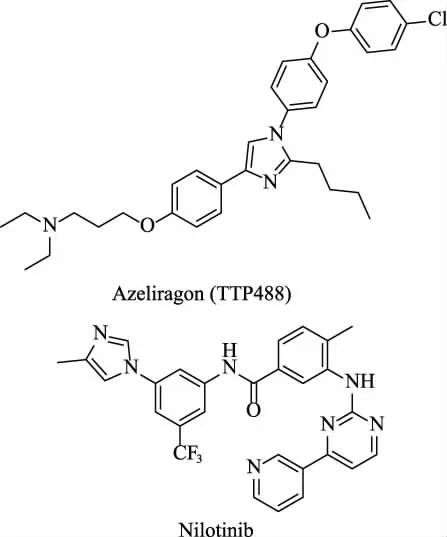
图4 基于增加Aβ 清除策略开发的小分子抗AD 药物结构Fig. 4 Structure of a small molecule anti -AD drug developed based on the strategy of increasing Aβ clearance
2.3 促进Aβ 自噬
小胶质细胞对细胞外Aβ 的吞噬和降解是脑内清除Aβ 的重要方式之一,Aβ 的降解主要发生在溶酶体中。 细胞自噬是细胞通过膜泡包裹细胞器或蛋白质,与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程,是细胞维持其自身稳态以及完成各种生理活动的一项重要的代谢过程。 增加小胶质细胞对Aβ 的吞噬,能够进一步促进Aβ 的降解和清除,减少脑内Aβ 沉积。
Abl 酪氨酸激酶与神经退行性疾病有密切关系。 Abl 在AD 病人脑内高表达,抑制Abl 酪氨酸激酶可恢复parkin 活性并促进beclin-1 自噬通路清除Aβ[45]。 Nilotinib 为第二代酪氨酸激酶抑制剂,具有良好的血脑屏障穿透性。Nilotinib(见图4)能抑制痴呆且表现出良好的安全性[46]。 在一项随机、双盲、安慰剂对照的为期26 周的Ⅱ期试验中,对轻度至中度痴呆的患者分别每天使用150 mg 和300 mg Nilotinib,与安慰剂组相比,Nilotinib 降低了脑脊液中Aβ42、Aβ40 和p-tau 的浓度,Nilotinib 安全、耐受性良好,但300 mg 给药组在给药期间情绪波动较大,而150 mg 组则基本没有这种情况。 还需更大规模,更长时间的Ⅲ期临床试验来进一步评估Nilotinib 的安全性和有效性[47]。
3 抑制Aβ 与神经元结合
Aβ 引发神经元损伤的具体分子机制目前尚有争议,主要可能通过与细胞膜上的Aβ 受体结合进而引起下游信号通路改变,直接损伤神经元或增加神经元的易感性。因此,抑制Aβ 与神经元结合已经成为基于Aβ 学说开发药物的新策略[48](见表3)。
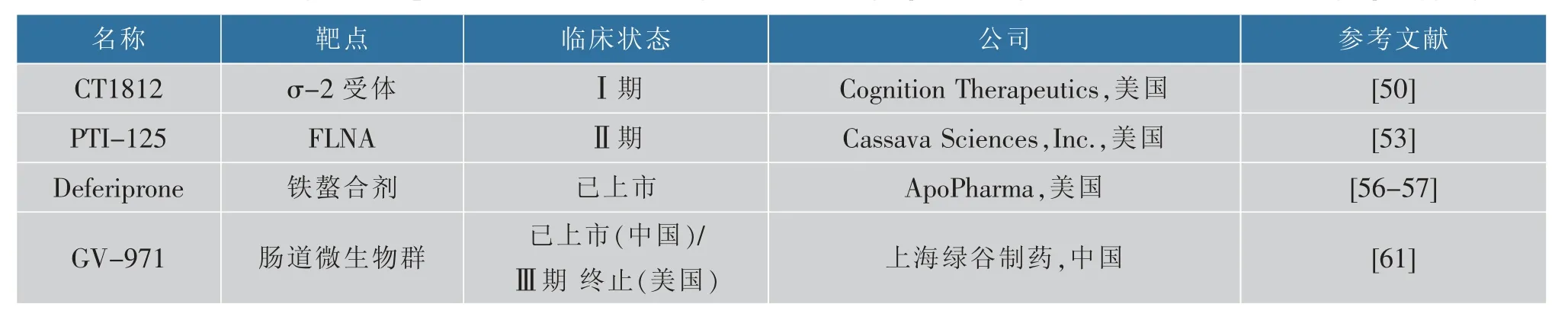
表3 基于抑制Aβ 与神经元结合及抑制Aβ 聚集策略开发的抗AD 药物Table 3 Anti-AD drugs developed based on the strategy of inhibiting Aβ binding to neurons and inhibiting Aβ aggregation
神经系统中的σ 受体与学习、 记忆等行为有关,其中σ-2 受体亚型参与细胞增殖,并在几种癌症中过度表达,是癌症及中枢神经系统疾病诊断和治疗的潜在靶点。 σ-2 受体与孕激素受体膜组分1(progesterone receptor membrane component 1,PGRM1) 结合位点构成的σ-2 /PGRMC1 受体复合物能够介导Aβ 寡聚体与神经元结合[49]。 而其小分子配体类似物CT1812(见图5)能够竞争性地抑制该过程,减轻下游突触毒性,并恢复老年AD 转基因小鼠模型的认知功能[50]。 该药物会导致轻至中度不良反应,包括头痛和胃肠道不适症状,目前正在AD患者中进行Ⅱ期临床试验研究。
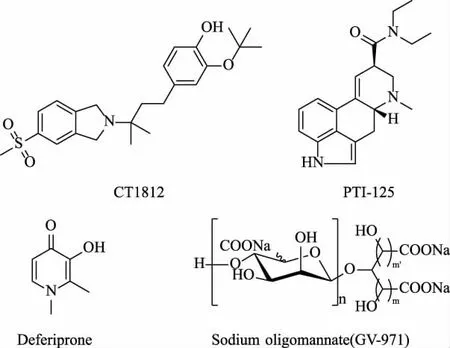
图5 基于抑制Aβ 与神经元结合和抑制Aβ 聚集策略开发的小分子抗AD 药物结构Fig. 5 Structure of a small molecule anti-AD drug developed based on the strategy of inhibiting the binding of Aβ to neurons and inhibiting Aβ aggregation
Aβ42 会触发支架蛋白丝蛋白A(FLNA)的构象变化,改变后的FLNA 和Toll 样受体4(TLR4)结合使该受体持续激活和炎症细胞因子释放,改变的FLNA 还与α7-烟碱型乙酰胆碱受体(α7nAChR)结合引起tau 过度磷酸化[51]。小分子药物PTI-125(见图5)优先结合改变的FLNA 并恢复其天然构象,恢复受体和突触活动,减少其α7nAChR/TLR4 关联和下游病理发展,从而减少tau 蛋白的过度磷酸化、Aβ42沉积、神经原纤维缠结和神经炎症[52]。 小鼠口服PTI-125 可以减少受体功能障碍,改善其筑巢行为、空间认知和工作记忆能力[51]。 试验结果发现PTI-125 可有效逆转AD 和神经炎症的所有生物标志物变化[53]。
4 抑制Aβ 聚集
过渡金属离子如铁和铜的稳态失衡与AD 发展有密切联系。 在AD 病人大脑中金属离子浓度显著升高,进而引起活性氧的增加和Aβ 聚集加速[54]。Deferiprone 是铁螯合剂,具有抗氧化、解离Aβ 聚集体和抑制乙酰胆碱酯酶的能力,并有斑块靶向性和穿透血脑屏障的特征[55]。 有研究发现Deferiprone可降低兔体内Aβ40、Aβ42 和BACE-1 的水平,并且能够降低高胆固醇饮食引起的tau 磷酸化增加[56]。其作用机制可能与降低血浆铁和胆固醇水平有关。Deferiprone 还可抑制Aβ 诱导的星形胶质细胞的铁积累[57]。
肠道菌群的组成变化可导致苯丙氨酸和异亮氨酸的外周积聚,在患者和AD 小鼠模型中观察到苯丙氨酸和异亮氨酸浓度升高,从而刺激血液中促炎性T 辅助细胞1(Th1)数量增加。Th1 在大脑中可促进M1 小胶质细胞激活,导致神经炎症[58]。 由中国海洋大学、中国科学院上海药物研究所和上海绿谷制药有限公司共同研发的GV-971(图5)是一种源于海洋褐藻的口服酸性线性低聚糖混合物,能够重塑肠道微生物群,抑制苯丙氨酸、异亮氨酸积累,并进一步控制神经炎症,逆转AD 相关的认知障碍[59]。在前期动物试验中发现口服GV-971 的小鼠大脑中Aβ 斑块聚集和tau 磷酸化减少,Th1 细胞、 小胶质细胞活化水平下降。 轻度至中度阿尔茨海默病患者中的GV-971Ⅲ期临床试验结果表明接受GV-971的患者认知功能较安慰剂组显著改善[60]。 该药于2019 年11 月2 日在中国首次被批准用于治疗轻、中度AD;于2020 年初在美国、欧洲和亚洲进行Ⅲ期临床试验。 但由于疫情,绿谷药业于2022 年宣布提前终止国际多中心Ⅲ期临床研究。
5 展 望
AD 的复杂性不但导致其具体发病机制不明确,还造成动物模型的建立受阻,阻碍了药物开发。在前30 年中,抗AD 药物的研发屡次受挫。 尽管全球诸多药企投入了大量的人力物力,但2003 年以来没有一个抗AD 药物被FDA 批准上市。 2019 年国产抗AD 药物GV-971 的上市在一定程度上填补了这一空白,然而抗AD 药物的研发依然充满挑战。目前处于Ⅲ期临床试验的抗AD 药物中,靶向Aβ的占比最高(占35%),其余如基于突触可塑性和神经保护的占24%,靶向tau 的占6%,表明Aβ 仍可作为抗AD 药物研发的重要靶点。
作者从减少Aβ 产生、 增加Aβ 清除、 抑制Aβ与神经元结合和抑制Aβ 聚集4 个方面总结目前仍在临床试验阶段的靶向Aβ 药物的研究进展。 其中,减少Aβ 产生和促进Aβ 清除是2 个最主要的策略。通过抑制分泌酶活性可以有效减少Aβ 产生,因此,BACE-1 和γ-分泌酶曾经是药物开发的热门靶点。然而BACE-1 和γ-分泌酶的底物不仅局限于APP,抑制剂会同时阻断其他通路,毒副作用强,相关药物的临床试验均已逐渐走向终点。 另一方面,抗体药物是促进Aβ 清除的主要手段。 多个Aβ 抗体药物在Ⅰ期、Ⅱ期临床试验中有效减少了患者脑内Aβ沉积,具有靶向性好、效价高的特点。 然而多个药物却在Ⅲ临床试验中因无法有效改善AD 患者认知功能而失败。 2021 年,Aducanumab 成为20 年来首个FDA 批准的抗AD 药物,证明清除Aβ 可改善AD临床结果,为Aβ 学说打了一剂“强心针”。 通过总结AD 病理机制研究及药物研发进展,现有基于Aβ 学说的抗AD 药物研发的挑战在于:AD 发病时已在病程晚期,此时Aβ 已达到较高水平并介导了多个病理学变化。 目前基于Aβ 学说的治疗策略大部分针对的是Aβ 代谢异常,旨在减少Aβ 的形成和聚集,并没有针对其产生毒性的下游通路,因而难以改变神经元受损的事实。从Aβ 受体的角度出发,在疾病早期抑制Aβ 寡聚体毒性或改善Aβ 转运情况,改善患者认知,可能成为AD 治疗的新策略。成对免疫球蛋白样受体(PirB)是一种I 型跨膜糖蛋白,通过融合表达PirB 胞外段蛋白,并且与TAT 蛋白融合,这种融合蛋白被定义为TAT-PEP。 研究发现该蛋白不仅可以穿过血脑屏障进入大脑,同时可以和神经抑制因子结合,起到拮抗PirB 的作用,可以促进轴突的再生和突触的形成,从而改善认知功能[61]。 因此,PirB可能成为AD 药物开发的一个全新靶点。 由于神经元损伤一旦发生就难以逆转,此类综合早期干预措施对AD 的预防、控制具有重要意义。

