静息态脑电在阿尔茨海默病诊断中的价值
周亚新,邵 园,王圆龙,林亚男,张梁英,3,王永军*
(1.安徽医科大学精神卫生与心理科学学院,安徽 合肥 230032;2.深圳市康宁医院,广东 深圳 518020;3.济宁医学院精神卫生学院,山东 济宁 272067 *通信作者:王永军,E-mail:wangyj1931@163.com)
阿尔茨海默病(Alzheimer disease,AD)是一种起病隐匿、以认知障碍为主、并伴有精神行为异常和社会功能减退的神经退行性疾病[1]。AD 的误诊率、患病率、致残率较高,给社会及家庭带来沉重负担。2019年,全世界大约有470万人患有痴呆症,预计2050年将增加到1 380万人[2],2021年我国阿尔茨海默病报告显示,我国AD 死亡居城乡居民总死亡原因的第5 位[3]。然而,目前AD 的病因尚不完全清楚,其中Aβ42 沉积和Tau 蛋白异常磷酸化形成的神经纤维缠结为主要病理假说[4]。当前,对AD的临床诊断主要基于患者的临床表现和头颅磁共振检查[5-6],早期很难被发现。AD 的分子生物学诊断需要进行脑脊液[7]或脑PET 标记物成像分析[8],存在一定的创伤,且费用较高,难以普及。寻求一种简单、便捷、无创的AD 诊断工具已成为老年医学临床领域亟需解决的问题。脑电主要监测大脑的生物电节律,了解大脑的功能状态,与大脑神经功能密切关联[9-10],且脑电的变化与认知功能也存在一定的关联[11-13]。但目前脑电指标用于诊断AD 尚不成熟。因此,探讨脑电作为AD 诊断工具的价值是目前重要的研究方向。本研究以AD 患者为对象,分析脑电在AD 诊断中的价值,为临床上AD 的早期识别提供参考。
1 对象与方法
1.1 对象
于2022年6月,回顾性分析2019年5月-2022年5 月在深圳市康宁医院老年精神科住院患者的临床资料。入组标准:①年龄60~85 岁;②由一名精神科主治医师和一名主任医师完成诊断,符合《国际疾病分类(第10 版)》(International Classification of Diseases,tenth edition,ICD-10)AD 诊断标准,首次诊断为AD;③病历资料完整。排除标准:①存在严重肝肾器官功能障碍;②伴有其他导致认知功能减退的中枢神经系统疾病,如帕金森病、亨廷顿病、硬膜下血肿、正常颅压脑积水、脑部肿瘤;③存在导致痴呆的全身性疾病,如B 族维生素缺乏、低钙血症、神经梅毒、HIV 感染;④存在听力及视力障碍以及严重运动障碍等不能配合检查或无法正常交流者;⑤脑电图检查前两天内服用过镇静剂、安眠药、抗癫痫药等。符合入组标准且不符合排除标准的AD 患者共59例。同期收集在深圳市康宁医院门诊检查的健康老年人为对照组。入组标准:①年龄60~85岁;②基本资料完整。排除标准:诊断为AD或患有重大躯体疾病者。符合入组标准且不符合排除标准共54例。
1.2 资料收集及方法
收集患者一般资料,包括性别、年龄、受教育年限以及独居情况。收集临床资料,包括高血压史、脑卒中史、心脏病病史、合并其他精神疾病史以及吸烟和饮酒情况。收集实验室资料,包括甲状腺功能、血脂和血糖指标。收集颅脑磁共振成像(MRI)资料,包括脑萎缩和脑白质高信号情况。以上所有资料收集均由一名研究人员完成。
采用简易精神状态评价量表(Mini-Mental State Examination,MMSE)[14]评定患者的认知功能。MMSE 共30 个条目,总评分范围0~30 分,测评耗时5~10 min。MMSE 评分≥27 分为正常,21~26 分为轻度痴呆,10~20 分为中度痴呆,<10 分为重度痴呆。该量表Cronbach’s α系数为0.890。
采用蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)[15]评定患者的认知功能。MoCA共12 个条目,满分为30 分,测评耗时10~15 min。若受教育年限≤12 年,最后评分再加1 分,总评分越高表明认知功能越好。
AD 组于入院后第二天,健康对照组于门诊就诊当天,由一名研究人员在科室的测量室进行资料收集和量表评定,时间控制在1 h 内,可根据受试者情况适当调整时间。
1.3 脑电图采集
采用Nicolet 型号8 通道脑电图仪描记EEG,由1 名具有中级职称的脑电图技师进行指导。采样率设置为250 Hz,输入阻抗Z>100 MΩ,使用国际10-20 标准电极系统放置电极,记录至少20 min 的8 通道(Fp1、Fp2、F3、F4、F7、F8、O1、O2)脑电图,参比电极为Cz,接地电极为Fpz。由于记录装置的限制,未使用顶叶电极。所有受试者均在闭眼、清醒状态下进行脑电数据采集,尽量避免眨眼、吞咽、咬牙、晃头或肢体活动等动作,以免肌电干扰影响脑电图结果。
1.4 统计方法
采用Matlab(R2017a)软件中的EEGLAB 工具进行脑电数据预处理,利用快速傅里叶变换(Fast Fourier Transform,FFT)进行时频转换,计算在Fp1、Fp2、F3、F4、F7、F8 脑电电极上的α、β、θ 和δ 频段绝对功率以及α 和θ 绝对功率比值(α/θ)。采用SPSS 25.0 进行统计分析,计数资料组间比较采用χ2检验,符合正态分布的计量资料以(±s)表示,组间比较采用两独立样本t 检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用两样本秩和检验。采用Spearman 相关分析考查脑电变量与MMSE 和MoCA 评分的相关性。检验水准α=0.05。临床资料的建模采用Logistic回归分析,采用受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under curve,AUC)评估模型性能。
2 结 果
2.1 基本资料
本研究共纳入59 例AD 患者和54 例健康对照组。两组年龄、高血压、糖尿病、睡眠障碍、脑萎缩、心脏病病史以及MMSE 和MoCA 总评分差异均有统计学意义(P<0.05或0.01)。见表1。
2.2 两组脑电差异分析
AD 患者右额极(F4)和左右侧额极(F7、F8)的θ绝对功率均高于健康对照组,差异均有统计学意义(t=-2.844、-2.825、-3.014,P<0.05 或0.01)。AD患者左右前额极(Fp1、Fp2)、左右额极(F3、F4)、左右侧额极(F7、F8)的α/θ绝对功率比值均低于健康对照组,差异均有统计学意义(t=2.081、2.327、3.423、2.358、3.272、2.445,P<0.05或0.01)。见表2。
表2 两组脑电θ绝对功率值和α/θ绝对功率比值比较(±s)Table 2 Comparison of the absolute power values of θ band and α/θ absolute power ratio of EEG between the two groups
注:AD,阿尔茨海默病
组 别AD组(n=59)健康对照组(n=54)t P Fp2 0.79±0.42 0.74±0.63-0.533 0.591 t P F3 1.09±0.49 0.97±0.37-1.440-2.846 F4 1.13±0.45 0.91±0.38-2.844 0.010 F7 1.34±0.58 1.08±0.40-2.825<0.010 F8 1.28±0.65 0.95±0.46-3.014<0.010组 别AD组(n=59)健康对照组(n=54)θ绝对功率Fp1 0.65±0.46 0.58±0.55-0.726 0.477 α/θ绝对功率比值Fp1 0.66±0.14 0.74±0.22 2.081 0.040 F8 0.84±0.26 0.84±0.26 2.445 0.020 Fp2 0.66±0.15 0.73±0.18 2.327 0.020 F3 0.69±0.17 0.84±0.2 3.423<0.010 F4 0.72±0.20 0.81±0.23 2.358 0.010 F7 0.71±0.21 0.87±0.28 3.272 0.010
2.3 脑电变量与MMSE和MoCA评分的相关性
AD 患者MMSE 评分与α 绝对功率、β 绝对功率和α/θ 绝对功率比值均呈正相关(r=0.206、0.288、0.372,P<0.05 或0.01)。MoCA 评分与β 绝对功率和α/θ 绝对功率比值均呈正相关(r=0.201、0.315,P<0.05 或0.01),与θ 绝对功率呈负相关(r=-0.218,P<0.05)。见表3。
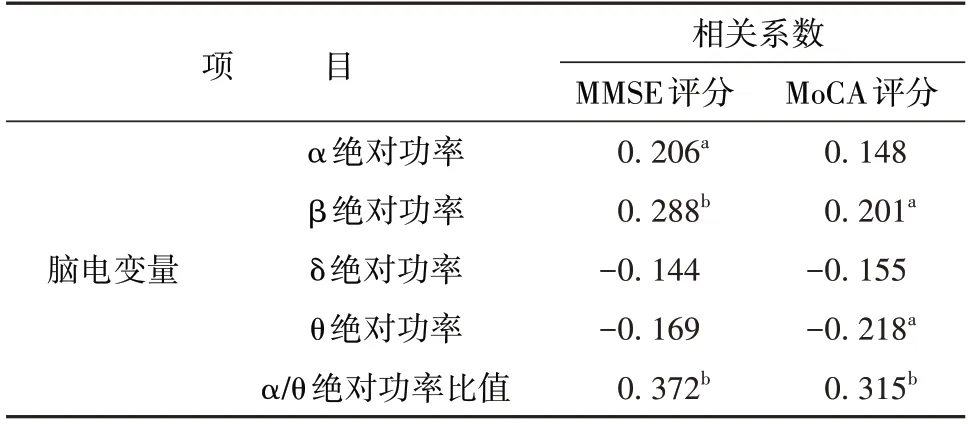
表3 各脑电变量与MMSE和MoCA评分的相关性(r)Table 3 Correlation between EEG variables and MMSE/MoCA scores
2.4 静息态脑电预测AD的Logistic回归分析
以AD 患病频率的转换量为因变量,以各项脑电指标为自变量,对AD 的影响因素进行二元Logistic回归分析,结果显示,较低的α绝对功率(OR=0.220,P=0.010)、较低的β 绝对功率(OR=0.304,P=0.040)、较高的θ绝对功率(OR=5.628,P=0.004)以及较低的α/θ 绝对功率比值(OR=0.080,P<0.01)是罹患AD的危险因素。见表4。

表4 静息态脑电预测AD的Logistic回归分析Table 4 Logistic regression analysis of resting state EEG in predicting AD
2.5 整合预测模型分析
基于上述脑电变量的筛选,分别整合人口学资料、实验室资料及血管因素资料进行Logistic回归分析,结果显示,年龄、高血压、糖尿病、脑萎缩和心脏病病史均为罹患AD的危险因素(OR=1.101、2.046、2.013、13.110、5.654)。见表5。
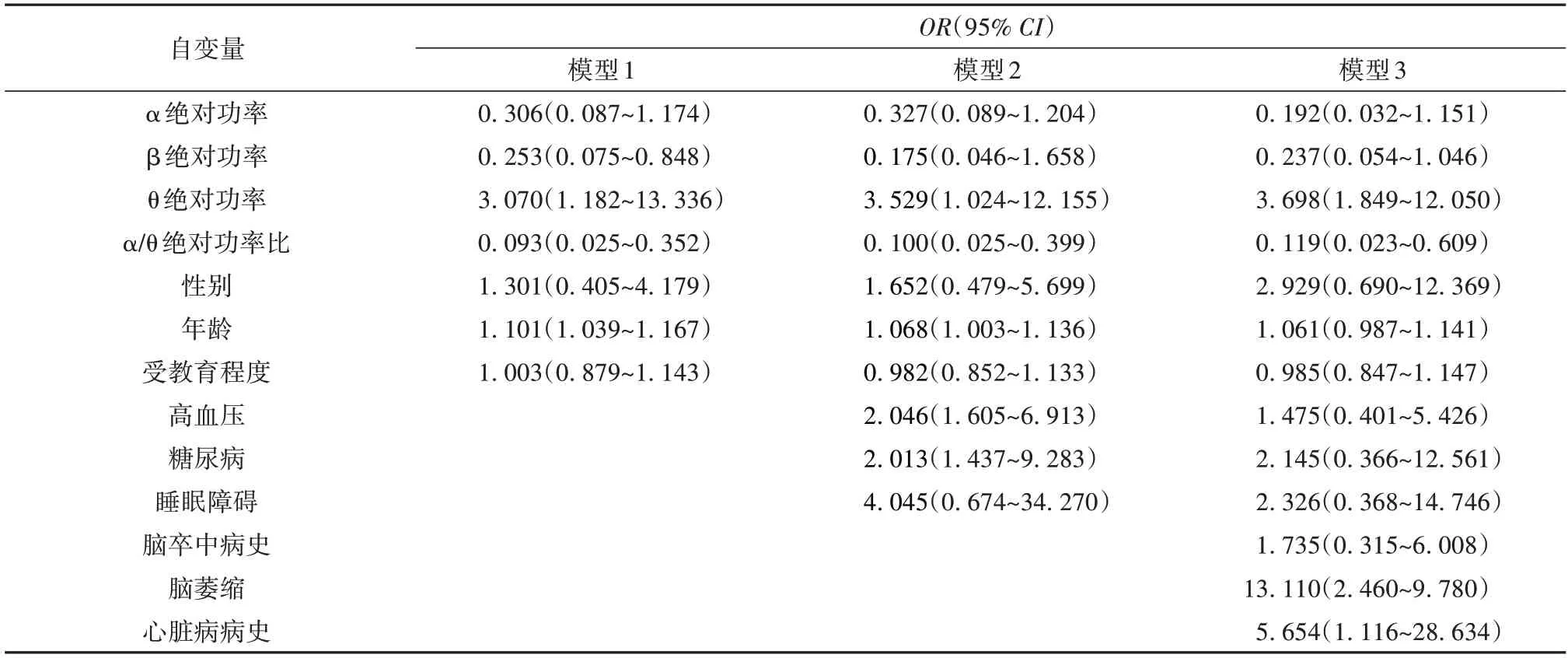
表5 整合变量后脑电在AD预测模型的价值Table 5 Analysis of EEG in prediction models for dementia after integrating variables
绘制ROC 曲线,结果显示,静息态脑电变量组合后模型的AUC=0.882,95% CI:0.820~0.943,该模型性能较好,最佳界值为0.638,灵敏度为0.966,特异度为0.673。见表6 和图1。脑电组合人口学资料、血管因素变量和实验室资料后的模型性能均较好。见表6 和图2。综合变量的模型AUC=0.946,95% CI:0.905~0.986,最佳界值为0.821,灵敏度为0.948,特异度为0.873。见表6。

图1 脑电变量和脑电变量组合后模型的ROC曲线和AUC值Figure 1 ROC curves and AUC values of the model after the combination of EEG variables and EEG variables

表6 根据各脑电和组合数据预测模型的评价Table 6 Evaluation of prediction models according to EEG and combined data
3 讨 论
AD 已经成为影响老年人健康的主要疾病之一。在世界范围内,AD 的患病率、发病率和死亡率不断上升[16-17],AD 的病因病理机制目前尚不完全清楚,但影响AD 的因素较多,如高血压、糖尿病、脑血管意外以及心脏疾病等[18-20]。本研究显示,AD 组患高血压、糖尿病、心脑血管疾病的人数均多于健康对照组,Skoog等[21]和Kannel[22]研究显示,高血压、糖尿病、心血管疾病经常同时发生,可引起血管壁的改变,可能导致脑灌注不足、缺血或脑缺氧,进而触发AD的老年斑和神经纤维缠结的病理改变。
本研究结果显示,在额叶脑区电极,AD 组θ 绝对功率值高于健康对照组,α/θ 绝对功率比值低于健康对照组,与既往研究结果一致[23],即AD 患者早期静息态脑电的θ绝对功率增加,α/θ绝对功率比值降低。Musaeus 等[24]研究也表明,θ 绝对功率与脑脊液总tau 蛋白(T-tau)及磷酸化tau 蛋白(P-tau)水平密切相关,且P-tau/Aβ42 比值与θ 绝对功率有更强的相关性,尤其在右后脑区。然而,有研究显示,在AD 早期未见任何频段的脑电异常[25]。也有研究显示,脑电α 节律的减慢可能是AD 的主要特征[25-26]。既往研究结果的不一致可能与脑电易受干扰有关,如头发的疏密、监测环境及用药情况等。
既往研究结果显示,脑电与认知功能相关[27-28],脑电作为AD 的诊断工具可能具有一定价值。本研究中,脑电α 绝对功率、β 绝对功率和α/θ 绝对功率比值与MMSE 和MoCA 评分均呈正相关,θ 绝对功率与MoCA 评分呈负相关,与既往研究结果一致。Choi等[29]比较了496 名老年参与者前额叶区域的静息态脑电和MMSE评分,结果显示,静息态脑电放缓与MMSE 总评分和认知领域评分均存在相关关系,特别是在时间和地点定位方面。
Logistic 回归分析显示,α、β、δ、θ 绝对功率和α/θ 绝对功率比值进入模型,尤其θ 绝对功率和α/θ绝对功率比值在模型中具有较好的特异度和灵敏度,提示脑电可能是AD 诊断的重要电生理指标,这与既往研究结果一致[30]。Poil 等[31]纳入6 个脑电生物标志物的Logistic 回归模型预测AD 的灵敏度为88%,特异度为82%。由于脑电易受多种因素的影响,故本研究整合人口学资料和血管因素等指标进行分析,结果显示,高血压、糖尿病、脑萎缩和心脏病病史均可增加罹患AD 的风险。脑电模型性能分析显示,静息态脑电变量组合后模型AUC 为0.882,该模型分类效果较好,所有变量整合的模型分类效果最好,AUC 为0.946。然而到目前为止,相关研究较少,早期的一项研究显示,脑电图的使用提高了通过神经心理和心血管因素来识别痴呆和轻度认知障碍的Logistic模型的准确性,准确率从82%提升到92%[32]。另外一项研究纳入6 个脑电变量,结合模糊理论建立AD 的预测模型,检出率为84.86%[33]。因此,脑电及整合其他指标可能是AD诊断的重要指标。
综上所述,静息态脑电作为一种特异性的生理指标,在AD 诊断方面可能具有较高的潜在价值,尤其是θ 绝对功率和α/θ 绝对功率比值。本研究局限性:因临床住院患者有限以及受住院时长的影响,样本量相对较少,且未对模型进行重复验证。今后需要更多的大样本、有模型重复验证等前瞻性研究以进一步考查静息态脑电在AD 诊断中的价值,为临床应用提供参考。

