微粒聚谷氨酸配施化肥对棉花生长和土壤养分及微生物群落结构的影响
陶龙锦 ,张经博 ,董正武 ,马晓东 ,涂永峰 ,赵冬梅 ,刘隋赟昊
(1.新疆师范大学 生命科学学院,新疆 乌鲁木齐 830054;2.新疆特殊环境物种保护与调控生物实验室,新疆 乌鲁木齐 830054;3.新疆特殊环境物种多样性应用与调控重点实验室,新疆 乌鲁木齐 830054;4.新疆慧尔农业集团股份有限公司,新疆 昌吉 831100)
棉花是新疆重要的经济作物,对新疆农业经济发展起着至关重要的作用[1]。近年来,南北疆超高产棉田频繁出现,由于施肥量加大,化肥使用率降低,造成棉田的环境污染,严重影响我国种植业的健康发展。因此,迫切需要新型环境友好型肥料,提高肥料利用率,降低污染。
缓控释肥的使用,在减少环境污染的同时,还能有效提高肥料利用率,已在棉花研究上得到应用[2]。γ-聚谷氨酸(γ-PGA)是一种可降解的绿色生物大分子材料,来源于微生物发酵,拥有巨大的开发潜力,在农业生产、医药、环保、食品等多个领域都有应用[3]。有研究发现,在蜜柑叶片上喷施5次质量浓度为200 mg/L的γ-PGA水溶肥,比不施用单果鲜质量提高17.4%,在草莓上施用2次100 mg/L的γ-PGA水溶肥,其产量比对照提高29.6%[4-5]。采用γ-PGA作增肥剂的茄子,氮磷钾肥表观利用率较常规肥分别提高了17.13~22.77、13.25~18.28、1.94~12.95百分点[6]。γ-PGA与肥料混合施用后,氮肥利用率提高59.0%,磷肥利用率提高5.8%,钾肥利用率提高17.9%,油菜、小青菜、番茄、玉米等作物施用γ-PGA都能增产节肥[7]。在蔬菜生长期,γ-PGA的喷施会显著增加植株株高、单株质量和产量等,同时也会对土壤微生物产生影响[8]。
土壤微生物由于其数量众多、种类繁多及其重要的功能,被认为是土壤中最活跃、最丰富的生物类群之一[9]。土壤微生物是陆地生态系统养分循环中不可缺少的重要参与者,对土壤物质循环起着至关重要的作用[10]。因为土壤微生物群对环境条件改变存在着高度敏感,在评判土壤品质与土壤肥力水平的过程中,其种群结构、组成与多样化都可以成为关键因素[11]。有研究表明,将γ-PGA作为底肥施加于土壤中,可明显促使根际微生物群落的发育[12]。在西瓜苗播种前,向基质中添加γ-PGA可以显著提高育苗基质微生物的活性[13]。未经纯化的γ-PGA发酵液或γ-PGA肥料,能够大大提高土壤微生物的数量、多样性和平衡性[14]。而γ-PGA则可以增强土壤肥力,降低营养损失,并促进根区微生物种群的发育。这也为γ-PGA调控作物生长提供了依据。
本研究使用盆栽试验,探讨微粒γ-PGA对新疆棉花的形态特征与根际土壤微生物群落的影响,旨在阐明微粒γ-PGA作为肥料增效剂,促进养分吸收,提高棉花产量的作用机理,并为微粒γ-PGA在棉花中的合理使用提供理论依据。
1 材料和方法
1.1 试验地概况
试验于2022年5月10日在新疆维吾尔自治区乌鲁木齐市沙依巴克区的新疆师范大学昆仑校区的自然光温室进行,温室内平均气温30 ℃,昼夜温差10 ℃,相对湿度40%,二氧化碳浓度为532.10 mg/m3,光照充足。供试土壤为壤土,肥力中等,土壤有机质7.5 g/kg,铵态氮41.2 mg/kg,有效磷18.5 mg/kg,有效钾115 mg/kg,pH值7.5。
1.2 试验材料
供试棉花品种为新陆早80号,其生育期117 d,吐絮率在95.6%以上。化肥选用氮磷钾复合肥(NPK为:15-15-15,有效成分45%),γ-PGA选用慧尔聚谷氨酸微粒肥(γ-PGA含量≥10%,N≥5%,P≥1%,K≥1%)。花卉营养土从当地市场购买。
1.3 试验方法
1.3.1 试验设计 试验共设置5个施肥处理,分别为:P1.4.5 g微粒γ-PGA配施1 g化肥;P2.3 g微粒γ-PGA配施1 g化肥;P3.1.5 g微粒γ-PGA配施1 g化肥;N.1 g化肥;CK.不施肥,为空白对照。选用75个花盆(内径18.5 cm、高7.5 cm),每盆装土1 400 g。每个处理设置15个重复,每个花盆栽种3株棉花,5月10日开始育苗,5月25日进行第1次施肥管理,6月10日定植,每盆仅保留长势最好的1株,并进行第2次施肥,每隔14 d进行一次施肥管理,总共6次,各处理具体方式如表1所示。

表1 施肥处理Tab.1 Fertilization treatment
1.3.2 棉花农艺性状的测定 在棉花蕾期(7月5日)、花铃期(8月5日)、吐絮期(9月5日),每个处理随机选取5株,使用卷尺测量株高,用游标卡尺测量株径,并记录棉花主茎叶数、果枝数。
1.3.3 土壤样品的采集与测定 在第6次施肥之后,2022年8月10日在每个处理随机选取3株植株,以棉花的根部为圆心,半径约5 cm,深10 cm,用铲刀小心地挖掘泥土并去除大土块,近根的土壤近似看成根际土,并将所收集的土壤样品均匀置于盘子上,去除样品中的落叶、砂石等污物,将土样混匀后再均匀铺于盘子内,组成一四方形。随后,在该四方形中心画一条对角线,将对角线两端的土样分别合并成一个子样品。保留一份装入离心管中作为1个重复,另一部分回填,每个处理各3个重复。将离心管带回实验室,立即置于-80 ℃冻存,以便后续进行根际微生物DNA的提取工作。9月10日将棉花植株采收后重复上述操作。
土壤化学性质测定参考《土壤农化分析》[15]中的相关方法进行。其中,土壤pH采用pH计测定;土壤总有机质(SOC)含量采用重铬酸钾-外加热法测定;土壤全氮(TN)含量采用凯氏定氮法测定;土壤全磷(TP)含量采用紫外可见分光光度计进行测定;土壤全钾(TK)含量采用火焰光度计法进行测定;土壤铵态氮(AN)含量通过全自动流动注释分析仪进行测定;土壤有效磷(AP)含量通过钼锑比色法进行测定;土壤有效钾(AK)含量通过火焰原子光度计法进行测定。
1.3.4 土壤微生物种类多样性测定 使用Power Soil DNA Isolation Kit强力DNA提取试剂盒(Power Mag™ Soil DNA Isolation Kit,MO BIO)进行微生物总DNA的提取。在进行细菌16S rRNA(V3+V4)区域的PCR扩增时,使用正向引物5′-AC TCCTACGGGAGGCAGCA-3′;反向引物5′-GGA CTACHVGGGTWTCTAAT-3′[16]。真菌ITS1区域引物:正向引物5′-CTTGGTCATTTAGAGGA AGTAA-3′;反向引物5′-GCTGCGTTCTTCAT CGATGC-3′[17]。本研究中所有样品的测序和生物信息服务均在北京百迈客生物科技有限公司Illumina NovaSeq测序平台完成。微生物多样性是基于Illumina NovaSeq测序平台,利用双末端测序(Paired-End)的方法,构建小片段文库进行测序。通过对Reads拼接过滤,聚类或去噪,并进行物种注释及丰度分析,揭示样品的物种构成;进一步进行α多样性分析(Alpha Diversity)、β多样性分析(Beta Diversity)、显著物种差异分析、相关性分析、功能预测分析等,挖掘样品之间的差异。
1.4 数据分析
试验使用Microsoft Excel 2016软件对数据进行整理,采用SPSS 20.0软件One-way ANOVA对棉花株高、茎粗、主茎叶数、果枝数分析,使用R 4.0.2对微生物数据进行分析,使用Origin 2021绘制细菌群落丰度图,使用Vegan 2.5.6进行RDA分析。
2 结果与分析
2.1 聚谷氨酸配施化肥对棉花植株生长的影响
由图1可知,在7、8月P2处理的株高显著最高,其次为P1、P3处理,在9月P1处理的株高显著最高,其次为P2、P3处理,N处理和CK的株高在7、8、9月均较低。在7、8月P2、P3处理的茎粗显著较高,P1、N处理和CK的茎粗较低,在9月P1、P3处理的茎粗显著较高,其次为P2处理,N处理和CK的茎粗较低。在7、8月P1处理的主茎叶数最低,其余处理组的主茎叶数均高于P1处理,在9月P3处理的主茎叶数显著最高,其次为P1、P2处理,N处理和CK较低。在7月P1、P2、P3处理的果枝数显著较高,CK次之,N处理最低,8月P2、P3处理的果枝数显著较高,N处理和CK次之,P1处理最低,9月P3处理的果枝数显著最高,P1处理次之,P2、N处理较低,CK最低。

图1 不同处理对棉花生长指标的影响Fig.1 Effects of different treatments on cotton growth indexes
2.2 聚谷氨酸配施化肥对土壤化学性质的影响
对盆栽棉花采前和采后的土壤进行化学性质测定,结果如表2所示。

表2 不同处理下的土壤化学性质Tab.2 Soil chemical properties under different treatments
由表2可知,采前N处理的pH最低,为7.53,其余处理间无显著差异,采后CK的pH最高,为7.63,P1处理最低,为7.27;采前P1、N处理和CK的土壤有机质含量较高,分别为44.62、44.26、43.65 g/kg,P2处理最低,为40.75 g/kg,采后N处理和CK的土壤有机质含量较高,分别为35.34、35.05 g/kg,P1、P2、P3处理较低;采前P1处理和CK的土壤全氮含量较高,分别为1.14、1.12 g/kg,其余处理次之且无显著差异,采后P1处理的土壤全氮含量最高,为1.78 g/kg,P3处理最低,为1.16 g/kg;采前CK的土壤全磷含量最高,为2.16 g/kg,P3处理最低,为0.47 g/kg,采后CK的土壤全磷含量最高,为1.26 g/kg,N处理最低,为0.84 g/kg;采前P2处理的土壤全钾含量最高,为9.81 g/kg,N处理最低,为4.02 g/kg,采后P3处理的土壤全钾含量最高,为10.06 g/kg,N处理最低,为5.23 g/kg;采前P2、P3处理的土壤铵态氮含量较高,分别为80.37、81.78 mg/kg,N处理最低,为61.27 mg/kg,采后P1处理的土壤铵态氮含量最高,为246.63 mg/kg,CK最低,为53.06 mg/kg;采前P3处理的土壤有效磷含量最高,为159.57 mg/kg,CK最低,为14.20 mg/kg,采后P2、P3处理的土壤有效磷含量较高,分别为172.86、173.41 mg/kg,CK最低,为39.87 mg/kg;采前N处理的土壤有效钾含量最高,为90.40 mg/kg,P2处理最低,为52.46 mg/kg,采后P1处理的土壤有效钾含量最高,为107.22 mg/kg,CK最低,为48.10 mg/kg。
2.3 土壤微生物OTU数量及微生物群落多样性分析
由图2可知,CK的细菌OTU值在采前和采后均显著最高,N处理从采前明显最低提高至CK水平,增加了871,微粒γ-PGA配施化肥的P1、P2、P3处理的细菌丰富度采前和采后均小于CK,N处理的细菌丰富度在采后急剧上升,CK无明显改变,各处理细菌多样性变化与丰富度变化基本一致;CK的真菌OTU值在采前明显最大,采后大幅下降,减少58.67,其余处理的真菌OTU值均较小且在采前和采后差异不大,CK的真菌丰富度在采前明显最大,P3处理次之,其余处理采前与采后的真菌丰富度差异不大,N处理的真菌多样性在采前明显最大,P3处理次之,P1、P2处理和CK的真菌多样性较低,采后N处理的真菌多样性大幅下降,P1、P2处理和CK明显增加,采后P2、P3、N处理和CK的真菌多样性相似且均高于P1处理。

图2 不同处理下微生物的OTU值和多样性指数Fig.2 OTU values and diversity indexes of microorganism under different treatments
2.4 土壤微生物在门水平上的物种组成变化
从门水平上对各处理的微生物相对丰度进行数据分析,结果如图3所示,在所有细菌种群的门水平分布中,变形菌门(Proteobacteria)占据比例最高,其次是酸杆菌门(Acidobacteriota)、放线菌门(Actinobacteriota)、芽单胞菌门(Gemmatimonadota)、拟杆菌门(Bacteroidota)、绿弯菌门(Chloroflexi)等。采摘前各配施处理棉花土壤根际细菌群落与采摘后相比有所差异,变化为:变形菌门的相对丰度均出现大幅度下降,分别下降4.61、11.66、9.59、19.04、10.36百分点;酸杆菌门在配施有γ-PGA的处理中变化不大,但化肥和清水处理酸杆菌门比例显著增加,分别增加9.28、6.09百分点;放线菌门在配施γ-PGA的处理中占比增加,分别增加5.28、5.34、5.49百分点,而化肥和清水处理中则基本维持不变;芽单胞菌门在配施有γ-PGA处理中变化不大,但化肥和清水处理中芽单胞菌门比例显著增加,分别增加4.94、6.99百分点。

图3 各处理不同时期下微生物优势群落门水平分布Fig.3 Horizontal distribution of microbial dominant community phylum under different treatments at different periods
如图3所示,在真菌群落的门水平分布中,子囊菌门(Ascomycota)占据比例最高,其次为担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、壶菌门(Chytridiomycota)和球囊菌门(Glomeromycota)等。采摘前各配施处理棉花土壤根际真菌群落与采摘后相比有所差异,变化为:子囊菌门的相对丰度在配施γ-PGA处理下的占比大幅度下降,分别下降12.67、30.08、17.08百分点,而化肥和清水处理的下降幅度较小;各处理中担子菌门均有所升高,分别增加10.23、3.49、9.24、7.65、3.31百分点;被孢霉门在各处理中均表现为下降的趋势,分别下降13.48、0.25、9.71、0.79、3.99百分点;壶菌门在配施γ-PGA处理中占比大幅度上升,分别增加8.19、6.38、2.11百分点,而化肥和清水处理则基本不变或略微上升。
2.5 根际微生物群落与土壤化学性质的相关性分析
采前细菌群落与土壤化学性质的RDA分析(图4-A),总解释率达87.20%,第1、2排序轴对土壤细菌群落变化的解释率分别为67.79%和19.41%,土壤TP、AP含量与土壤细菌群落结构相关性最大,其次是TK、pH,TN、AN、AK和SOC的影响较小,配施γ-PGA的P1、P3处理组相对距离较近,细菌群落相似性较高。采后细菌群落与土壤化学性质的RDA分析(图4-B),总解释率达80.12%,第1、2排序轴对土壤细菌群落变化的解释率分别为68.89%和11.23%,土壤SOC、AN、AP含量与土壤细菌群落结构相关性最大,其次是TK、TN、pH、AK,TP的影响较小,单施化肥的N处理组和清水处理的CK组相对距离较近,细菌群落相似性较高。采前真菌群落与土壤化学性质RDA分析(图4-C),总解释率达77.09%,第1、2排序轴对土壤真菌群落变化的解释率分别为54.68%和22.41%,土壤AK、pH与土壤真菌群落结构相关性最大,其次是SOC、TK、TN,TP、AN和AP的影响较小,配施γ-PGA的P1、P3处理组相对距离较近,真菌群落相似性较高。采后真菌群落与土壤化学性质RDA分析(图4-D),总解释率达77.09%,第1、2排序轴对土壤真菌群落变化的解释率分别为33.76%和25.80%,土壤AN、AK、pH与土壤真菌群落结构相关性最大,其次是SOC、TP,AP、TN和TK的影响较小,配施γ-PGA的P1、P2处理组相对距离最近,真菌群落相似性较高。
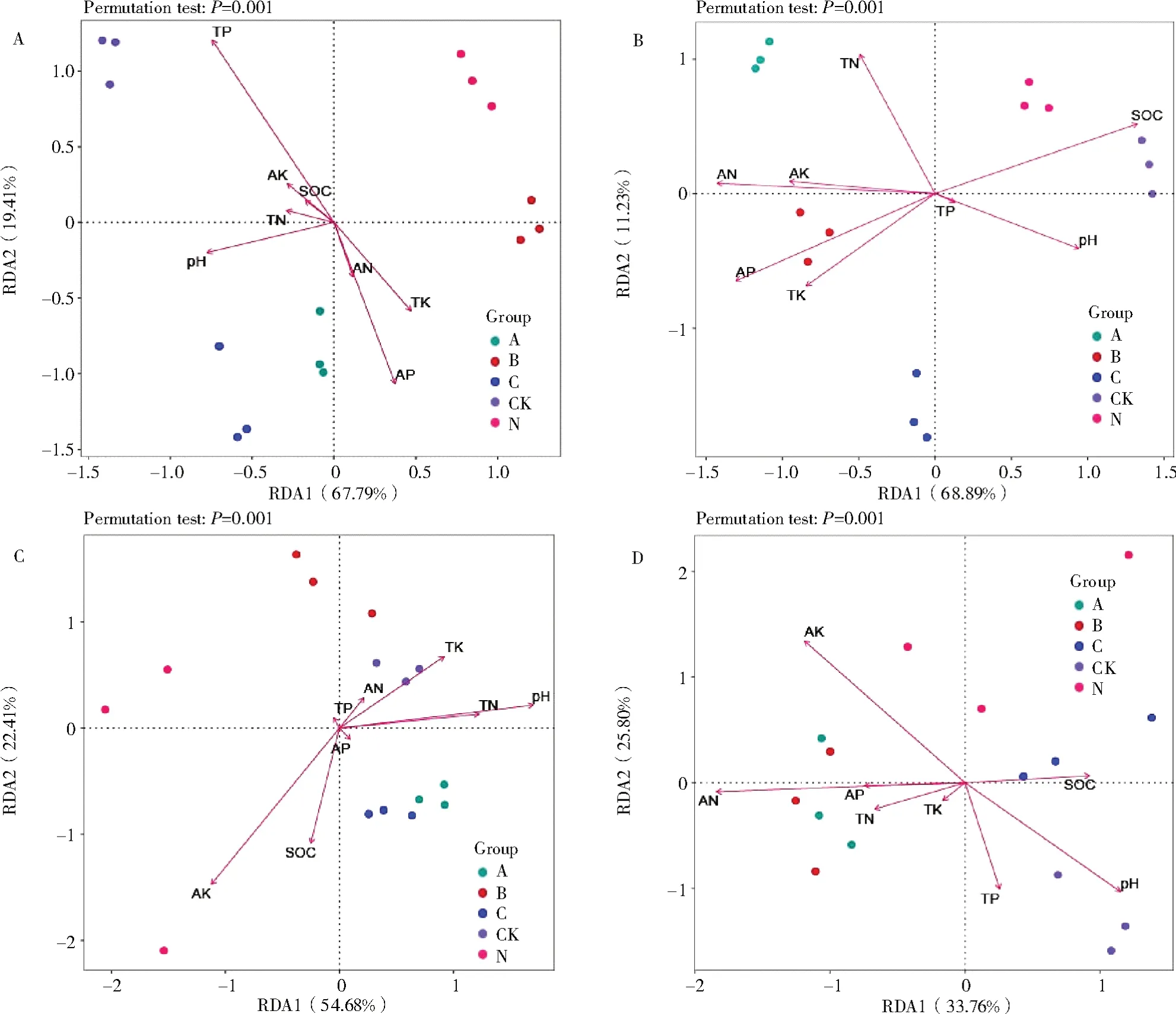
图4 土壤微生物群落与土壤化学性质的RDA分析Fig.4 RDA analysis of soil microbial communities and soil chemical properties
3 结论与讨论
本试验中,配施微粒γ-PGA处理的棉花在各生育期均优于单施化肥和不施肥,其中,配施1.5 g微粒γ-PGA效果最好,在棉花的不同生育期均保持较高的株高、茎粗、主茎叶数和果枝数。褚群等[18]在番茄播种前将γ-PGA溶液混入基质,其中使用10 kg/m3的处理效果最好,在顶部灌溉中,将γ-PGA融入1 L水溶性肥料溶液中,使用10 g/L的处理效果最好。王润凡等[4]对蜜柑叶片进行5次γ-PGA水溶肥喷施,结果显示,200 mg/L应用效果最佳。喻三保等[5]研究发现,对草莓进行2次100 mL/株的γ-PGA水溶肥处理,其产量较不施用处理增加29.6%。与未施用处理相比,该剂量可使单果鲜质量增加17.4%。这表明γ-PGA可以促进作物生长发育,但最佳应用剂量会因植物类型及品种而异。
γ-PGA分子内含有羟基和酰胺基等亲水基团,因此,可以与阳离子矿物养分发生螯合或吸收再利用,这些功能都可以很有效地避免营养物质淋失,从而增加营养物质利用率[19-20];γ-PGA可以增加钙离子和磷酸根的生物效能,减少铵态氮流失[21-22]。微粒γ-PGA配施化肥后,土壤的铵态氮和有效磷含量均明显提高,而其余养分在采前或采后均高于单施肥料和不施肥。有研究表明,在使用生物菌剂和停止施用后,土壤中全氮、有机质和有效钾含量的下降程度很大,而全钾和铵态氮的含量却没有下降,土壤肥力也出现了一定范围的盈余[23]。本试验中γ-PGA配施化肥的土壤全氮和有效钾含量在采后大幅上升,其余养分含量变化基本一致。
γ-PGA具有高生物可降解性,能够同时为细菌生长提供碳源和氮源,进而影响基质细菌的生物活力与功效发挥作用[24]。有研究表明,加入γ-PGA可增加土壤微生物数量和微生物多样性[22]。彭宇等[25]研究表明,施用氨基酸液体肥较仅施用化肥处理显著提高了放线菌和细菌的数量,抑制了真菌的生长。何宇[26]研究表明,添加γ-PGA可降低根际微生物细菌丰富度,增加多样性。本试验中,通过γ-PGA配施化肥降低了细菌的丰富度与多样性,降低了真菌的丰富度,但提高了真菌多样性。土壤中微生物种群组成的改变与土壤pH值、电导率、碱解氮、有效磷含量等诸多因子密切相关[27-28],可能是由于γ-PGA引起土壤化学性质指标改变,进而改变了土壤微生物的丰富度与多样性。
土壤微生物是土壤中不可或缺的组成部分,对于影响土壤的健康评价具有关键作用[29]。研究表明,土壤中常见的细菌优势菌门主要包括变形菌门、放线菌门、绿弯菌门、酸杆菌门等[30],土壤中常见的真菌优势菌门主要为担子菌门、子囊菌门、被孢菌门和壶菌门[31-32]。本试验发现,优势菌门为变形菌门、放线菌门、酸杆菌门、芽单胞菌门、子囊菌门、担子菌门和被孢菌门等,这与上述研究基本一致。变形菌门的大部分成员在固氮中发挥重要作用[33-34]。本试验中,与单施化肥和清水处理相比,配施γ-PGA的采后土壤中变形菌门的相对丰度下降程度较低且保持较高水平。研究已证实,酸杆菌门细菌属于寡营养型细菌,生长缓慢[35-36],通常生活于营养贫瘠的低肥力土壤[37-40]。本试验中,单施化肥和清水处理酸杆菌门的相对丰度增高,γ-PGA配施化肥的采后土壤中酸杆菌门的相对丰度基本不变。有研究发现,放线菌门细菌具有产生多种代谢物及分解难降解物质转化为有机物的功能,是土壤养分供给的重要来源之一[41]。本试验中,单施化肥和清水处理酸杆菌门的相对丰度变化不大,γ-PGA配施化肥的采后土壤中酸杆菌门的相对丰度有所增加。子囊菌门真菌大多为腐生菌,可分解有机质,但子囊菌门也包含大量导致植物病害的病原菌[42]。本试验结果表明,子囊菌门占主导地位,γ-PGA配施化肥的采后土壤中子囊菌门的相对丰度变化大幅下降,单施化肥和清水处理下降幅度较小,可能是γ-PGA可抑制病原菌。担子菌门真菌具有较强的分解木质纤维素的能力,可将植物残体的有机养分矿化为植物可利用的形式,降解植物残体[43]。本试验发现,γ-PGA配施化肥和单施化肥的采后土壤中担子菌门的相对丰度变化大幅上升,清水处理上升幅度较小。随着作物生长过程中环境、土壤条件等的变化,微生物的生长会受到促进或抑制[44]。通过施用γ-PGA能够显著改变变形菌门、酸杆菌门、放线菌门、子囊菌门和担子菌门等相对丰度,并在棉花采摘后依旧维持某些菌门的高相对丰度,维持土壤生物活性。
土壤微生物作为根际微生态系统的主要构成,不仅与植物类型有关,与土壤化学性质同样紧密联系[45]。通过RDA分析结果得出,棉花根系土壤中全磷、全钾、有效磷是细菌群落主要的影响因子,有效钾、pH、有机质是真菌群落主要的影响因子。土壤中的有效磷与有效钾都与土壤微生物群落存在着很大关联,并成为重要因子影响土壤微生物群落的组成[46],本研究也证实了此观点。本研究还发现,不同时期微生物的主要影响因子会发生变化,如采前细菌的主要影响因子全磷,在采后其影响降低,采前真菌的较弱影响因子铵态氮,在采后其成为主要影响因子。
本研究结果表明,1.5 g微粒聚谷氨酸配施化肥处理可有效提高棉花的株高、茎粗、主茎叶数和果枝数;在棉花生育期施用微粒聚谷氨酸肥可提高土壤有益微生物的相对丰度,继而促进土壤铵态氮和有效磷等速效养分的分解,并且在断绝棉花根系与土壤联系后,微粒聚谷氨酸配施化肥的土壤中全钾、铵态氮、有效磷和有效钾含量仍高于单施化肥和不施肥处理;γ-PGA配施化肥虽会降低细菌和真菌群落的整体丰富度与多样性,但使微生物群落种类相对集中在部分有益菌群上,并且在棉花采摘后依旧能维持较高的相对丰度,达到改善土壤质量的作用。

