枸杞叶多酚的超声辅助酶法提取工艺优化及抗氧化活性分析
闫帅帅,晋程妮,武颖,徐建国,张亮亮
(山西师范大学 食品科学学院,山西 太原 030031)
枸杞作为一种药食同源类物质,被《中华人民共和国药典》2020版收录,具有较高的药用价值和营养保健功效[1-3]。《本草纲目》中曾记载,枸杞叶又名天精草,是指枸杞嫩茎部位在春天长出的新鲜芽叶[4]。据研究发现,枸杞叶具有与枸杞相近的化学组成,不仅含有大量的蛋白质、膳食纤维、多种氨基酸等营养成分,还包括黄酮、多酚、多糖和萜类等多种生物活性物质,具有抗氧化、抗炎、降血糖、改善精神疾病等生理功效[5-8]。因此,枸杞叶的潜在医食利用价值和开发应用前景值得关注。
枸杞叶作为枸杞栽培过程中主要的副产物,除被少量的用于茶饮和新鲜食用外,每年造成近百万吨的废弃,提升对枸杞叶副产品的精深加工至关重要[9]。广泛存在于植物原料中的多酚类物质作为开发功能性产品的热点之一,在食品、医药、化工等领域得到应用[10-11]。闫亚美等[12]研究表明,不同品种枸杞叶中黄酮、多酚、氨基酸含量差异较大,且多酚类物质含量最高。并且植物多酚提取物的生物活性、提取效率与提取方法密切相关,常用的提取方法有溶剂萃取法、超临界流体萃取法、超声波辅助浸提法、微波辅助提取法、酶工程技术等。研究表明,多技术协同提取法在多酚提取效率、纯度等方面均优于单一提取技术[13-14]。何若男等[15]运用响应面法优化了微波-超声波协同技术提取黑枸杞叶多酚的试验参数,提高了枸杞叶中多酚的提取效率。具有绿色、高效、操作简单等特点的超声辅助酶法作为一种新兴的提取技术,广泛应用于植物材料中多酚的获取[16-17],但鲜有采用超声辅助酶法提取枸杞叶多酚的报道。
本试验以枸杞叶为原料,通过超声波辅助酶法优化枸杞叶多酚的提取工艺,并对枸杞叶多酚清除自由基能力进行探究,旨在为开发枸杞叶精深加工利用,丰富副产品种类提供参考。
1 材料和方法
1.1 试验材料与试剂
供试枸杞叶为市售,产于宁夏。
没食子酸、福林酚、无水碳酸钠、纤维素酶,上海源叶生物科技有限公司生产;DPPH、ABTS(纯度>99%),美国Sigma公司生产。
1.2 仪器与设备
真空冷冻干燥机(LGJ-30F型,北京松源华兴科技发展有限公司);紫外可见分光光度计(LN-1800PC型,上海美谱达仪器有限公司);超声波清洗机(CQ-250A-DST型,上海恒悦医疗器械有限公司);粉碎机(SS-1022型,永康市红太阳机电有限公司);低速台式离心机(TDL-60C型,上海安亭科学仪器厂)。
1.3 试验方法
1.3.1 枸杞叶多酚提取 在真空冷冻干燥机中将枸杞叶进行干燥,粉碎过筛后样品粉末保存于4 ℃冰箱。
取0.10 g粉末样品,设置超声波清洗机的工作条件(温度60 ℃、功率100 W),加入已知量的纤维素酶、乙醇溶液,提取适当时间,悬浮液离心(3 000 r/min、10 min)后,收集上清液并定容至100 mL,得到枸杞叶多酚提取液[18]。
1.3.2 多酚含量测定 采用福林酚比色法[19]测定枸杞叶多酚的含量。配制0.10 mg/mL没食子酸标准溶液,分别吸取0、0.1、0.2、0.3、0.4、0.5 mL于6个试管中,向各管中加入0.1 mL福林酚试剂和2.8 mL蒸馏水,混匀后再加入7.5%碳酸钠溶液2.0 mL,避光静置1 h,于765 nm波长处测定吸光值,绘制标准曲线,得到线性回归方程为:y=76.917x+0.016(R2=0.998 3),其中,y表示吸光度;x表示没食子酸质量浓度(mg/mL)。吸取枸杞叶多酚提取液0.1 mL,按照没食子酸标准曲线方法步骤操作,根据公式(1)计算多酚含量。
式中,W表示多酚含量(mg/g);c表示提取液中多酚的质量浓度(mg/mL);V表示多酚提取液的体积(mL);n表示稀释倍数;m表示干燥粉末样品的质量(g)。
1.3.3 单因素试验 分别称取枸杞叶粉末0.10 g,设置料液比1∶50(g/mL),超声时间50 min,纤维素酶添加量2 mg/g,考察乙醇体积分数分别为10%、30%、50%、70%、90%时对多酚得率的影响;设置乙醇体积分数70%,超声时间50 min,纤维素酶添加量2 mg/g,考察料液比分别为1∶10、1∶30、1∶50、1∶70、1∶90(g/mL)时对多酚得率的影响;设置乙醇体积分数70%,料液比1∶70(g/mL),纤维素酶添加量2 mg/g,考察超声时间分别为10、20、30、40、50 min时对多酚得率的影响;设置乙醇体积分数70%,料液比1∶70(g/mL),超声时间40 min,考察纤维素酶添加量分别为0、1、2、3、4 mg/g时对多酚得率的影响。
1.3.4 响应曲面设计 基于1.3.3单因素试验,遵循Box-Behnken效应面法,对4个因素(表1)进行4因素3水平的响应面分析,以多酚得率作为响应值,探究枸杞叶多酚的最佳提取工艺条件[20-21]。响应面试验因素水平如表1所示。
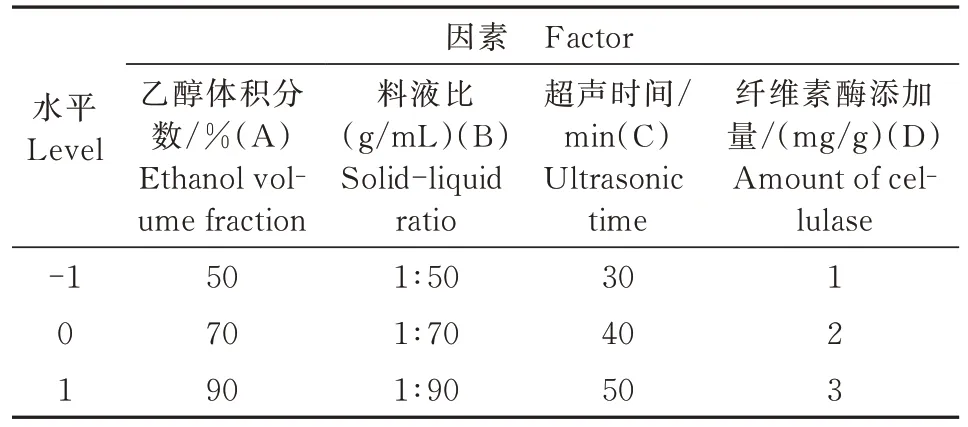
表1 响应面试验因素与水平Tab.1 Response surface test factor and levels
1.3.5 抗氧化指标测定
1.3.5.1 检测清除DPPH自由基能力 用无水乙醇配制60 μmol/L DPPH工作液,测定时在517 nm波长下,调节其吸光度为0.70±0.02。将枸杞叶多酚提取液稀释成不同浓度,分别取0.5 mL提取液置于4 mL比色皿中,加入2.5 mL DPPH溶液,充分反应后,于517 nm处测定吸光度,并用Vc作为阳性对照[22]。根据公式(2)计算DPPH自由基清除率。
式中,A0为空白样品吸光值;A1为提取液溶液的吸光值;A2为样品溶液阴性对照吸光值。
1.3.5.2 检测清除ABTS自由基能力 配制7 mmol/L的ABTS溶液和4.9 mmol/L的过硫酸钾溶液,等体积混匀后4 ℃避光放置12 h,得到ABTS母液。在734 nm波长下,用无水乙醇稀释母液吸光值至0.70±0.02,得到ABTS测定溶液。在3.8 mL ABTS测定溶液中,加入0.1 mL不同浓度的枸杞叶多酚提取液,于734 nm处测定吸光度[23],根据公式(3)计算ABTS自由基清除率。
1.4 数据统计与处理
处理数据、绘图、响应面分析由Origin 8.6、Design-Expert V 8.0.6软件完成。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数对枸杞叶多酚得率的影响 由图1可知,当乙醇体积分数在10%~70%时,多酚得率呈上升趋势,在乙醇体积分数为70%时多酚得率最高,随后逐步下降。这可能是遵循与溶液极性相似相溶性原则,70%乙醇溶液和提取的多酚相溶[24],表明在溶剂中适当加水以增加萃取溶剂的极性是必要的,有利于多酚的提取。综合考虑,响应面优化试验的乙醇体积分数选择50%、70%、90%。
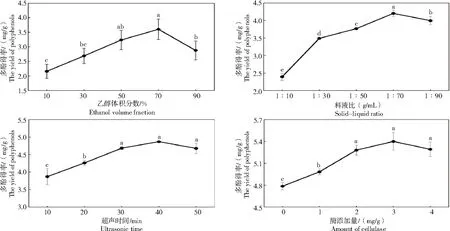
图1 4个单因素对枸杞叶多酚得率的影响Fig.1 Effect of four single factors on the yield of polyphenols from Lycium barbarum leaves
2.1.2 料液比对枸杞叶多酚得率的影响 由图1可知,当料液比在1∶10(g/mL)~1∶70(g/mL)时,多酚得率随着料液比的增加而增加,在料液比为1∶70(g/mL)时达到最大值,这可能是由于溶剂用量的增加使得其与枸杞叶粉末的接触面积加大,从而促进了多酚的提取[25];当料液比大于1∶70(g/mL)时,多酚得率开始降低,这可能是因为溶剂用量过大,超声波与枸杞叶粉末之间的作用降低,不利于多酚物质溶出。因此,响应面优化试验的料液比选择1∶50、1∶70、1∶90(g/mL)。
2.1.3 超声时间对枸杞叶多酚得率的影响 图1显示,超声时间小于40 min时,多酚得率与超声处理时间呈正相关,说明超声时间的增加可促进枸杞叶中生物活性化合物多酚的完全溶出[26]。在超声时间为40 min时,多酚得率达到最大值,之后开始降低。这可能是因为细胞内外浓度达到平衡,待溶出的物质较少,提取效率降低。因此,响应面试验的超声时间选择30、40、50 min。
2.1.4 纤维素酶添加量对枸杞叶多酚得率的影响 图1显示,纤维素酶添加量小于2 mg/g时,多酚得率趋势相对陡峭,这可能是由于酶水解有助于溶剂渗透,通过增加基质孔隙率,使酚类化合物溶出[27]。当酶添加量为2~3 mg/g时,多酚得率增长趋于平缓,可能是由于酶量的增加加快了酶解速度,提高了部分多酚溶出量。当酶添加量高于3 mg/g时,多酚得率出现下降趋势,可能与分解的纤维素造成多酚逸出孔隙堵塞有关[28]。因此,响应面试验的纤维素酶添加量选择1、2、3 mg/g。
2.2 响应面试验优化
2.2.1 响应面试验结果 基于回归拟合分析(表2),得出4个因素与枸杞叶多酚得率之间的二次回归拟合方程:Y=5.16-0.19A+0.087B+0.047C+0.12D+0.082AB+0.059AC-0.028AD-0.20BC-0.097BD+0.005 25CD-0.68A2-0.052B2-0.63C2-0.54D2,二次项系数均小于0,回归拟合曲线开口向下,多酚得率有最大值。
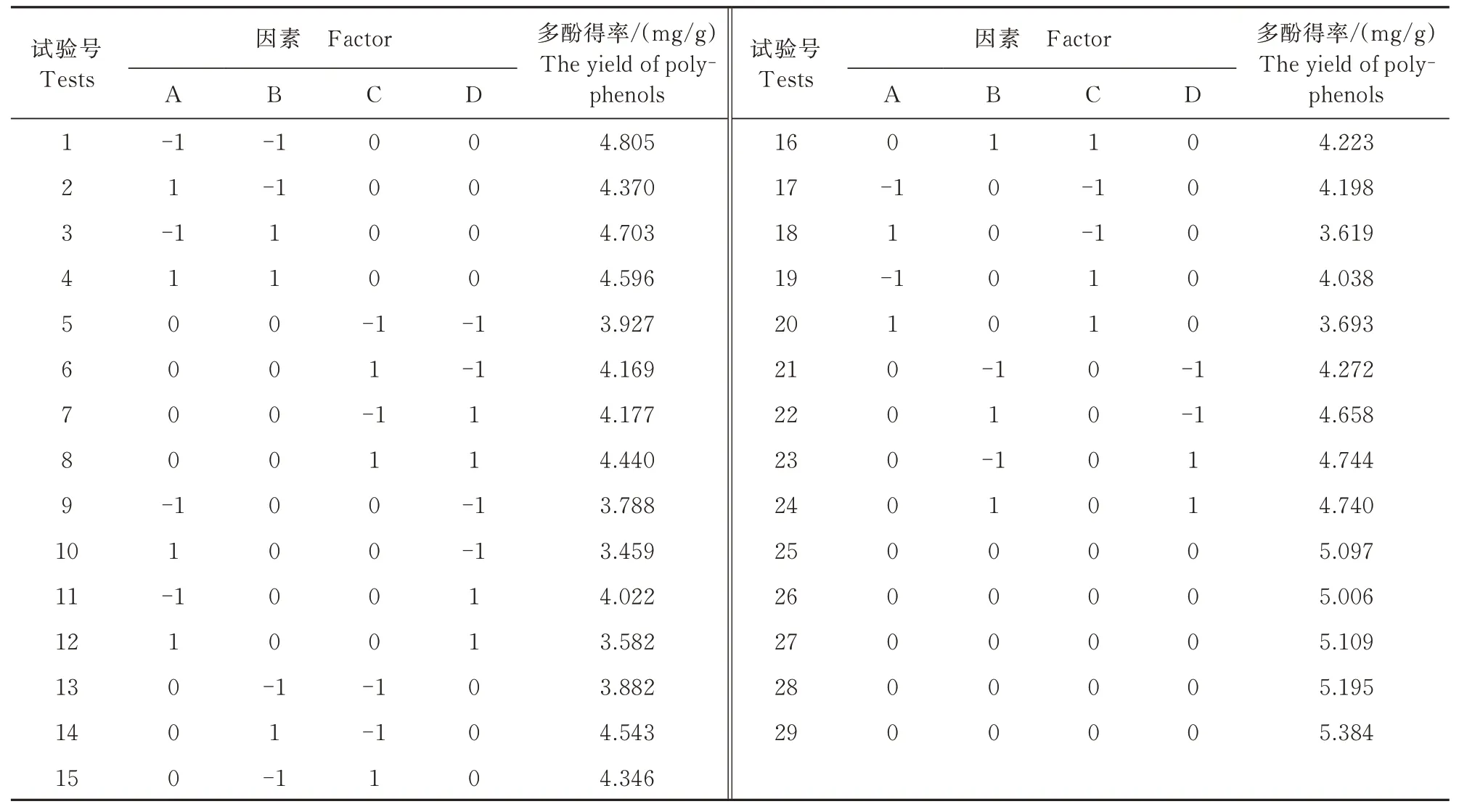
表2 响应面试验设计及结果Tab.2 Response surface test design and results
由表3可知,该回归模型具有极显著性(P<0.01),试验方法可行;失拟误差不显著(P>0.05),表明试验值与拟合方程计算值没有显著差异;R2=0.882 6,表明该模型拟合度良好。模型中A2、C2和D2对枸杞叶多酚得率的影响极显著,A对枸杞叶多酚得率的影响显著。基于F值的大小判断4个因素对枸杞叶多酚得率的影响从高到低排序为:乙醇体积分数(A)>纤维素酶添加量(D)>料液比(B)>超声时间(C)。
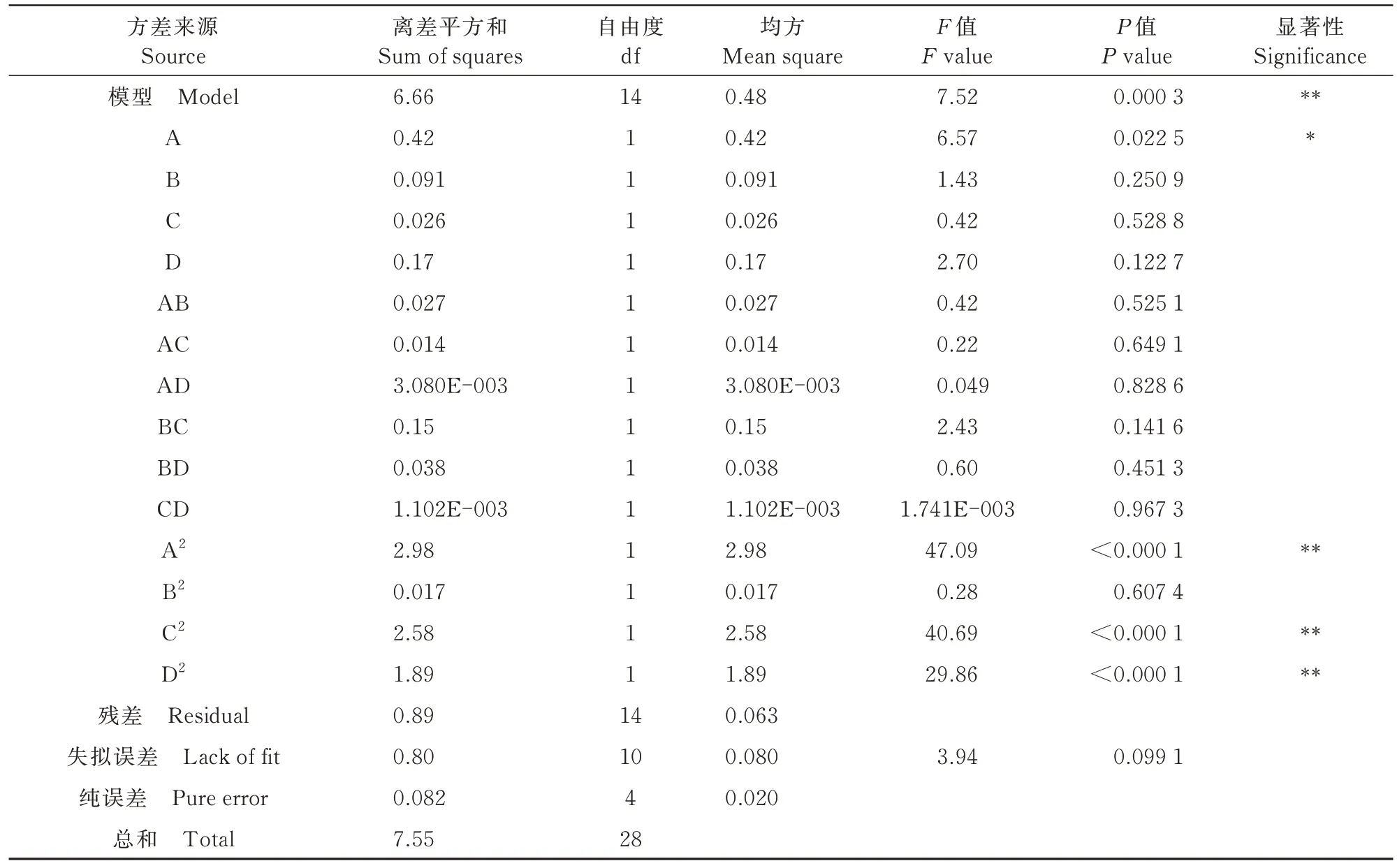
表3 响应面回归模型方差分析Tab.3 Analysis of variance of response surface regression model
2.2.2 响应面交互作用分析 图2~7结果显示,任意2个变量交互作用下,枸杞叶多酚得率呈抛物线形变化趋势(先上升后逐渐下降)。料液比和超声时间对枸杞叶多酚得率的影响曲线更陡,等高线和坐标轴之间形成一定的角度,等高线清晰、紧密集中、排列平均一致,表明二者对多酚得率的协同交互作用相对较大。当超声时间为40 min时,料液比从1∶50(g/mL)增加到1∶70(g/mL),多酚得率从4.3 mg/g提高至5.0 mg/g;在恒定料液比为1∶70(g/mL)时,超声时间从30 min增加到40 min,多酚得率从4.5 mg/g提高至5.0 mg/g。因而,料液比大于超声时间对响应值的影响,这与表3的结果一致。
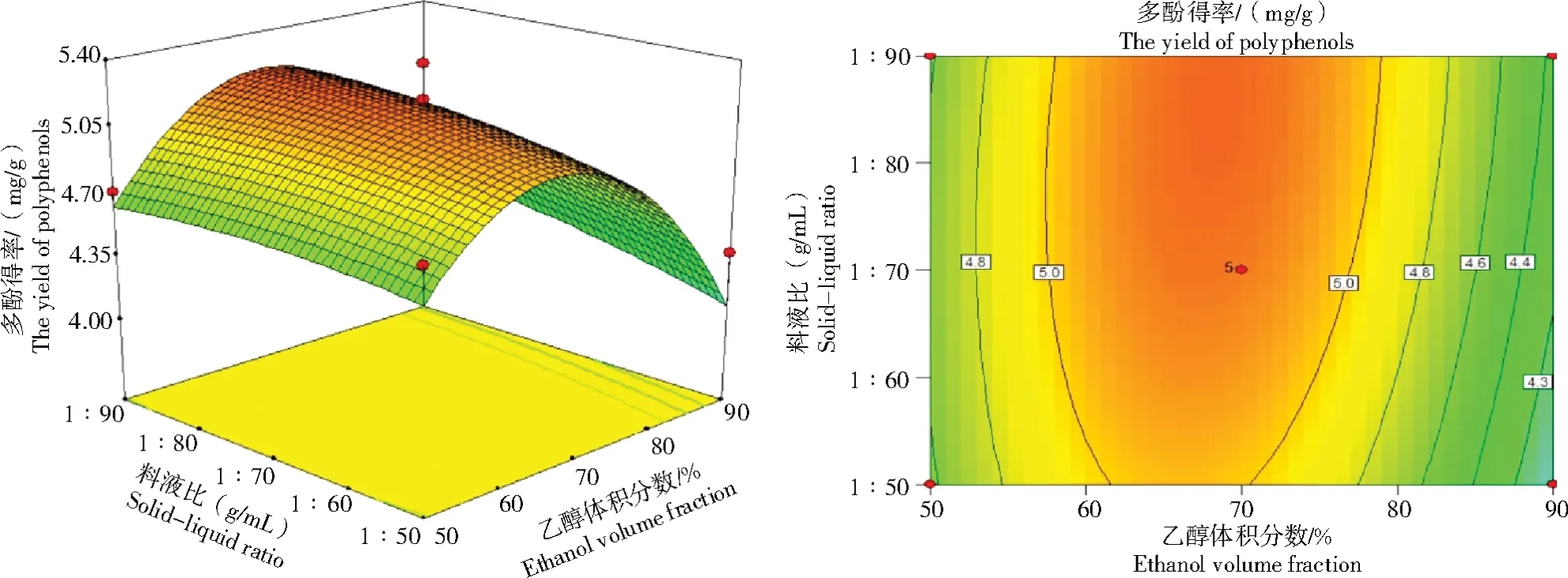
图2 乙醇体积分数和料液比对枸杞叶多酚得率的响应面和等高线Fig.2 Response surface and contour plots of the effects of ethanol volume fraction and solid-liquid ratio on the yield of polyphenols from Lycium barbarum leaves
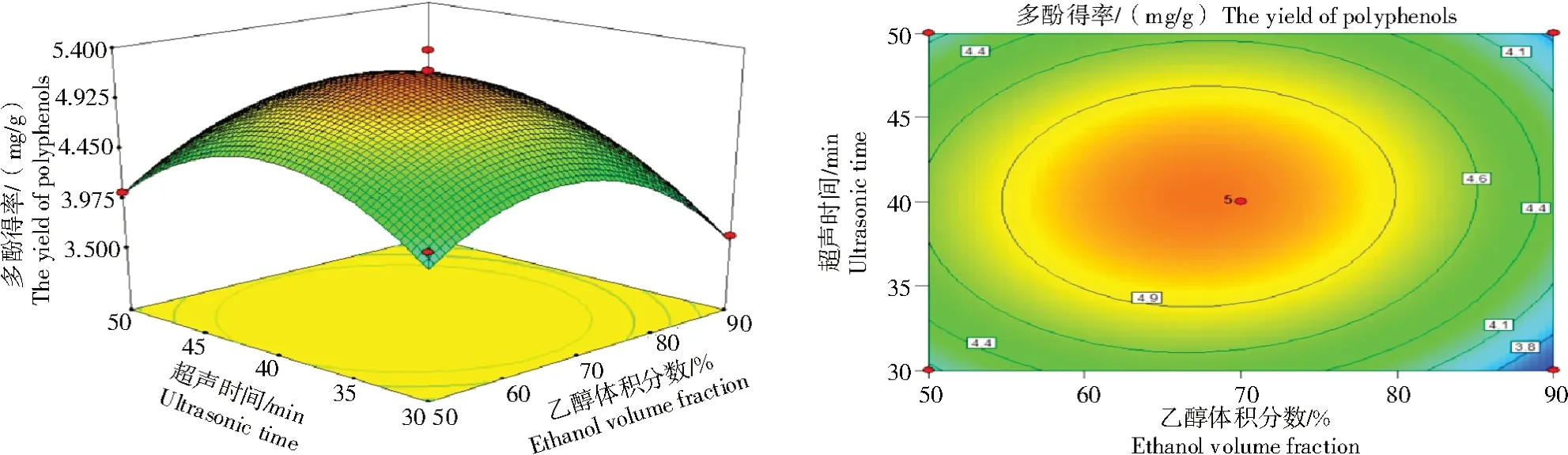
图3 乙醇体积分数和超声时间对枸杞叶多酚得率的响应面和等高线Fig.3 Response surface and contour plots of the effects of ethanol volume fraction and ultrasonic time on the yield of polyphenols from Lycium barbarum leaves
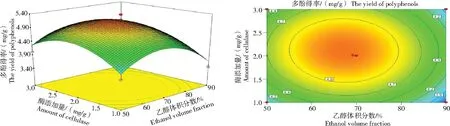
图4 乙醇体积分数和纤维素酶添加量对枸杞叶多酚得率的响应面和等高线Fig.4 Response surface and contour plots of the effects of ethanol volume fraction and amount of cellulase on the yield of polyphenols from Lycium barbarum leaves
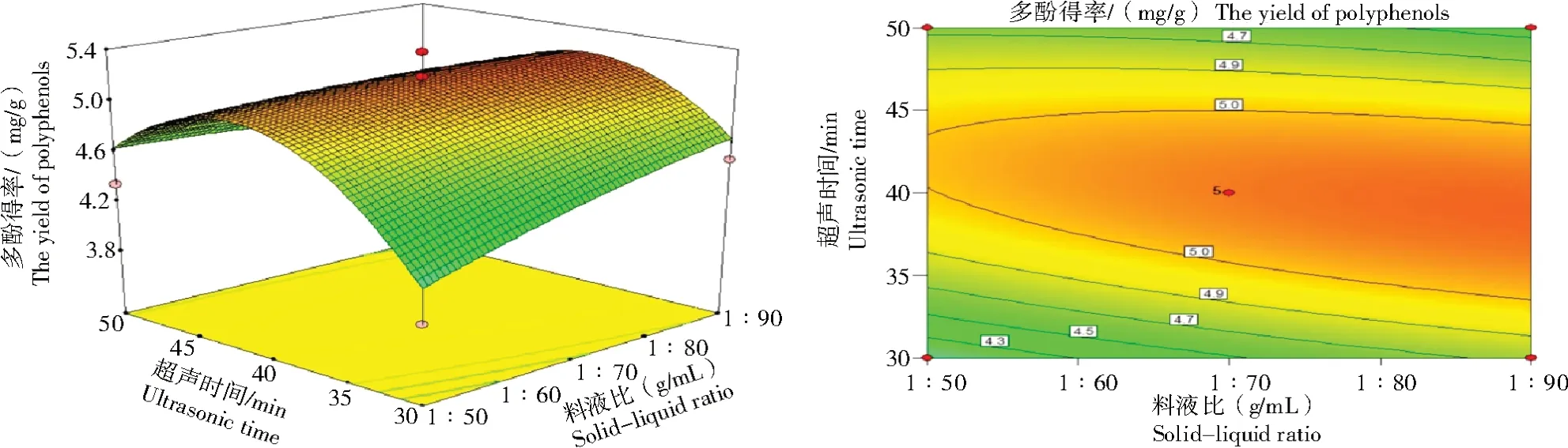
图5 料液比和超声时间对枸杞叶多酚得率的响应面和等高线Fig.5 Response surface and contour plots of the effects of solid-liquid ratio and ultrasonic time on the yield of polyphenols from Lycium barbarum leaves
2.2.3 模型验证 响应面模型优化的最佳提取工艺为:乙醇体积分数68.33%、料液比1∶89.38(g/mL)、超声时间38.83 min、纤维素酶添加量2.02 mg/g。为了便于实际应用,将最佳工艺条件调整为:乙醇体积分数68%、料液比1∶89(g/mL)、超声时间39 min、酶添加量2 mg/g,在此条件下多酚得率为5.09 mg/g,与模型预测值(5.21 mg/g)的相对误差为2.3%,表明模型有效,优化工艺稳定可行。
2.3 枸杞叶多酚提取物抗氧化活性分析
由图8可知,枸杞叶多酚提取物和Vc对DPPH自由基的清除率均随各溶液多酚和Vc质量浓度的增加而升高。枸杞叶多酚提取物和Vc对DPPH自由基清除率IC50值分别为27.28、13.06 μg/mL,虽然枸杞叶多酚提取物对DPPH自由基清除能力略低于阳性对照Vc,与前人对红枸杞叶总多酚提取物对DPPH自由基清除能力相当[14]。而且,随着提取物中多酚质量浓度的升高,枸杞叶多酚提取物和Vc对ABTS自由基的清除能力呈上升趋势(图8),IC50值分别为190、150 μg/mL,二者对ABTS自由基清除能力相近,表明枸杞叶多酚提取物有一定的抗氧化能力。
3 结论与讨论
从食用副产品中获得具有生物活性的酚类化合物并开发成新的可利用产品,是新时代落实大食物观的内在要求。高温水提取酚类化合物的传统方法,由于作用时间长、温度高,造成酚类化合物的大量损失。酶辅助提取法可以对植物细胞壁中的多糖进行水解,打破原有的多糖-木质素网络结构,促进多酚类化合物的释放。但在单一的酶辅助提取法过程中,长时间的处理造成经济成本的增加[29]。超声辅助提取法基于超声波的振动产生并传递较大的能量,可以在液相介质中短时间内通过空化作用分解细胞中的固体基质,加速所需化合物的提取,此过程对产品的生物活性影响很小[30]。因此,超声波辅助酶法具有提取时间短、成本低、效率高、保留酚类物质原始特性等优势。前人研究表明,超声波辅助酶法可以提高香蕉皮中多酚类化合物[31]及葡萄皮中白藜芦醇的提取效率[32]。何若男等[15]基于微波-超声波协同的方法对黑枸杞叶多酚提取得率为6.02 mg/g,略高于本试验的多酚得率,这可能与提取方法、原料种类和采摘季节等有关。
多酚类物质作为天然的抗氧化剂,对维持体内自由基的动态平衡至关重要。枸杞叶多酚提取物的抗氧化能力可能与多酚类物质中羟基的数量、位置以及芳香环的存在有关[33]。周志阳等[34]研究发现,宁夏枸杞芽茶、枸杞叶茶的热水浸提物清除DPPH自由基的IC50值分别为147.63、241.23 μg/mL,且基于各类有机试剂对枸杞芽茶的萃取物清除DPPH自由基能力[5]均低于本试验枸杞叶多酚提取物对DPPH自由基的清除能力(IC50为27.28 μg/mL),可能与本研究采用超声波辅助酶法的提取工艺有关。
基于超声波辅助酶法,采用响应面分析得到枸杞叶中多酚提取的最优参数∶乙醇体积分数68%、料液比1∶89(g/mL)、超声时间39 min、纤维素酶添加量2 mg/g,此时枸杞叶提取液中多酚含量为5.09 mg/g,与预测值(5.21 mg/g)的相对误差为2.3%。抗氧化试验结果表明,枸杞叶多酚具有较好的抗氧化活性,对DPPH和ABTS自由基的清除率随着提取物中多酚质量浓度的增加而升高,IC50值分别为27.28、190 μg/mL,为枸杞叶中多酚化合物的深入开发利用提供参考基础。

