组合性抗体在分流ASC-US病变中的应用价值*
王 侠,杨 翠
(皖西卫生职业学院,安徽 六安 237000)
宫颈癌为女性常见的生殖系统恶性肿瘤,40~50岁为高发年龄[1-2]。宫颈癌患者发病基数大且死亡率高,早期诊断及早期治疗在宫颈癌诊治中具有重要意义[3]。临床上筛查宫颈癌多采用宫颈液基细胞学检查,但对意义不明确的非典型鳞状细胞(Atypical squamous cells of undetermined significance,ASC-US)存在诊断敏感度低等缺点[4-5]。ASC-US可能发展为宫颈上皮内瘤变或宫颈癌,故高效准确的检测方式对ASC-US患者进行合理的分流管理具有重要意义[6]。本研究分析组合性抗体P16/SOX-2与P16/Ki-67在分流ASC-US病变中的应用价值,报道如下。
1 资料与方法
1.1 纳入及排除标准
纳入标准:患者已婚且为非妊娠妇女;患者不存在内科免疫系统疾病且未使用相关药物;患者无全子宫切除史、无化疗以及盆腔放疗史;患者临床随访资料完整。排除标准:进行过宫颈手术的患者;曾患有宫颈癌和阴道癌、等病史的患者;存在近期急性泌尿及生殖道感染者或者有阴道用药者;在近1年服用免疫抑制剂或处于免疫抑制状态者;处于妊娠阶段的妇女。
1.2 一般资料
收集2018年9月至2020年10月于我院妇科门诊进行筛查的2250例女性患者中获得240例完整的宫颈脱落细胞样本,患者年龄为21~78岁。240例样本均经过TCT检测确诊为ASC-US。经过HR-HPV与TCT检测进行检测:所有筛查妇女均由医师放置窥器暴露子宫颈,采集子宫颈脱落细胞标本,保存并进行Cobas-HPV检测和TCT检查。Cobas-HPV检测能够提供HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68型结果。TCT检查结果判定:按照子Bethesda分类系统(TBS)的标准将240例样本分为LSIL组(n=138)和HSIL组(n=102)。本研究经单位伦理委员会审批批准。
1.3 方法
1.3.1 HR-HPV检测
通过专用取样刷采集各组患者的宫颈分泌物,依据PCR反向点杂交技术集合HPV试剂盒检测HR-HPV DNA 16、18、31、33、35、39、45、51、53、56、58、59、66、68等14种,存在1种HR-HPV阳性即判断为阳性[7]。
1.3.2 免疫组化的方法检测联合抗体P16/SOX-2和结果判定
采用罗氏全自动免疫组化分析仪,取宫颈上皮内病变的病理组织标本,组织标本经过制片、固定、染色、晾干、封片后做显微镜下观察。P16阳性的细胞质呈现棕黄色,SOX-2阳性表现为细胞核为棕黄色[8]。评分标准:(1)阳性率评分:以5个高倍视野(×200)观察组织切片,平均每高倍视野阳性细胞数占观察总细胞数的百分比。细胞阳性率<5%记为0分;细胞阳性率为5%~25%记为1分;细胞阳性率为26%~50%记为2分;细胞阳性率为51%~75%记为3分;细胞阳性率为76%~100%记为4分。(2)染色强度评分:无色为0分;淡黄色为1分;棕黄色为2分;棕褐色为3分。细胞阳性率与染色强度评分相乘,则阴性为0分(-),弱阳性为1~4分(+);阳性为5~12分(++)。
1.3.3 免疫组化的方法检测P16/Ki-67双染抗体和结果判定
各组患者宫颈上皮内病变的病理组织标本做P16/Ki-67双染[9]。分级标准:视野为单个细胞染色且双染阳性细胞数量<5%的记为阴性(-);视野为散在的或者小的细胞团染色且双染阳性细胞数量为5%~24%的记为弱阳性(+);视野为片状或簇状细胞染色且双染阳性细胞数量为25%~50%的记为阳性(++)。
1.3.4 阴道镜检查及宫颈活检
由专职阴道镜医师通过电子阴道镜观察患者阴道情况,采用醋酸白试验和碘试验进行组织活检,病理报告方式:LSIL组、HSIL组[10]。
1.3.5 HPV E6/E7测定
根据HPV E6/E7 mRNA试剂盒操作说明,采用QuantiVirus TM冷光仪进行检测,通过电脑软件换算为mRNA拷贝数,当HPV E6/E7 mRNA拷贝数<1copy/mL时判断为HPV E6/E7阴性,≥1copy/mL判断为HPV E6/E7阳性[11]。
1.4 观测指标
与阴道镜宫颈活检的金标准比较,检测P16/SOX-2、P16/Ki-67诊断ASC敏感度及特异度,敏感度=真阳性/(真阳性+假阴性)×100%,特异度=真阴性/(假阳性+真阴性)×100%。
1.5 统计学方法
2 结 果
2.1 P16/SOX-2联合抗体在ASC-US中的表达
LSIL组和HSIL组患者组织中P16/SOX-2联合表达阳性率均显著高于组内P16表达、SOX-2表达阳性率(LSIL组81.88%比45.65%、31.88%;HSIL组90.20%比78.43%、76.47%),差异有统计学意义(P<0.05,图1、表1)。
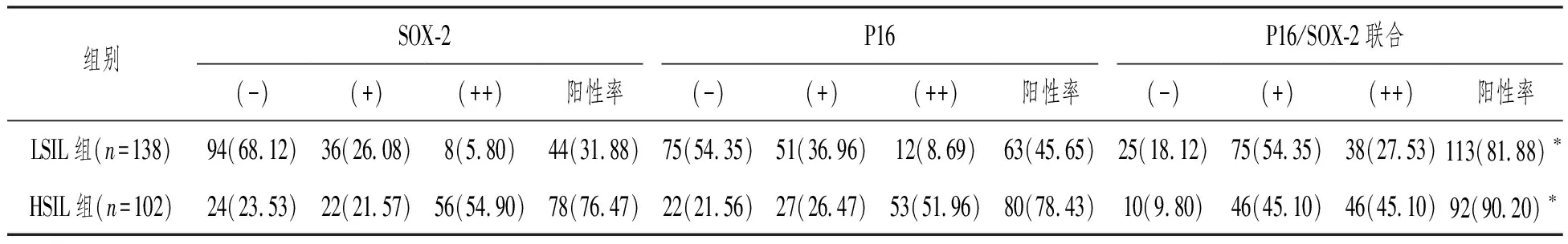
表1 P16/SOX-2联合抗体在ASC-US的病例组织中的表达[n(%)]
2.2 P16/Ki-67在ASC-US中的表达
LSIL组和HSIL组患者组织中P16/Ki-67联合阳性率均显著高于组内Ki-67、P16阳性率(LSIL组90.58%比55.07%、45.65%,HSIL组95.10%比76.47%、78.43%),差异有统计学意义(P<0.05,图2、表2)

表2 P16/Ki-67在ASC-US的病例组织中的表达[n(%)]
2.3 HPV E6/E7 mRNA、P16/SOX-2和P16/Ki-67在ASC-US中的表达
LSIL组HPV E6/E7 mRNA阳性率均低于组内P16/Ki-67阳性率(79.71%比90.58%),HSIL组患者组织中HPV E6/E7阳性率均低于组内P16/SOX-2和P16/Ki-67阳性率(HSIL组73.53%比90.20%、95.10%),差异有统计学意义(P<0.05,表3)。

表3 HPV E6/E7、P16/SOX-2和P16/Ki-67在ASC-US的病例组织中的表达对比分析[n(%)]
2.4 P16/SOX-2及P16/Ki-67诊断ASC敏感度及特异度
本组240例ASC-US患者经金标准宫颈活检病理组织学诊断ASC(阳性)206例、正常(阴性)34例。SOX-2/P16诊断ASC-US敏感度为92.2%,特异度为55.9%;SOX-2/P16诊断ASC-US敏感度为96.1%,特异度为29.4%。见表4。
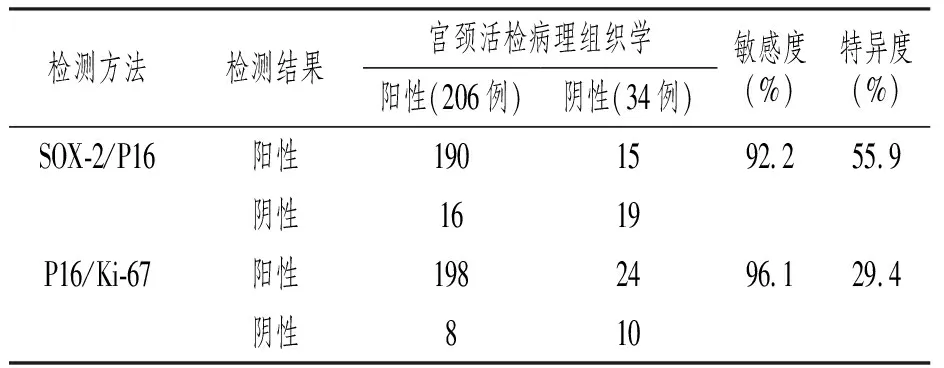
表4 P16/SOX-2及P16/Ki-67诊断ASC敏感度及特异度
3 讨 论
宫颈癌发病率呈逐年上升趋势,且发病年龄越来越年轻化,在妇产科生殖系统肿瘤中占比最高[12]。ASC-US病变依赖于传统的阴道镜宫颈活检,但其容易受到检测者主观因素及检测取材的干扰而影响到分级分流,导致病情的诊断和治疗困难增大[13]。临床上为提高ASC-US病变诊断结果的可靠性、可重复性以及准确性,提倡采用特异性强的组合性抗体来提高诊断的敏感度及特异度,常用P16/SOX-2和P16/Ki-67等多种组合[14]。本研究以阴道镜宫颈活检为对照,分析P16/SOX-2联合抗体及P16/Ki-67双染抗体是否能有效分流ASC-US病变,结果发现,HPV E6/E7检测阳性率低于P16/SOX-2和P16/Ki-67组合性抗体检测阳性率(P<0.05),SOX-2/P16和P16/Ki-67组合性抗体在诊断ASC中具有极高的敏感度及特异度,值得在临床上推广。
宫颈癌的发病机制尚未完全明确,研究发现其与多种癌基因密切相关,其中P16作为一种抑癌基因,该基因能够直接作用于癌细胞的周期,起到抑制癌细胞分裂的作用[15-16]。正常细胞内P16蛋白水平较低,但是在ASC-US病变患者细胞中,P16的表达水平相对较高,引起细胞周期的调节发生紊乱,细胞表现出无限的增殖;Ki67作为肿瘤细胞增殖性标志物,其表达水平与肿瘤细胞活跃程度相关[17-18];SOX-2可调控细胞周期及DNA损伤修复等。研究表明,ASC-US与宫颈癌病变程度与SOX-2表达密切相关,且阳性表达率可能与ASC-US病变细胞的分化程度有关,常用于监测病情进展[19-20]。因此,P16/SOX-2和P16/Ki-67组合性抗体在分流ASC-US病变中具有较高的应用价值。本研究中,ASC-US中P16/SOX-2和P16/Ki-67表达阳性率较高,证实SOX-2、P16和Ki-67与宫颈癌发病机制的相关性。
综上所述,组合性抗体检测在ASC-US诊断及鉴别诊断中具有重要价值,可作为ASC-US分流的有效指标。值得注意的是,本研究为单中心研究且临床病例较少,组合性抗体检测在ASC-US诊断及鉴别诊断及分流中的价值有待于进一步研究证实。

