健肝散体外对拉米夫定耐药株病毒表达抑制及增敏作用的研究
李 堃,葛 飞,孙茂秋,严展鹏,仲 婕,季 瑜,朱方石
(1.海安市中医院脾胃病科,江苏 海安 226600;2.江苏省中医药研究院中西医结合临床研究室,江苏 南京 210046)
慢性乙型病毒性肝炎(Chronic hepatitis B,CHB)是感染乙肝病毒(Hepatitis B,HBV)后形成的慢性肝炎,是严重影响人类健康的慢性传染性疾病,迁延不愈会导致肝纤维化、肝硬化[1],抗病毒是治疗CHB最有效的治疗方法,而核苷(酸)类似物[Nucleos(t)ide analogues,NAs]被认为是首选抗病毒药物,然而在长期临床实践中NAs耐药是一直存在且难以避免的棘手问题。健肝散(Jiangan powder,JGP)为海安市中医院院内制剂,临床用于肝郁脾虚型慢性肝病尤其是CHB的治疗,收效显著,临床实践中我们观察到JGP在缓解肝功能、降低抗病毒药物耐药方面具有一定优势。课题组前期相关临床研究发现健肝散对拉米夫定(Lamivudine,LMV)诱发的乙型肝炎病毒酪氨酸-蛋氨酸-天冬氨酸-天冬氨酸(YMDD)变异起到显著抑制作用[2]。本研究以JGP含药血清干预稳定表达HBV病毒的人肝癌细胞——HepG2.2.15细胞构建的LMV耐药株细胞模型,观察其对耐药株对LMV作用敏感性及病毒表达水平的影响,验证JGP体外对LMV耐药的抑制、增敏作用。
1 材料与方法
1.1 实验材料
1.1.1 动物及细胞株:雄性SD大鼠,体重200 g左右,空调下架式笼养,环境适宜,正常饲养1周;HepG2.2.15细胞株(赛百慷)。
1.1.2 实验试剂:引物(擎科生物),氯仿(天津市风船化学试剂科技有限公司),无RNase水(Biteke Gorporation),DEPC(美国AMRESCO公司),TRIzol Reagent(Ambion),SweScript-First-strand-cDNA-Synthesis-kit(Servicebio,MPC2210019),2×Universal Blue SYBR Green qPCR Master Mix(Servicebio,MPC2208017),胎牛血清(Gibco公司),100×青霉素-链霉素溶液(上海生工生物工程有限公司),PBS(Solarbio公司),胰酶(Invitrogen公司),MEM培养基(美伦生物),DMSO(Solarbio),人乙型肝炎E抗原(HBeAg)ELISA检测试剂盒(上海酶研生物科技有限公司,EK-H12435),人乙型肝炎S抗原(HBsAg)ELISA检测试剂盒(上海酶研生物科技有限公司,EK-H12030),血球计数板(美国Hausser Scientific公司),0.2 ml/1.5 ml EP管(Axygen公司),拉米夫定(IL0020)(Solarbio)。
1.1.3 主要仪器:高速低温离心机(安徽中科中佳科学仪器有限公司),电子分析天平(天津精科天平厂),高速离心机(德国Eppendorf公司),2720 Thermal Cycler 普通PCR仪(Applied Biosystems),CFX96实时定量荧光PCR仪(Bio-Rad),冷冻高速离心机(Thermo公司),掌上瞬时离心机(大龙DragonLab),涡旋振荡器(大龙DragonLab),微量加样器(德国eppendorf公司),酶标检测仪(BioTeK),96孔板离心机(LABGIC),CO2培养箱(美国Thermo公司),低速离心机(安徽中科中佳科学仪器有限公司),倒置显微镜(Motic公司)。
1.2 实验方法
1.2.1 HepG2.2.15细胞的培养:细胞用含有胎牛血清的MEM完全培养基置于37 ℃、5% CO2的培养箱中培养,每3天换液,约铺满T-25培养瓶底70%~80%以1∶3传代。
1.2.2 健肝散含药血清制备:健肝散含药血清制备根据“人和动物间体表面积折算等效剂量比值表”:70 kg人与200 g大鼠的等效计量比为56.0,正常成年人服用中药复方JGP每日生药量120 g,计算后大鼠生药用量为10.71 g/(kg·d),设置JGP煎药剂量组按照10.71 g/(kg·d)灌胃SD大鼠,每天2次,连续灌胃7 d后于胸左侧第3~4肋间,心搏最强处穿刺取血,离心收集血清并灭活,用0.22 μm微孔滤器获得含药血清-20 ℃保存。
1.2.3 CCK8检测JGP含药血清对HepG2.2.15细胞增殖的影响:细胞复苏及传代同1.2.1。取对数生长期HepG2.2.15细胞的敏感株进行胰蛋白酶消化计数,分别用0%、5%、10%、20%、30%、50%、70%、80%、100% JGP含药血清的完全培养基进行稀释并做好标记,并转移细胞悬液到96孔板中,每孔细胞数目相同,设置时间梯度24、48 h。细胞贴壁后24 h及48 h随机取板(0%、5%、10%、20%、30%、50%、70%、80%、100%各1块),向细胞培养基中添加10 μl CCK-8试剂并进行孵育2.5 h后,测定细胞培养液450 nm处的OD读数,并记录数据,每组重复5次,用Graph Pad Prism软件绘制图表。
1.2.4 LMV耐药细胞株构建:采用药物浓度递增法,取对数生长期HepG2.2.15细胞(汇合度60%~80%),加入起始浓度为5 μg/ml的LMV作用24 h,弃去培养液,PBS清洗2遍,更换不含LMV的培养液,待细胞生长后,消化细胞传代,再以5 μg/ml的药物浓度培养,如此重复3次药物冲击;待细胞稳定生长后,逐渐增加药物浓度,每个浓度重复3次冲击培养,如此持续耐药大约2个月,直到细胞能够稳定生长。最终得到可在高浓度的含药培养基中正常生长的HepG2.2.15细胞,即HepG2.2.15/LMV细胞。
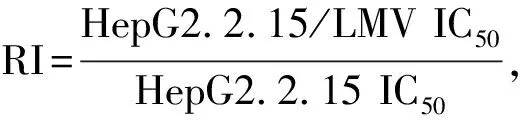
1.2.6 JGP含药血清对HepG2.2.15耐药株耐药的影响:取对数生长期HepG2.2.15细胞耐药株进行胰蛋白酶消化计数,实验分为两个组:正常大鼠血清组用含有30%正常大鼠血清以及0、5、10、20、30、50、80、100 μg/ml LMV完全培养基进行稀释,JGP含药血清组用含有30% JGP含药血清及0、5、10、20、30、50、80、100 μg/ml LMV完全培养基进行稀释,分别转移细胞悬液到96孔板中,每孔细胞数目相同,每组3个复孔。同1.2.5 CCK8法检测并计算IC50值,统计分析。
1.2.7 荧光定量PCR检测HBV-pgRNA表达水平:分别为HepG2.2.15耐药株+正常大鼠血清组和HepG2.2.15耐药株+JGP含药血清组两组。取对数生长的细胞,待细胞培养至80%以上融合后接种于6孔板中,每组3个复孔。用TRIzol提取总RNA,检测RNA浓度,应用RT-PCR方法测定HBV-pgRNA表达水平,按照逆转录试剂盒说明配制体系,使RNA逆转录为cDNA,反应参数分别为:25 ℃,5 min;50 ℃,15 min;85 ℃,5 s;4 ℃,hold;再按下列条件在CFX96实时定量荧光PCR仪进行40个循环的反应:预变性95℃,1 min;变性95 ℃,20 s;退火55 ℃,20 s;延伸72 ℃,30 s。采集记录荧光,制作扩增曲线和溶解曲线,读取Ct值。获得RNA产物后检测RNA浓度,设置如表1。引物信息见表2。

表1 RNA检测浓度设置
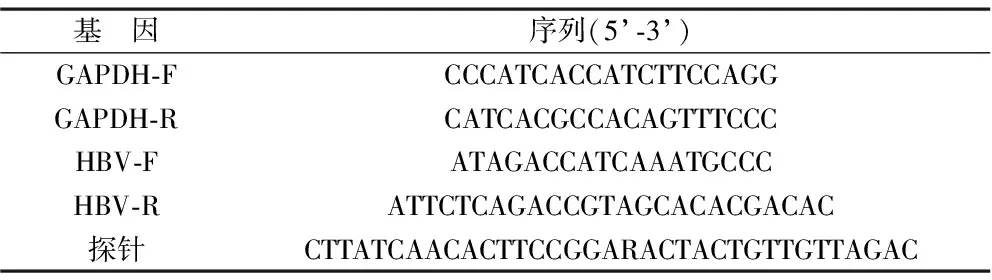
表2 引物信息
1.2.8 ELISA检测上清HBsAg和HBeAg的表达水平:分组同1.2.7。取对数生长细胞,按5×105个/ml浓度分别接种于6孔板细胞培养板中(1 ml/孔)。分组给药,每组6个复孔,24 h后取上清液,采用ELISA法测定HBsAg和HBeAg含量,于450 nm处测定吸光度,根据标准曲线在回归方程上计算出对应的样品浓度。
1.3 统计学方法 采用SPSS 26.0统计学软件进行数据分析。计量资料以均数±标准差表示,组间两两比较采用t检验,两组以上的差异比较采用单因素方差分析;P<0.05为差异有统计学意义。
2 结 果
2.1 HepG2.2.15的培养 通过细胞培养,倒置显微镜观察到细胞于接种后24 h贴壁,呈岛壮聚集生长,状态良好,可继续后续实验(图1)。
图1 HepG2.2.15细胞图片(×100)
2.2 CCK8检测JGP含药血清对HepG2.2.15细胞增殖的影响 CCK8实验检测JGP含药血清作用24 h和48 h对HepG2.2.15细胞活力的影响,24 h/48 h时,与空白组相比,随着含药血清浓度的增加,HepG2.2.15细胞活力逐渐下降。当JGP含药血清的浓度增加到30%时,HepG2.2.15细胞的存活率下降50%左右,因此后续实验JGP含药血清选择30%的浓度(图2)。
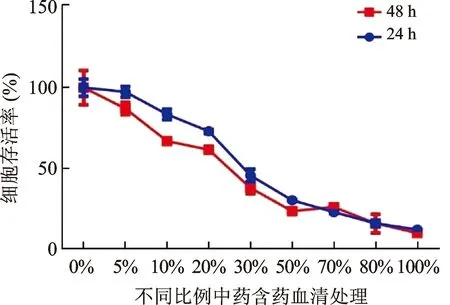
图2 CCK8检测含药血清对HepG2.2.15细胞增殖的影响
2.3 LMV耐药细胞株构建 从HepG2.2.15细胞与HepG2.2.15 LMV耐药细胞株的细胞培养图片可以看出,细胞生长状态良好。可以直接进行下一步检测(图3)。
图3 HepG2.2.15 LMV耐药细胞株构建(×100)
2.4 检测HepG2.2.15耐药前后IC50值变化验证耐药株的构建情况 CCK8实验检测HepG2.2.15细胞敏感株和耐药株对LMV的IC50值,结果如图4所示,敏感株IC50值为12.35,耐药株的IC50值为67.66,RI值(67.66/12.35)>5,表明耐药株构建成功。
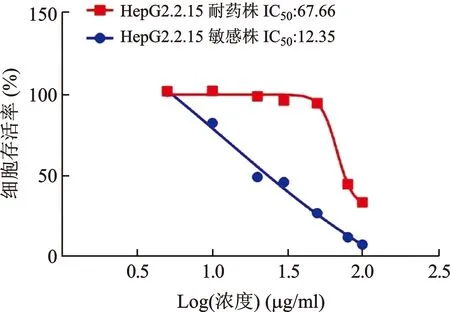
图4 CCK8检测HepG2.2.15细胞敏感株和耐药株对LMV的IC50值
2.5 JGP含药血清对HepG2.2.15耐药株IC50值的影响 HepG2.2.15细胞耐药株添加JGP含药血清的IC50值为19.31,而HepG2.2.15细胞耐药株添加正常大鼠血清的IC50值为67.50,表明JGP含药血清可增加HepG2.2.15细胞耐药株对LMV的敏感性(图5)。
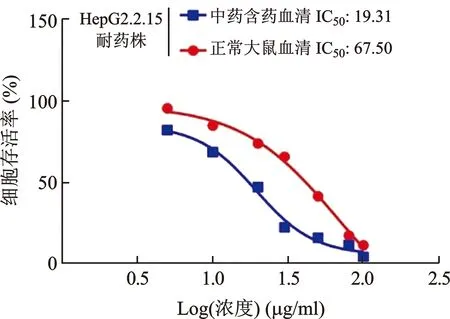
图5 JGP含药血清对HepG2.2.15耐药株IC50值的影响
2.6 RT-PCR检测HBV-pgRNA的表达水平 与HepG2.2.15/LMV耐药细胞株添加正常血清组相比,HepG2.2.15/LMV耐药细胞株添加JGP含药血清组的HBV-pgRNA的表达水平显著降低,表明JGP含药血清可抑制HepG2.2.15/LMV耐药细胞株HBV-pgRNA的表达(图6)。
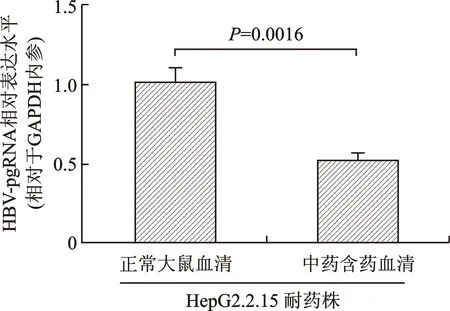
图6 RT-PCR检测HBV-pgRNA的表达水平
2.7 ELISA检测血清HBsAg和HBeAg 与HepG2.2.15/LMV耐药细胞株添加正常血清组相比,HepG2.2.15/LMV耐药细胞株添加JGP含药血清组培养上清中HBsAg和HBeAg的蛋白水平均极显著降低,表明JGP含药血清可抑制HepG2.2.15/LMV耐药细胞株HBsAg和HBeAg的蛋白表达。见表3。
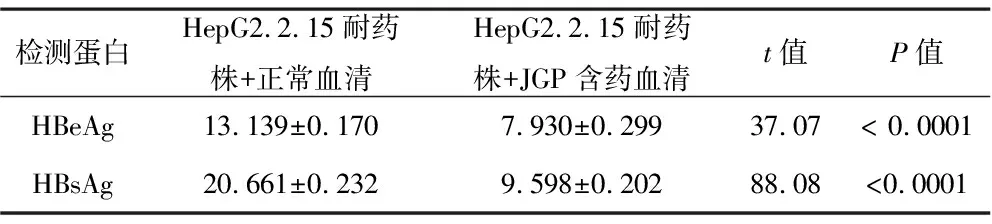
表3 两组细胞上清中HBsAg和HBeAg的表达水平(ng/ml)
3 讨 论
NAs的耐药贯穿用药的整个过程,从开始使用NA就产生了变异毒株及相应变异的cccDNA,随着治疗的进行,野生毒株逐渐被耐药变异株取代,变为劣势株,而这其中通常经历了基因型耐药(即变异株复制低于野生株,血清病毒复制正常)、表现型耐药(另一位点发生了补偿变异而恢复其复制活性,变异株数量迅速复增多而发生病毒突变、甚至反弹)、临床耐药(病毒数量增高到一定程度,肝炎复发)[3]。目前直接作用于HBV和作用于宿主的治愈性药物仍没有进入Ⅲ期临床研究[3]。
NAs的耐药现象一直存在,目前难以完全抑制。同样作为L-核苷类的ETV有很高的耐药屏障,但对LMVr交叉耐药,甚至ETVr也依赖YMDD的变异;有学者[4-6]研究发现包括ETV、TDF在内的NAs仍存在联合耐药位点变异情况,且认为NAs并不能完全清除cccDNA和整合的HBV-DNA,随着慢性乙型肝炎NAs治疗的日益普及,抗病毒药物不断更迭、用药方案组合多元化,耐药位点将呈现更加复杂的变化,多位点变异和多药耐药的情况有增加趋势,HBV耐药变异株概率也将逐渐增加,治疗获益需被重新评估。
LMV的耐药株(LMVr)主要是YMDD基序变异,rtC区YMDD基序204位点的甲硫氨酸被缬氨酸或异亮氨酸所替代(rtM204V/I),LMV的基因耐药率每年以14%~32%递增[3];针对CHB对NAs耐药情况,指南也提出建议更换为强效低耐药药物如恩替卡韦(ETV)、替诺福韦酯(TDF)、富马酸丙酚替诺福韦(TAF),但仍需密切监测,代价高昂,长期服用可能存在肾脏和骨密度损害等风险。相较其他抗病毒药物而言,患者远期临床结局差异、疗效及安全性仍待观察。
针对NA耐药,指南推荐了挽救措施,需定期监测,仍然存在多重、交叉耐药可能,一定程度上可降低耐药的几率,但仍难从根本上解决NAs耐药问题。目前尚未有药物可以提高对NA耐药株的敏感性,以抑制变异株。新近有研究尝试对NAs进行结构修饰,在抗HBV活性研究中,化合物3-29似乎表现出一定抑制HBV-DNA复制、保护肝功能、改善肝脏炎症等效用,但缺乏药物代谢动力学等研究,尚未成药[7]。曾有报道认为HAP类化合物单独或者与ADV联用,可一定程度上解决耐药问题[8],却仅停留于实验,未有抗LMV耐药的专用药物面世。中医药在乙肝的治疗上具有抑制病毒复制、免疫调节等独特优势[9-10],而对于中医药干预NA耐药的相关研究相对较少。
健肝散组方药物有效成分大多被证实具有抗病毒效应。氧化苦参碱 (Oxymatrine,OMT)联合胸腺肽可以通过促进IFN-α表达而抑制HepG2.2.15细胞分泌HBsAg、HBeAg及HBV-DNA复制[11],此外,作为生物碱代表,其抗病毒机制有学者认为与激活先天免疫,并诱导产生CD4+T细胞中γ干扰素(Interferon-γ,IFN-γ)相关[12]。相关研究发现从茵陈提取液中得到的柚皮苷A和丹参活性成分丹参素、紫草酸也可以显著抑制HepG2.2.15细胞分泌HBsAg、HBeAg及HBV-DNA的复制[13-16]。柴胡皂苷C能显著抑制转染HepG2.2.15细胞HBV-DNA的复制和RNA水平[17],其对HBeAg的分泌和HBV-DNA表达的抑制作用也较为显著[18]。课题组前期研究发现健肝散可对LMV诱发的乙型肝炎病毒YMDD变异现象起到明显的抑制作用。在所有患者治疗前血清标本中,均未发现YMDD变异。治疗组HBV-DNA转阴率为86.54%,对照组为73.08%,治疗组优于对照组,差异有统计学意义。
本研究采用CCK8作用后检测IC50值的方法衡量细胞株对药物的敏感性。IC50是指被测量的药物的半抑制浓度。它能指示该药物在抑制某些生物程序的半量。IC50值可以用来衡量HepG2.2.15细胞对LMV的耐受程度,即对LMV的敏感性。
HBV-pgRNA是3.5 kb大小的乙肝病毒前基因组RNA,作为新型HBV感染血清标志物,是病毒DNA及蛋白质合成模板[19],能够反映感染肝细胞内cccDNA的存在和转录活性,与检测HBV DNA一样,检测上清中HBV-pgRNA表达水平能够反映HBV病毒的感染情况,是较好的临床诊断、预后标志物[20]。

