富含GABA的豆豉前发酵制备工艺及成分分析
刘一静,余科金,狄飞达,张驰松*,冯骏,方秋野
(1.成都市农林科学院,成都 611130;2.成都医学院,成都 610500)
γ-氨基丁酸(GABA)是一种广泛存在于动植物体内的四碳非蛋白质天然氨基酸,主要由谷氨酸(Glu)经谷氨酸脱羧酶(GAD,EC4.1.1.15)脱羧产生,是哺乳动物抑制性神经递质[1],能够参与多种代谢[2],起到免疫调节的作用[3]。具有降血压[4]、调节心血管疾病[5-6]、活化肝功能、改善脂质代谢[7]、预防肥胖的功能[8]。研究表明,随着年龄的增长以及外部环境压力的增加,人体内的GABA含量会逐渐减少,因此在饮食中GABA的补充非常重要[9]。GABA的味道类似于谷氨酸的甜味,添加在食品中能够增强食品的风味并具有醒酒、消臭等作用。在日本,以GABA为功能性营养因子的食品已经产业化,且已形成数百亿日元的巨大市场规模[10]。近年来,GABA作为食品中一种新型的功能性成分[11],受到了人们的普遍关注。我国对富集GABA的豆制品和谷物类的研究也逐渐增多,曹晶晶[12]对发芽糙米进行了研究,发现随着发芽时间的延长,GAD活性呈先升高后降低的趋势:在发芽0~48 h内,GABA的含量增加了6倍以上;在48~60 h之间,GABA含量的增加不明显;可以看出GABA含量受到GAD的调控。刘畅[13]的研究表明,对大豆采取不同的处理方式,GABA的含量也不尽相同,其中最重要的因素为发芽温度和发芽时间,GABA的最大含量可达到11.62 mg/g。申迎宾等[14]对5种不同豆类GABA富集的研究表明,在相同处理条件下,萌芽豇豆中GABA含量最高,达到131.36 mg/100 g,又通过响应面试验确定了豇豆的最佳发芽工艺参数,在浸泡温度34 ℃、浸泡时间25 h、发芽温度33 ℃和发芽时间24 h的条件下,豇豆中GABA含量达到203.53 mg/100 g,是未发芽豇豆中GABA含量的7.48倍。
豆豉是百姓生活中经常出现的一种发酵豆制品,主要是通过微生物发酵,在保留大豆中大部分营养物质的条件下,将大豆中的大分子物质经过分解或者重组变成利于人体吸收的小分子物质,这些小分子物质多具有抗氧化活性和其他功能特性,如预防心血管疾病、抗氧化、抗癌等生理功能[2]。
本研究在将大豆进行豆豉前发酵的过程中富集GABA,观察在整个过程中GABA的变化。通过优化富集工艺开发出具有高GABA含量且具有功能性的豆豉,为将来功能性豆豉的开发提供了参考。
1 材料和设备
东升一号大豆:黑龙江乡土农业科技开发有限公司;豆豉发酵剂:安琪酵母股份有限公司;GABA(纯度>99%):上海源叶生物科技有限公司;甲醇(色谱纯)、乙腈(色谱纯)、三氯乙酸(分析纯)、乙酸(分析纯)、盐酸吡哆辛:成都市科隆化学品有限公司;β-疏基乙醇(分析纯):北京瑞泽康生物科技有限公司;四硼酸钠pH标准缓冲溶液:河南标准物质研发中心;次氯酸钙:成都市科龙化工试剂厂。
高效液相色谱仪、Syncronis C18反相色谱柱(4.5 mm×250 mm,5 μm) 美国Thermo公司;精密可编程热风循环烘箱 LEAD-Tech科学仪器有限公司;智能光照培养箱 宁波赛福实验仪器有限公司;生物培养设备 深圳市鼎鑫宜实验设备有限公司。
2 试验方法
2.1 大豆发芽前处理及豆豉前发酵工艺
工艺流程:挑选籽粒饱满无褶皱的大豆→用自来水清洗3次→用体积分数为1%的次氯酸钙浸泡大豆10 min后用蒸馏水再次清洗大豆3次→将清洗好的大豆装入烧杯中,加入蒸馏水浸泡,放入冰箱(4 ℃)中→将浸泡好的大豆装入铁盘中(上下各覆盖3层纱布)放入培养箱中培养(30 ℃、相对湿度80%)发芽→将发芽后的大豆装入烧杯中,放入高压蒸汽灭菌锅中蒸煮(121 ℃、20 min、101 kPa)→将蒸煮后的大豆按照体积分数添加豆豉发酵剂,搅拌均匀装入漏筛→将装入大豆的漏筛放入培养箱中培养(25 ℃、相对湿度80%)→称取大豆测量。
2.2 GABA含量的测定[15-16]
样品前处理:样品粉碎,过60目筛,4 ℃下保存。称取1.5 g豆粉(含水量为80%),加入15 mL质量分数为8%的三氯乙酸,超声波处理50 min后放入离心机中离心10 min(10 000 r/min),取上清液再次离心10 min。之后取出过0.45 μm的水相微孔滤膜,上机检测。
HPLC色谱条件:Syncronis C18反相色谱柱(4.5 mm×250 mm,5 μm);流动相A:25 mmol/L乙酸钠,用4%的乙酸调节pH至5.9;流动相B:纯乙腈。A∶B为90∶10(体积比);流速1 mL/min;进样量10 μL,检测波长332 nm;柱温40 ℃。
GABA标准曲线的绘制:在20~140 mg/dL质量浓度范围内,用配制好的200 mg/dL的标准液配制成20,40,60,80,100,120,140 mg/dL系列质量浓度的标准液,OPA柱前衍生后上机检测,制成标准曲线。用标准物色谱峰的保留时间定性;用外标多点校准法,以峰面积定量。采用外标面积归一化法测得样品含量。
2.3 富含GABA的豆豉前发酵工艺的优化
2.3.1 培养液pH对发芽大豆GABA含量的影响
称取1 000 g大豆用自来水清洗,再用体积分数为1%的次氯酸钙浸泡10 min。用蒸馏水清洗3次,分成5组,依次编号为A:pH 4.5、B:pH 5.0、C:pH 5.5、D:pH 6.0、E:pH 6.5,将它们装入烧杯中放到冰箱(4 ℃)中浸泡24 h,将浸泡好的大豆装入铁盘放入培养箱中进行发芽(30 ℃、相对湿度80%、24 h)。发芽完成后,将发芽的大豆放入高压蒸汽灭菌锅中蒸煮(121 ℃、20 min、101 kPa),按照蒸煮后体积的1%加入豆豉发酵剂混合均匀,将混匀的大豆放入培养箱中培养(25 ℃、相对湿度80%)5 d。分别在浸泡后、发芽后、蒸煮后、前发酵结束4个阶段取样40 g,测大豆中GABA含量。
2.3.2 维生素B6浓度对GABA含量的影响
称取1 000 g大豆用自来水清洗,再用体积分数为1%的次氯酸钙浸泡10 min,用蒸馏水清洗3次,分成5组,依次编号为A:0 mmol/L、B:1 mmol/L、C:2 mmol/L、D:3 mmol/L、E:4 mmol/L,将它们装入烧杯中放到冰箱(4 ℃)中浸泡24 h,将浸泡后的大豆装入铁盘放入培养箱中进行发芽(30 ℃、相对湿度80%、24 h)。发芽完成后,将发芽的大豆放入高压蒸汽灭菌锅中蒸煮(121 ℃、20 min、101 kPa),按照蒸煮后体积的1%加入豆豉发酵剂混合均匀,将混匀的大豆放入培养箱中培养(25 ℃、相对湿度80%)5 d。分别在浸泡后、发芽后、蒸煮后、前发酵结束4个阶段取样40 g,测大豆中GABA含量。
2.3.3 浸泡时间对GABA含量的影响
称取1 000 g大豆用自来水清洗,再用体积分数为1%的次氯酸钙浸泡10 min,用蒸馏水清洗3次,分成5组,依次编号为A:12 h、B:18 h、C:24 h、D:30 h、E:36 h,将它们装入烧杯中放到冰箱(4 ℃)中浸泡,将浸泡后的大豆装入铁盘放入培养箱中进行发芽(30 ℃、相对湿度80%、24 h)。发芽完成后,将发芽的大豆放入高压蒸汽灭菌锅中蒸煮(121 ℃、20 min、101 kPa),按照蒸煮后体积的1%加入豆豉发酵剂混合均匀,将混匀的大豆放入培养箱中培养(25 ℃、相对湿度80%)5 d。分别在浸泡后、发芽后、蒸煮后、前发酵结束4个阶段取样40 g,测大豆中GABA含量。
2.3.4 发芽时间对GABA含量的影响
称取1 000 g大豆用自来水清洗,再用体积分数为1%的次氯酸钙浸泡10 min,用蒸馏水清洗3次并分成5组,依次编号为A:12 h、B:18 h、C:24 h、D:30 h、E:36 h,将它们装入烧杯中放到冰箱(4 ℃)中浸泡24 h,将浸泡后的大豆装入铁盘放入培养箱中进行发芽(30 ℃、相对湿度80%)。发芽完成后,将发芽的大豆放入高压蒸汽灭菌锅中蒸煮(121 ℃、20 min、101 kPa),按照蒸煮后体积的1%加入豆豉发酵剂混合均匀,将混匀的大豆放入培养箱中培养(25 ℃、相对湿度80%)5 d。分别在浸泡后、发芽后、蒸煮后、前发酵结束4个阶段取样40 g,测大豆中GABA含量。
2.4 发芽处理大豆中GABA富集的正交试验
在单因素试验的基础上,选取对豆豉中GABA含量有影响的培养液pH、发芽时间、浸泡时间为试验因素,以GABA含量为试验指标,分为三因素三水平,且不考虑交互作用,进行L9(34)试验,试验因素水平见表1,具体试验设计见表2,试验重复3次,结果以3次测定的平均值表示。

表1 L9(34)正交试验因素水平表Table 1 Factors and levels of L9(34) orthogonal test
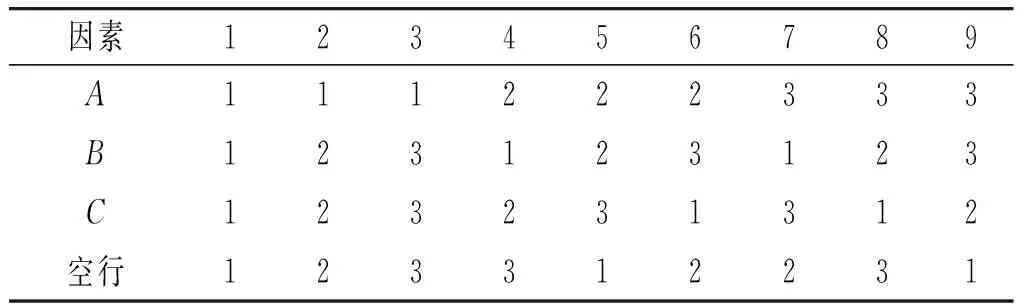
表2 正交试验设计Table 2 Orthogonal test design
3 结果与分析
3.1 GABA的高效液相色谱图
本试验采用高效液相色谱仪测定豆豉中GABA含量,在众多的色谱图中挑选两张色谱图,其中GABA的标准液相色谱图见图1,大豆的GABA液相色谱图见图2。
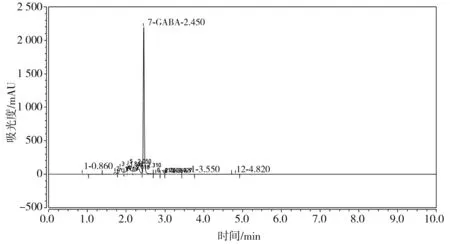
图1 GABA标准色谱图Fig.1 Standard chromatogram of GABA
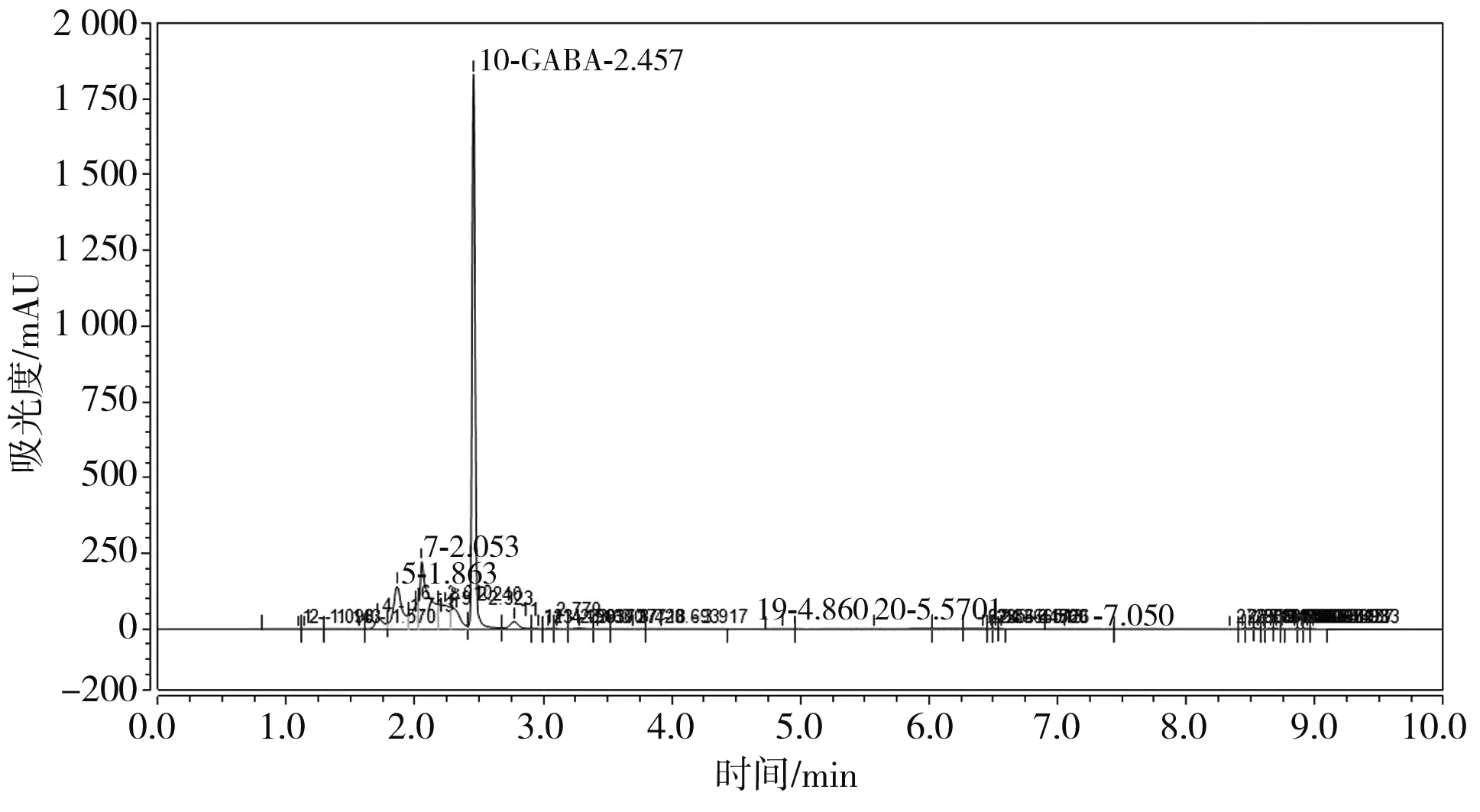
图2 大豆GABA色谱图Fig.2 Chromatogram of GABA in soybean
3.2 GABA标准曲线的绘制
用信号峰面积(Y)和GABA标准品浓度(X)进行线性回归,结果见图3。回归方程为Y=0.109 2X+43.227 9。Y与X显著相关,表明GABA在该浓度范围内呈良好的线性。GABA的标准曲线见图3。
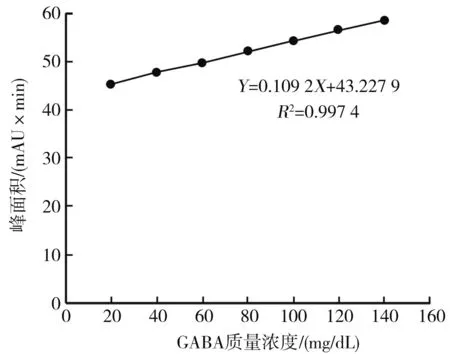
图3 GABA的标准曲线Fig.3 Standard curve of GABA
3.3 单因素试验
3.3.1 培养液pH的影响
不同培养液pH下GABA含量变化情况见图4。
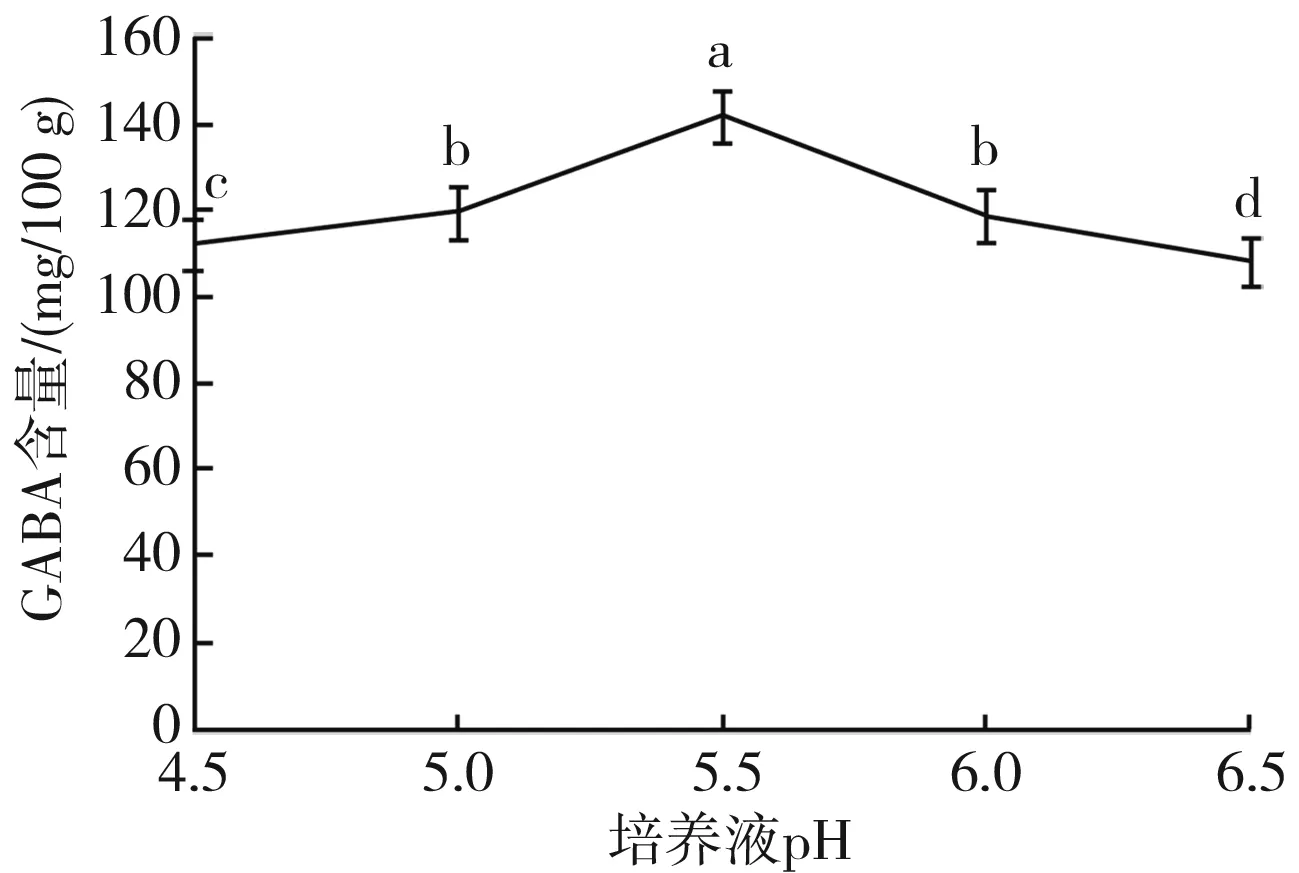
图4 不同培养液pH下GABA含量的变化Fig.4 Change of GABA content under different pH valuesof culture medium注:不同小写字母表示样品中GABA含量之间存在显著性差异(P<0.05),下图同。
由图4可知,GABA含量在pH 4.5~5.0的范围内缓慢增加,在pH 5.0~5.5的范围内明显增加,在pH 5.5时达到最大值141.612 6 mg/100 g;在pH 5.5~6.5的范围内,GABA含量随着pH的增加而减少。这可能是由于植物中GAD的最适反应pH值通常在5.5左右,在此pH值下,大豆中的酶活性最高,合成GABA含量也最高,而进一步提高pH值会使酶活力降低,降低大豆的代谢能力,从而使大豆中的GABA含量逐渐下降。因此,将最佳pH值设定为5.5左右,作为后续试验最佳培养液pH值。
在最适pH的发酵过程中GABA含量变化情况见图5。

图5 最适pH的发酵过程中GABA含量变化Fig.5 Change of GABA content during the fermentation under the optimum pH value
由图5可知,大豆经过浸泡和发芽后,GABA含量逐渐增加,发芽时GABA含量达到最大值141.612 6 mg/100 g,该值是未经过处理的大豆GABA含量的2.65倍。经过蒸煮和前发酵两个过程后,发芽大豆的GABA含量趋于平稳,并且利用SPSS 21.0进行Duncan法比较分析,此过程中大豆的GABA含量无明显变化(P>0.05)。因此,可以得出结论:蒸煮和前发酵两个过程对大豆的GABA含量无明显影响。
3.3.2 维生素B6浓度的影响
不同维生素B6浓度下GABA含量变化情况见图6。
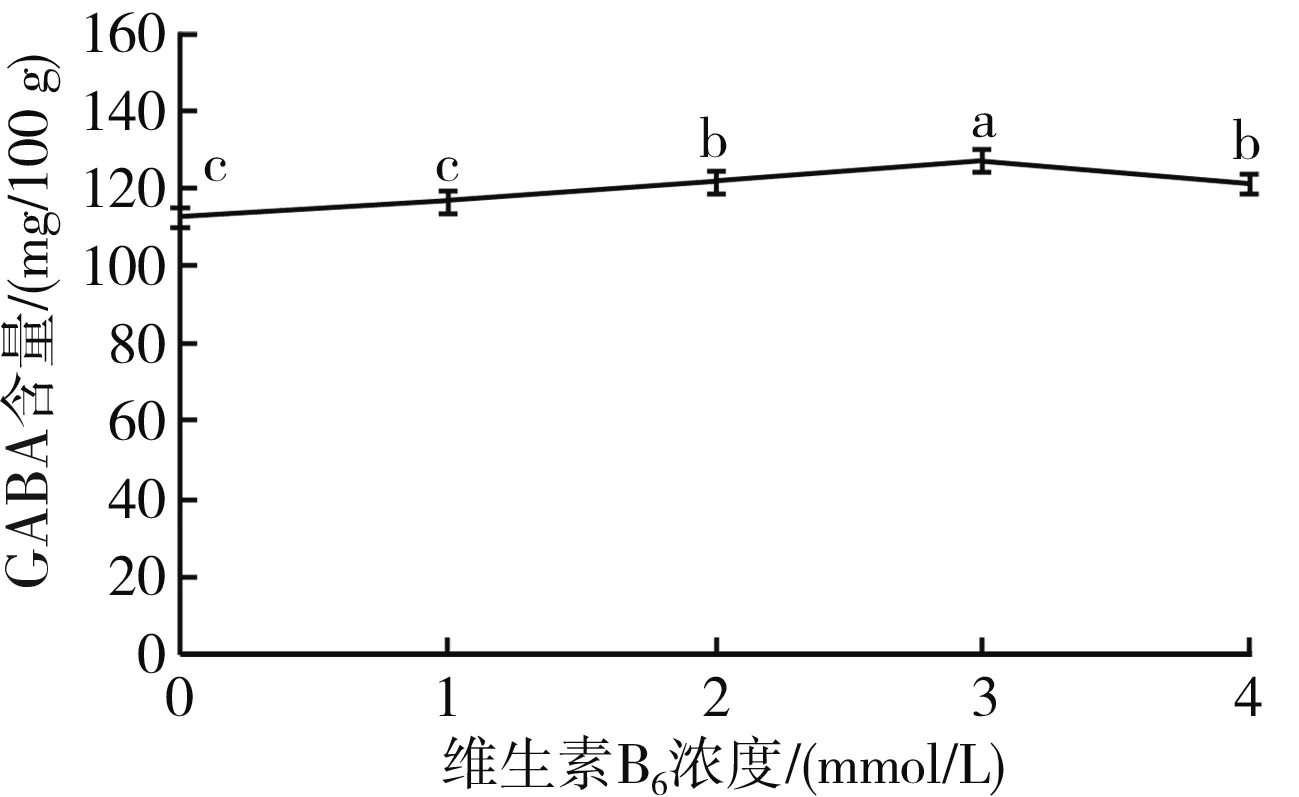
图6 不同维生素B6浓度下GABA含量的变化Fig.6 Change of GABA content under different vitamin B6 concentrations
由图6可知,在0~3 mmol/L范围内,随着维生素B6浓度的不断增加,豆豉中GABA的含量也不断升高,并在浓度为3 mmol/L时GABA含量达到最大值126.881 0 mg/100 g;在3~4 mmol/L范围内,随着维生素B6浓度的增加,豆豉中GABA含量逐渐降低。因此,将最佳维生素B6浓度设定为3 mmol/L。磷酸吡哆醛是谷氨酸脱羧酶的辅酶,而维生素B6又是磷酸吡哆醛类似物,所以维生素B6具有促进谷氨酸脱羧酶活性的作用,可用维生素B6代替磷酸吡哆醛来促进GABA的积累。相关文献报道,在豇豆中添加维生素B6,浓度达到3 mmol/L时,豇豆中GABA含量最高,这与本试验结果相似。
在最适维生素B6浓度的发酵过程中GABA含量变化情况见图7。
由图7可知,大豆的GABA含量在浸泡和发芽后逐渐增加,并在发芽阶段达到最大值126.881 0 mg/100 g,是未经过处理的大豆GABA含量的2.37倍。大豆中GABA含量曲线在发芽至前发酵的过程中趋于平缓,并且利用SPSS 21.0进行Duncan法比较分析,此过程中大豆的GABA含量无明显变化(P>0.05)。因此,可以得出结论:蒸煮和前发酵两个过程对大豆GABA含量无明显影响。
3.3.3 浸泡时间的影响
不同浸泡时间下GABA含量的变化情况见图8。
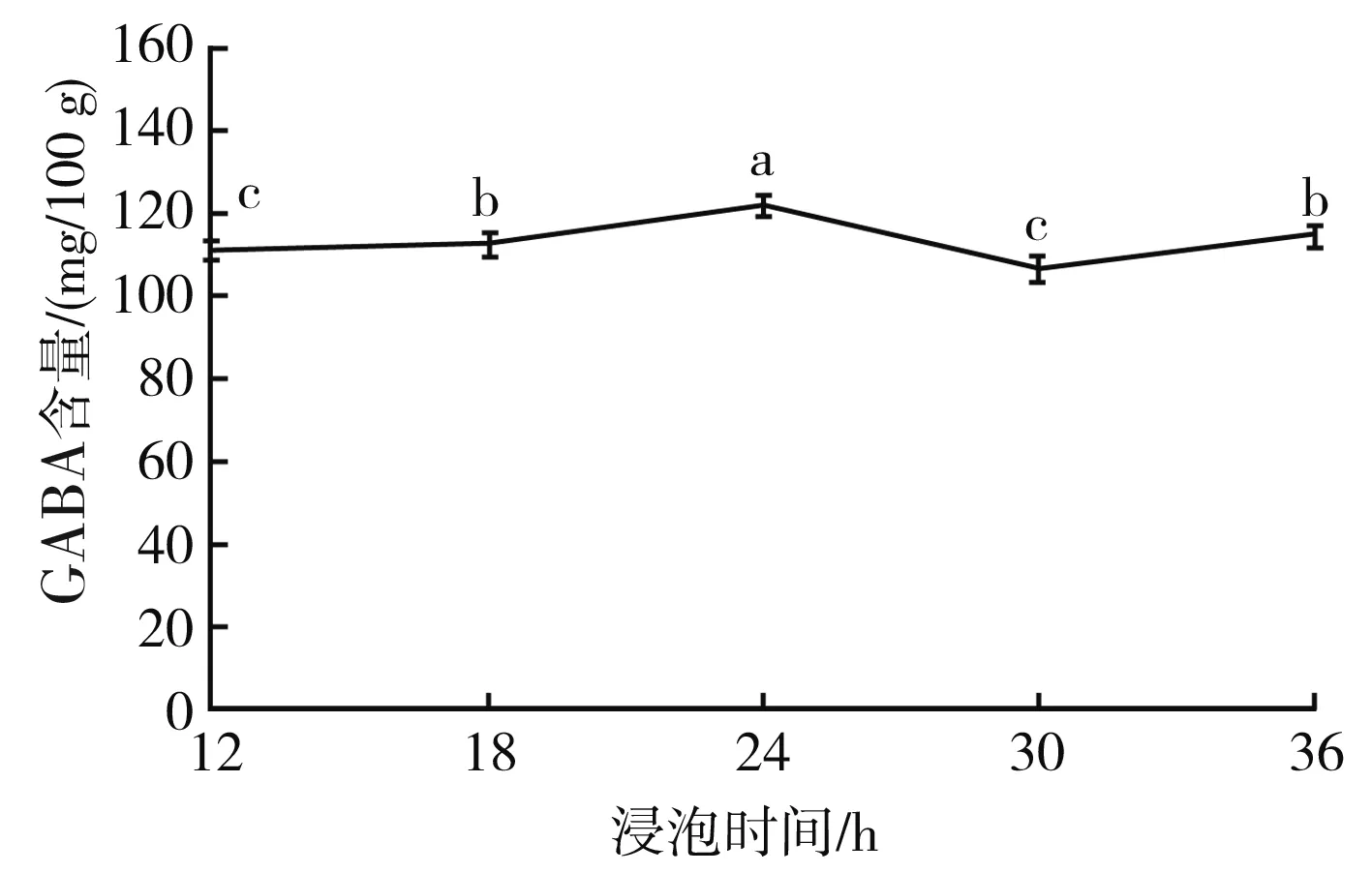
图8 不同浸泡时间下GABA含量的变化Fig.8 Change of GABA content under different soaking time
由图8可知,在12~18 h范围内,随着浸泡时间的不断延长,豆豉中GABA的含量变化不明显;在18~24 h范围内,随着浸泡时间的不断延长,豆豉中GABA的含量也逐渐升高。在浸泡24 h时豆豉中GABA的含量达到最大值121.453 3 mg/100 g,是未经过处理的大豆中GABA含量的2.28倍;在24~30 h范围内,随着浸泡时间的不断延长,豆豉中GABA的含量逐渐降低;在30~36 h范围内,豆豉中GABA的含量随着浸泡时间的延长又逐渐升高。大豆浸泡时间过长导致大豆膨胀过度,不利于大豆后期的生长,为后期发芽和制作毛霉型豆豉带来困难。因此,根据GABA含量确定最佳浸泡时间为24 h,并将其作为后续试验的最佳浸泡时间。相关文献报道,随着浸泡时间的不断延长,大豆的吸水率也在逐渐增加,并在浸泡24 h时大豆吸水率达到最大,此时大豆完全吸收水分,将干物质转化为可溶性物质,提高了大豆的代谢活性。在此阶段,大豆的GABA含量达到最大值。当浸泡时间过长时,大豆细胞中的易溶性物质浸出,阻断了GABA的合成通道,并将原有积累的GABA分解,此时大豆的 GABA含量又逐渐下降。
在最适浸泡时间的发酵过程中GABA含量变化情况见图9。
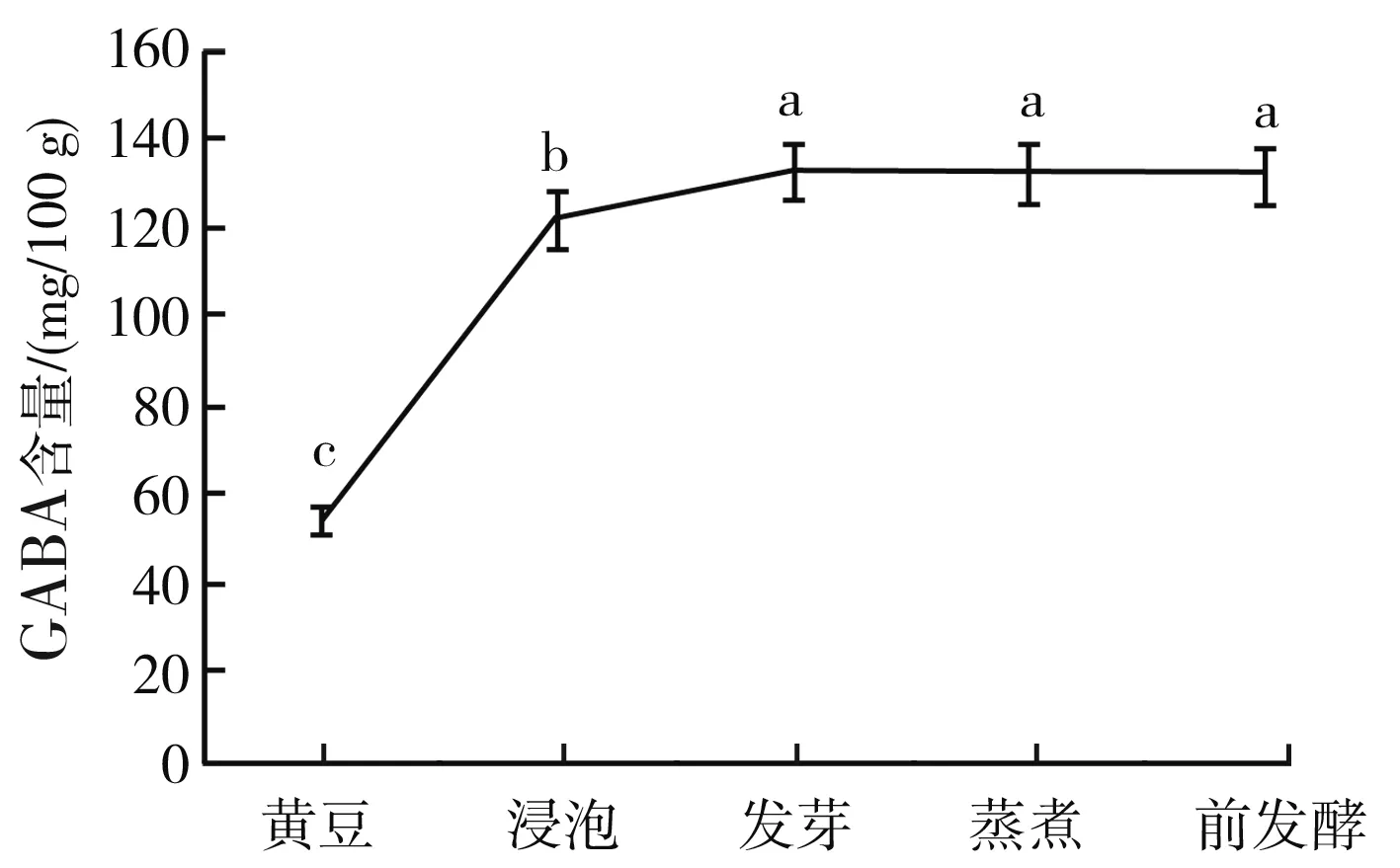
图9 最适浸泡时间的发酵过程中GABA含量变化Fig.9 Change of GABA content during fermentation underthe optimum soaking time
由图9可知,大豆经过浸泡和发芽处理后,GABA含量逐渐增加,并在发芽末期达到最大值121.453 3 mg/100 g,是未经过处理的大豆GABA含量的2.28倍。大豆中GABA含量在发芽至前发酵的过程中趋于平缓,并且利用SPSS 21.0进行Duncan法比较分析,此过程中大豆的GABA含量无明显变化(P>0.05)。因此,可以得出结论:蒸煮和前发酵两个过程对大豆GABA含量无明显影响。
3.3.4 发芽时间的影响
不同发芽时间下GABA含量的变化情况见图10。
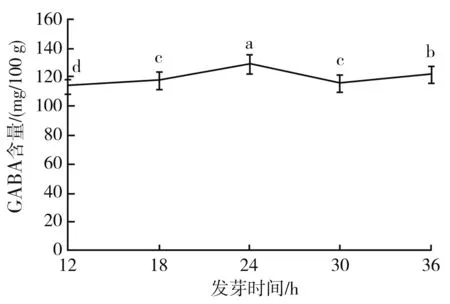
图10 不同发芽时间下GABA含量的变化Fig.10 Change of GABA content under different germinating time
由图10可知,在12~24 h范围内,随着发芽时间的不断延长,豆豉中GABA的含量也在不断升高,并在发芽24 h时豆豉中GABA含量达到最大值128.630 0 mg/100 g,是未经过处理的大豆中GABA含量的2.41倍;在24~30 h范围内,随着发芽时间的不断延长,豆豉中GABA含量逐渐降低;在30~36 h范围内,随着发芽时间的不断延长,豆豉中GABA含量逐渐升高。考虑到36 h后大豆芽生长过长,为后期制作毛霉型豆豉带来困难,因此,根据GABA含量确定最佳发芽浸泡时间为24 h,并将其作为后续试验的最佳发芽时间。在发芽中期,随着发芽时间的不断延长,GABA的合成速率逐渐加快,同时底物中谷氨酸含量也在逐渐增加,使得GABA含量在此过程中达到最大值;在发芽末期,随着大豆体内代谢的进行和发芽时间的不断延长,大豆体内微生物大量繁殖。同时,GABA的分解速度加快,谷氨酸底物含量逐渐下降,这些因素都不利于GABA的富集,所以GABA含量在达到最大值后开始下降。
最适发芽时间的发酵过程中GABA含量的变化情况见图11。

图11 最适发芽时间的发酵过程中GABA含量变化Fig.11 Change of GABA content during fermentation underthe optimum germinating time
由图11可知,大豆的GABA含量在浸泡和发芽后逐渐增加,并在发芽阶段达到最大值128.630 0 mg/100 g,是未处理的大豆GABA含量的2.41倍。大豆GABA含量的变化在发芽到前发酵的过程中趋于平缓,并且利用SPSS 21.0进行Duncan法比较分析,此过程中大豆的GABA含量无明显变化(P>0.05)。因此,可以得出结论:蒸煮和前发酵两个过程对大豆GABA含量无明显影响。
3.4 正交试验设计结果与分析
按照表2中的正交试验方案制备样品,并测定样品中GABA含量,按照正交试验设计方案计算极差,结果见表3,RA>RB>RC,因此影响豆豉富集GABA的主次顺序为培养液pH值(A)>发芽时间(B)>浸泡时间(C),最佳组合为A2B2C2。
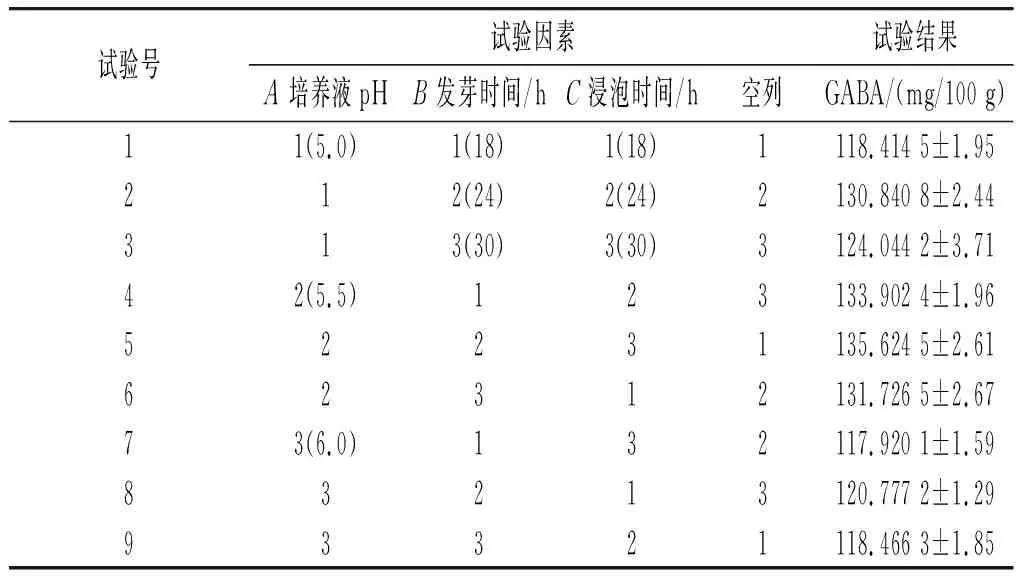
表3 正交优化试验结果Table 3 Orthogonal optimization test results
由表4可知,利用方差分析对自由度、均方、F比值和显著性等指标进行综合分析可得出结论:豆豉中GABA含量随试验条件的变化而变化,并且在5%的显著水平下,由计算可知,FA>F0.01(2,4)=18.000,则认为培养液pH值对试验结果有极显著影响;FB 表4 方差分析Table 4 Variance analysis 在豆豉富集GABA的工艺中,以GABA含量为指标,研究了培养液pH、发芽时间、浸泡时间和维生素B6浓度对豆豉中GABA富集的影响,同时对富集GABA的条件进行优化,最后得到豆豉产品。通过单因素试验,并对试验数据进行分析可知,培养液pH值为5.5时,豆豉中GABA含量可达到最大值141.612 6 mg/100 g,是未经过处理的豆豉GABA含量的2.65倍;发芽时间为24 h时,豆豉中GABA含量可达到最大值128.630 0 mg/100 g,是未经过处理的豆豉GABA含量的2.41倍;浸泡时间为24 h时,豆豉中GABA含量可达到最大值121.453 3 mg/100 g,是未经过处理的豆豉GABA含量的2.28倍;维生素B6浓度为3 mmol/L时,豆豉中GABA含量可达到最大值126.881 0 mg/100 g,是未经过处理的豆豉GABA含量的2.37倍。通过正交试验数据可得出结论:富含GABA的豆豉最佳前处理工艺条件为培养液pH值5.5、发芽时间24 h、浸泡时间24 h、维生素B6浓度3 mmol/L,此时豆豉中GABA的富集量为139.724 4 mg/100 g,是未经处理的大豆GABA含量的2.62倍。利用SPSS 21.0进行Duncan法比较分析整个发酵过程数据可得,在制作豆豉的过程中,蒸煮、发酵对豆豉中GABA含量无明显影响(P>0.05),最终豆豉产品的GABA含量为139.724 4 mg/100 g,是未经过处理的豆豉中GABA含量的2.62倍。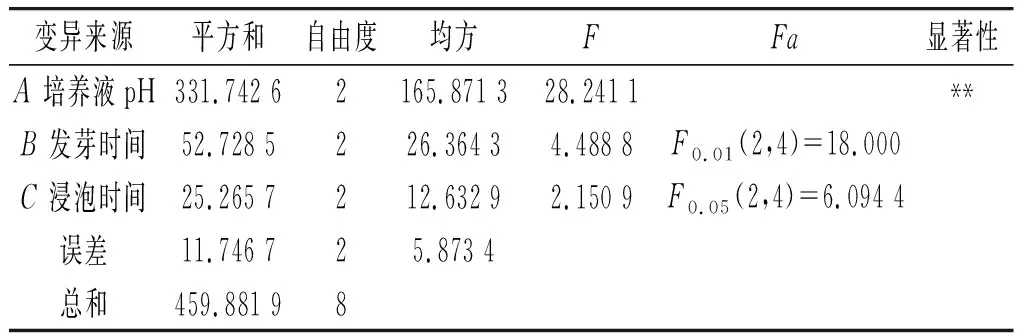
4 结论

