不同pH溶液制备亚麻籽胶组成和功能特性的差异比较
冯孟熙,汪兰
(1.华中农业大学 食品科学技术学院,武汉 430070;2.湖北省农业科学院农产品加工与核农技术研究所,武汉 430064)
亚麻是全球最重要的经济作物之一,由于其纤维在纺织行业以及种子在食品和保健品行业的作用而在全球被广泛种植[1]。亚麻籽富含营养素,即必需的脂类、蛋白质、生物活性多肽以及可溶性和不溶性膳食纤维,在食品工业中显示出良好的应用潜力[2]。亚麻籽的膳食纤维含量占其总质量的22%~28%,最外层的表皮含有约8%质量的黏性胶[3]。
亚麻籽胶(FG)是一种中性多糖和酸性多糖组成的阴离子杂多糖。中性阿拉伯木聚糖由β-D-(1,4)-木聚糖骨架组成,相对分子质量为1 200 kDa,酸性组分以鼠李糖半乳糖醛酸-I(RG-I)主干,其特征是[→2]-α-L-Rhap-(1→4)-α-D-GalpA-(1→)的二糖基重复单元。 FG由于其良好的乳化性、增稠性、凝胶性和界面稳定性等,已成为商用的食品亲水胶体。Luo等[4]发现适当地摄入FG可以通过改变肠道菌群的比例,降低体重、体脂和总三酰甘油的含量。
FG是一种亲水性胶体,常用水进行提取。温度、pH和料水比是影响提取得率和最终胶化学成分的主要因素[5]。提高提取温度可获得更高的提取得率(高达脱脂亚麻籽质量的16%~20%),但会降低最终胶的纯度,即蛋白质和灰分残留会更多[6-7]。原料与水的比例对FG提取率的影响相对较小,当比例超过1∶20时,可以忽略不计[8]。已有研究着重提取工艺对FG得率和纯度的影响,但溶液的pH 值对 FG 的化学成分、理化性质影响的研究较少。本研究通过比较酸性、中性和碱性溶液下提取的FG的组分、单糖组成、理化特性,筛选适宜的提取溶液,为其在食品工业中的开发和利用提供了基础。
1 材料与方法
1.1 材料与试剂
亚麻籽(甘肃张掖黄籽):由中国农业科学院油料作物研究所提供。
大豆色拉油:益海嘉里金龙鱼粮油食品股份有限公司;三氟乙酸(色谱纯)、甲醇(分析纯):上海安谱实验科技股份有限公司;醋酸钠:Sigma公司;重蒸苯酚:北京索莱宝科技有限公司;盐酸、氢氧化钠、乙醇(95%)、氯化钠、硝酸钠、十二烷基硫酸钠(SDS)、硫酸等:均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
SHJ-6A磁力搅拌水浴锅 常州金坛良友仪器有限公司;UH5300 紫外可见分光光度计 日本日立公司;DHG-9078A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;ICS5000离子色谱仪、Reacti-ThermTM氮气吹扫仪 美国赛默飞世尔科技公司;GPC-MALLS 凝胶渗透色谱-多角度激光光散射联用仪 美国怀雅特技术有限公司;GL-21M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;Mastersizer 2000激光粒度分析仪 英国Malvern公司;IKA均质机 广州市东南科创科技有限公司;TA.XT 2i/50质构仪 英国Stable Micro Systems公司。
1.3 试验方法
1.3.1 亚麻籽胶提取工艺
称取3份适量亚麻籽,过筛,除去灰尘,然后用去离子水洗涤。将洗干净的亚麻籽与9倍体积的去离子水混合,用1 mol/L NaOH和l mol/L HCl分别将pH调至4和10,最后一组调节pH为6.5,分别命名为FG-4、FG-10、FG-6.5。然后在60 ℃的水浴条件下用磁力搅拌器在3 000 r/min的转速下将溶液搅拌2 h,在4 500 r/min的条件下离心10 min,分离亚麻籽壳与不溶性杂质。通过乙醇与浸泡亚麻籽收集的黏稠液体以(9∶1)的比例,加入95%乙醇进行沉淀过夜;在4 ℃,7 000 r/min的条件下离心15 min后,收集FG进行冷冻干燥后研磨成粉备用。
1.3.2 FG基本组成的测定
灰分含量的测定参考 GB 5009.4-2016,蛋白质含量的测定参考 GB 5009.5-2016,多糖含量的测定参考 SN/T 4260-2015,脂肪含量的测定参考GB 5009.6-2016。
1.3.3 单糖组成的测定
参照Wang等[9]的方法利用离子色谱仪检测FG的单糖组成。分别准确称取岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡萄糖醛酸、甘露糖醛酸、古罗糖醛酸13种标准品加入水配制成10 mg/mL标准溶液母液单标,然后取适量标准品母液单标混合配制成最高指标浓度为60,50,40 μg/mL的标准品混标。取干净的色谱瓶,称取适量FG样品,加入1 mL 2 mol/L TFA溶液,121 ℃加热2 h,通氮气,吹干。加入99.99%甲醇清洗,再吹干,重复甲醇清洗2~3次。加入无菌水溶解,转入色谱瓶中待测。采用ICS5000离子色谱仪和电化学检测器对单糖组分进行分析检测。采用DionexTMCarboPacTMPA20液相色谱柱(150 mm×3.0 mm,10 μm);进样量为5 μL。流动相A(H2O),流动相B(0.1 mol/L NaOH),流动相C(0.1 mol/L NaOH,0.2 mol/L NaAc),流速0.5 mL/min;柱温为30 ℃;洗脱梯度:0 min A相/B相/C相(95∶5∶0,体积比),26 min A相/B相/C相(85∶5∶10,体积比),42 min A相/B相/C相(85∶5∶10,体积比),42.1 min A相/B相/C相(60∶0∶40,体积比),52 min A相/B相/C相(60∶40∶0,体积比),52.1 min A相/B相/C相(95∶5∶0,体积比),60 min A相/B相/C相(95∶5∶0,体积比)。
利用Origin软件处理色谱数据,横坐标为检测的保留时间(min),纵坐标为离子检测的响应值,得到标准品离子色谱图和样品离子色谱图。采用外标法进行定量。
1.3.4 分子量的测定
利用GPC-MALLS凝胶渗透色谱-多角度激光散射仪测定FG的分子量,用0.1 mol/L NaNO3配制1 mg/mL的亚麻籽胶溶液,将FG溶液在8 000 r/min下离心15 min,用注射器吸取上层溶液经0.45 μm聚醚砜微孔滤膜过滤。具体条件:流速0.4 mL/min;进样量500 μL;试验温度(25.0±0.2) ℃。
1.3.5 粒径的测定
用0.1 mol/L NaNO3配制1 mg/mL的FG溶液,通过0.22 μm过滤器过滤,利用动态光散射法,采用马尔文粒径仪测定亚麻籽胶溶液的粒径。
1.3.6 Zeta电位的测定
采用马尔文粒径仪测定FG溶液的Zeta电位,将冷冻干燥得到的亚麻籽胶粉末用去离子水溶解,得到0.25%浓度的FG溶液,进行测定。
1.3.7 特性黏度的测定
参照Hellebois等[10]的方法并稍作修改,将亚麻籽胶溶于0.1 mol/L NaCl溶液中,用乌氏黏度计测定不同浓度的FG溶液(0.5~2.5 mg/mL)在25 ℃水浴中流经两个刻度需要的时间Ti,并测出溶剂流经两个刻度需要的时间T0,以浓度和比浓黏度作图,外推至浓度C=0时的比浓黏度即为特性黏度[η]。比浓黏度和特性黏度按下式计算:
式中:ηsp为增比黏度;C为被测溶液的浓度(mg/mL);ηsp/C为比浓黏度(mL/mg);T为被测溶液在乌氏黏度计下的流出时间(s);T0为纯溶剂在乌氏黏度计下的流出时间(s);[η]为特性黏度(mL/g)。
1.3.8 凝胶性的测定
配制2%的FG溶液,在90 ℃下溶解后置于4 ℃冰箱中过夜,形成凝胶。用TA.XT 2i/50质构测试仪的P/0.5型探头,测试速度为2.0 mm/s,形变 50%,测定凝胶破裂所需要的最大力,即凝胶强度。
1.3.9 乳化性及乳化稳定性的测定
参照Zang等[11]的方法并稍作修改,分别配制1%的FG溶液,90 ℃加热搅拌溶解,于室温下冷却后,加入8%的大豆色拉油,使用高速均质机于10 000 r/min下均质3 min,得到乳白均一的乳状液。
乳状液在常温下放置,于0 h和24 h从乳液底部吸取50 μL,用0.1 g/dL SDS溶液稀释250倍,测定在500 nm处的吸光度,以SDS溶液为空白对照。
样品的浊度为T,以浊度的大小表示乳化剂的乳化活性(emulsion ability,EA):
式中:L为光路长度,此处为1 cm。
乳化剂的乳化稳定性(emulsion stability,ES) 用24 h后测定的浊度T2的变化程度来表示:
1.3.10 起泡性及起泡稳定性的测定
参照袁孝瑞等[12]的方法并稍作修改,分别取10 mL浓度为1%的FG溶液,于高速均质机下以8 000 r/min均质1 min,读取泡沫体积(mL),放置30 min后再次读取泡沫体积。起泡性(FC)和起泡稳定性(FS)按照下式计算:
1.4 数据处理及分析
采用Excel 2010、Origin 2022b 和 SPSS 26 进行作图与数据分析。试验结果均以平均值±标准差表示,采用单因素方差分析法进行显著性差异分析,当P<0.05 时表示差异显著。
2 结果与分析
2.1 FG的提取率及基本组成
FG提取率与基本组成见表1。

表1 亚麻籽胶的提取率和基本组成成分Table 1 Extraction rate and basic composition of flaxseed gum %
本方法对FG的提取率为5.65%~5.83%,与刘蕾等[13]优化的提取工艺相近。提取FG的原料集中于亚麻籽全籽和亚麻籽壳,也有少部分研究者利用亚麻籽饼粕和脱脂亚麻籽粉进行提取。冯爱娟等[14]以亚麻籽壳为原料,利用超声波辅助提取,得到的最佳工艺条件为料液比1∶30(g/mL)、提取温度90 ℃、初始pH 7.0、提取功率240 W、时间40 min,得到的FG提取率达到19.8%。姚玥等以亚麻饼粕为原料,采用酶法-超声波辅助法优化了FG的提取条件,得到的最佳工艺条件为酶添加量1.25%、提取温度40 ℃、提取时间60 min、料液比(亚麻饼粕∶水)1∶30(g/mL)、提取功率400 W,提取率达到33.41%。本研究中FG得率较低,可能与提取原料差异有关。
FG的主要成分为碳水化合物,含量为81.44%~82.33%,含有8.36%~10.09%的蛋白质、6.18%~6.6%的灰分和2.02%~3.31%的脂肪残留。本试验所提取的FG基本组成与Hellebois等[15]所测定的棕色亚麻籽提取的FG相似。由于蛋白质在酸性或碱性条件下会发生部分变性和水解,因此FG-4和FG-10的蛋白质含量显著低于FG-6.5。
2.2 单糖组成
利用离子色谱法测定FG的单糖组成,测定的混合标准品及样品的离子色谱图见图1和图2。
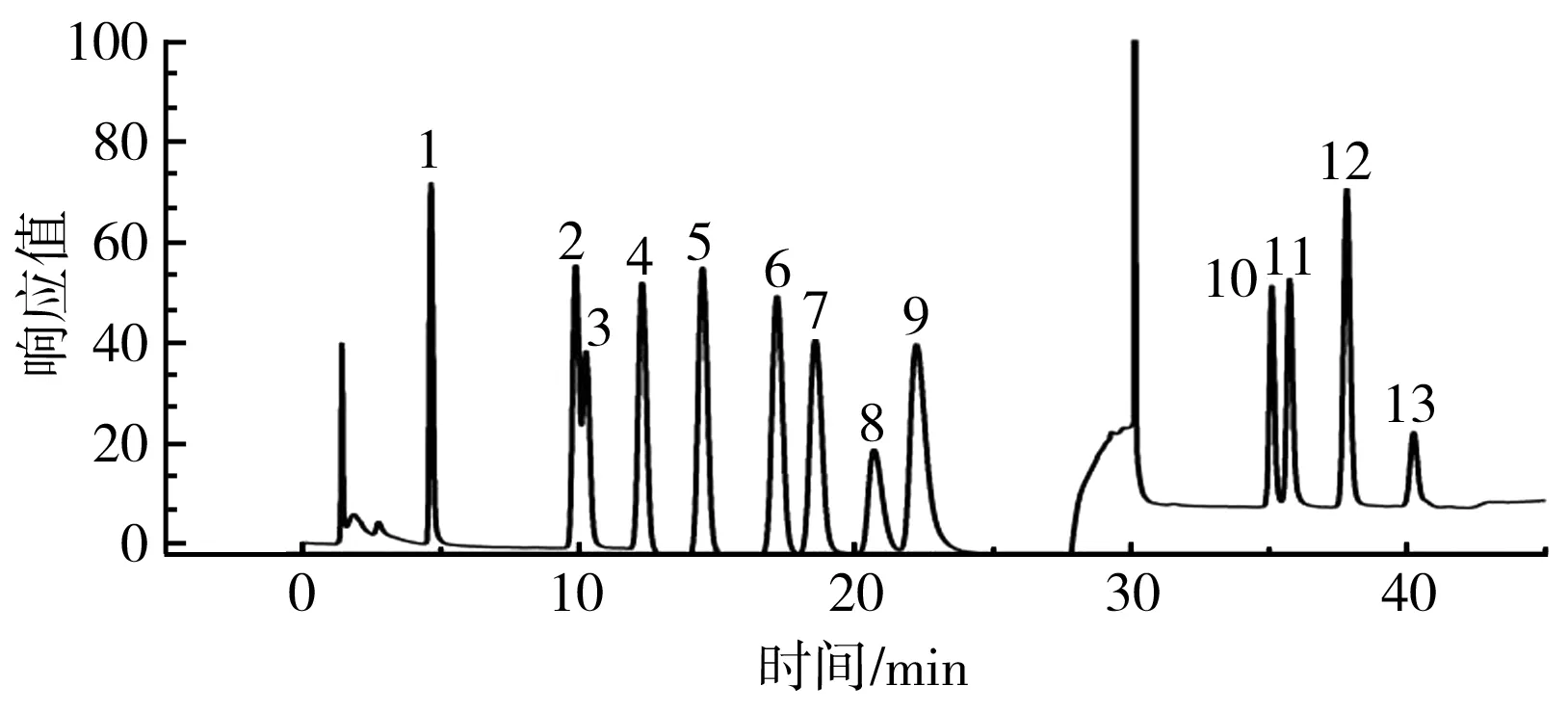
图1 混合标准单糖离子色谱图Fig.1 Ion chromatogram of mixed standard monosaccharide
由图1可知,各标准单糖的保留时间依次为岩藻糖4.633 7 min(峰1)、阿拉伯糖9.875 3 min(峰2)、鼠李糖10.250 3 min(峰3)、半乳糖12.283 7 min(峰4)、葡萄糖14.475 3 min(峰5)、木糖17.167 min(峰6)、甘露糖18.567 min(峰7)、果糖20.700 3 min(峰8)、核糖22.242 min(峰9)、半乳糖醛酸35.100 3 min(峰10)、古罗糖醛酸35.742 min(峰11)、葡萄糖醛酸37.800 3 min(峰12)、甘露糖醛酸40.225 3 min(峰13)。
由图2可知,在不同pH下提取的FG在单糖种类和含量上没有表现出较大差异,均是由岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖和半乳糖醛酸组成。验证了FG是由以鼠李糖为主的酸性多糖和以木糖为主的中性多糖构成的杂多糖。本试验测定的单糖种类与陈海华[16]和Hellebois等的测定结果一致。梁珊等[17]采用气相色谱法测定了FG的单糖组成,结果表明仅有鼠李糖、阿拉伯糖、木糖、葡萄糖、半乳糖 5 种单糖。
由表2可知,木糖是FG中含量最多的单糖,占30.35%~31.19%。与Hellebois等[10]的测定结果不同的是,他们测定的FG中含有16.4%~22.3%的半乳糖醛酸,而本试验结果表明FG中只含有微量(0.96%~1.15%)的半乳糖醛酸。FG的单糖组成随着亚麻的品种、生长环境、产地、提取方式的不同而不同。Oomah等[18]研究了12个地区的FG单糖组成,结果表明有较大差异。木糖/鼠李糖(Xyl/Rha)的比值能反映FG中的中性多糖和酸性多糖的比例,从而影响亚麻籽胶的功能性质。由表2可以算出3种pH 环境下提取的FG的Xyl/Rha值分别为1.26,1.25,1.188。
2.3 分子量和特性黏度
为了防止多糖分子间由于非共价相互作用如氢键、范德华力、静电斥力而聚集在一起,采用0.1 mol/L NaNO3代替蒸馏水作为溶剂[19]。由图3可知,3种FG洗脱曲线相似,均有两个洗脱峰,说明FG是由大分子量的中性单糖和较小分子量的酸性单糖组成的,与单糖组成的测定结果一致。
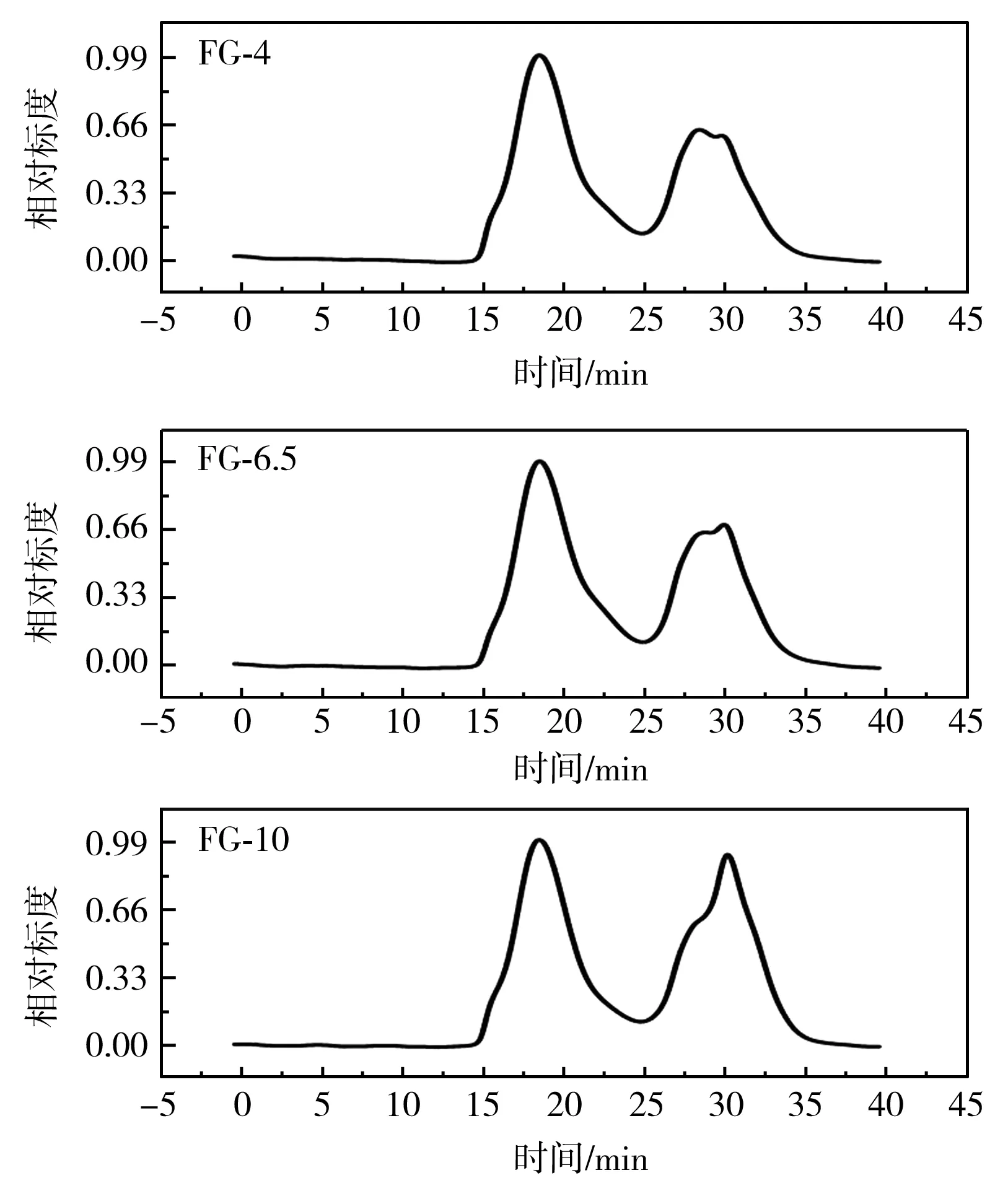
图3 FG的GPC洗脱曲线Fig.3 GPC elution curves of FG
由表3可知,FG-10重均分子量Mw最大(7.377×105g/mol),FG-4的稍小(6.996×105g/mol),FG-6.5的最小(6.381×105g/mol)。FG作为一种阴离子多糖,本身带负电荷,在碱性条件下比较稳定,由于带同种电荷的分子间产生静电斥力,引起分子链充分伸展。在加热条件下,分子链可能发生一定的断裂,从而导致分子量减小[20];还可能是中性条件下提取的FG有较多的蛋白质残留,导致分子量降低。梁珊等[17]比较了热水浸提和微波辅助热水浸提FG的Mw分别为13 452和2 368。FG不同的品种、生长环境和提取方法可能导致分子量的差异。Mw/Mn可以反映大分子的均一性,其值越小,说明该聚合物的一系列大分子分子量越均一,由于FG含有两种分子量的组分,所以均一性较差,酸性、中性和碱性条件下提取的FG 的Mw/Mn值依次为11.827,7.615,9.497。

表3 FG的分子量及特性黏度Table 3 Molecular weight and characteristic viscosity of FG
特性黏度表示单个分子对溶液黏度的贡献,是反映高分子特性的黏度,其值不随浓度的变化而变化,与聚合物的相对分子质量、溶剂特性有关。为了减小溶液中静电斥力对测定结果的影响,采用一价盐离子的溶液作为溶剂。由表3可知,在不同pH条件下提取的FG的特性黏度分别为692.1,674.4,763.6 mL/g,与Hellebois等[15]测定的金色亚麻籽提取的FG结果(652~674 mL/g)较接近。特性黏度与重均分子量的观测结果一致,FG-10的重均分子量明显高于FG-4和FG-6.5。可能的原因是在碱性介质下,糖苷键相当稳定,但在酸性条件下容易断裂,从而影响大分子的聚集,降低聚合物的黏度。另外,流体动力学半径越大,则分子在溶液中的伸展程度越大,流动阻力随之增加,继而提高多糖溶液的黏度,由表4可知粒径的观测结果与特性黏度保持一致。

表4 不同pH溶液中提取的FG粒径、Zeta电位和功能特性Table 4 Particle size, Zeta potential and functional properties of FG extracted with solutions at different pH values
2.4 粒径
由表4可知,FG的粒径较小,均在134~204 nm范围内,说明FG的流体力学直径较小,与Hellebois等[15]的观测结果(216~262 nm)相近。FG-10的粒径最大,为204.25 nm,显著大于另外两组,FG-4的粒径稍小,为142.94 nm, FG-6.5的粒径最小,为134.04 nm。与分子量观测结果一致,pH 10提取的FG最大,pH 4提取的FG稍小,pH 6.5提取的FG最小。
2.5 Zeta电位
胶体体系的稳定性是当颗粒相互接近时,它们之间的双电层互斥力与范德瓦尔互吸力相互作用的结果。如果颗粒带有很多正或负的电荷,即Zeta电位很高,颗粒间将相互排斥以达到稳定的体系,相反,如果Zeta电位很低,颗粒间相互吸引,会使整个体系趋于不稳定。水相中颗粒分散稳定性的分界线一般认为在+30 mV或-30 mV,由表4可知,3种pH条件下提取的FG的Zeta电位都低于-30 mV,说明FG是一种阴离子多糖且分散体系较稳定。Vieira等[21]研究了不同温度下提取的FG电位的变化,结果表明在25,40,60 ℃下提取的FG最大电位分别是-29.37,-34.57,-35.1 mV。
pH作为影响Zeta电位最重要的因素,在FG本身带负电荷的情况下,在提取过程中加入碱性物质,颗粒得到更多的负电荷,所以FG-10溶液的Zeta电位最高且显著高于另外两种,达到-37.39 mV。Zeta电位越大,分子间所带的电荷越多,分子间静电斥力越大,这可能也是导致FG-10的特性黏度最高的原因之一。由单糖组成的测定结果可知,3种pH环境下提取的FG的Xyl/Rha值分别为1.26,1.25,1.188,以及FG-10的糖醛酸含量更高,说明FG-10携带的负电荷更多[22],这可能是导致Zeta电位差异的原因。而且在较低pH值下,FG分子中的羧基被质子化,静电斥力也会减小[23]。
2.6 胶凝性
胶凝性是指亲水胶体通过分子长链的交联将水或者其他液体固定在三维网络中,形成不流动的固体或半固体性质,不过只有部分亲水胶体具有胶凝性,如明胶、果胶等,有些则需要通过与其他亲水胶体复合来形成凝胶,因为这些亲水胶体本身不具有胶凝性,例如黄原胶等。
关于FG胶凝性的研究已有许多,亚麻籽具有弱凝胶的特性,可在加热溶解后,在冷却的过程中形成冷致凝胶。由表4可知,随着提取过程中pH的增大,胶凝性逐渐降低,FG-4的凝胶强度(21.38 g)显著高于FG-10(15.29 g),略大于FG-6.5(19.3 g),但差异并不显著。陈海华等[24]的研究结果表明,90 ℃条件下溶解2%的FG,得到的FG的凝胶强度为30 g,造成差异的原因可能是亚麻籽的产地、生长环境以及纯度不同。碱性条件下提取的FG分子发生部分解聚,分子间相互缠结点减少,导致凝胶强度降低。Chen等[25]指出,含中性多糖含量更高的FG具有更好的剪切变稀和弱凝胶的特性,由单糖组成可以看出,在3种pH环境下提取的FG的Xyl/Rha值分别为1.26,1.25,1.188,这也可能是导致FG凝胶性差异的原因之一。
2.7 乳化性和乳化稳定性
乳化性是FG的一个重要性质,取决于降低油水界面的张力的能力。由表4可知,FG-4的乳化性最好,显著大于FG-6.5和FG-10。在乳化稳定性上,FG-4显著大于FG-6.5,FG-6.5显著大于FG-10。这与粒径的观测结果对应,酸性和中性溶剂提取的FG粒径较小,可以在乳化时形成较小的乳滴,从而达到较好的乳化性,而碱性条件下提取的FG的粒径较大,导致其乳化性较差。亲水胶体的蛋白质含量也会影响其乳化性,由于在不利条件下蛋白质乳液容易失去稳定性,而且中性FG的蛋白质含量显著高于另外两种,这可能也是导致乳化性及乳化稳定性差异的原因。
2.8 起泡性和泡沫稳定性
起泡性是指亲水胶体降低液体表面张力并捕捉气体的能力,泡沫稳定性是指产生泡沫后保持气泡的能力。不同pH条件下提取的FG的起泡性和泡沫稳定性见表4,随着提取过程中pH的改变,FG溶液的起泡性和泡沫稳定性并没有较大幅度变化,分别为112%~119%和92%~96%,这说明提取过程中pH的变化并不会影响FG的起泡性和泡沫稳定性。
3 结论
本文主要探究了在不同pH条件下提取的FG性质以及结构上的差异。结果表明,在特性黏度上, FG-10最大,FG-4略高于FG-6.5,这与其分子量大小、流体动力学半径和Zeta电位有关,同时,由于FG-10的粒径较大,也使得其乳化性较差;FG主要单糖组成成分为木糖(30.35%~31.19%)和鼠李糖(24.65%~25.54%),FG-10的中性多糖比例相对来说较少,这可能影响其Zeta电位和胶凝性;提取过程中pH的改变并不会影响其起泡性和泡沫稳定性。因此,在酸性条件下提取的FG功能特性相对来说更优越,但如果提取过程中pH过低,可能也会使FG的功能性质下降。

