根系去除改变了毛竹林土壤酶活性对氮磷添加的响应
王 一,栾军伟,刘世荣
1 国际竹藤中心 国家林业和草原局/北京市共建竹藤科学与技术重点实验室, 北京 100102 2 四川长宁竹林生态系统国家定位观测研究站, 宜宾 644000 3 中国林业科学研究院 森林生态环境与自然保护研究所, 北京 100091
世界范围内工业的发展、化石燃料使用以及氮(N)肥施用导致大气活性N沉降量逐年增加,全球大气N沉降速率预计在2050年会比工业革命前增加近3倍[1—2]。尽管近年来我国工业减排和农业减肥使我国氮沉降量趋于稳定,但我国仍是氮沉降较严重地区之一[1, 3]。通常来讲,通过沉降作用进入生态系统的氮素可作为养分满足植被对氮素的需求,增加地上部分生产力[1, 4]。但长期且过量的氮沉降会引起土壤酸化、地上植被组成和地下土壤微生物群落结构的改变、甚至生态系统功能改变[5—7]。亚热带森林常被认为我国重要的N沉降区且相对缺乏磷元素(P)[3, 8],持续的N输入会加剧亚热带地区的P限制从而影响生态系统过程[9—11]。快速生长的植物由于在合成蛋白质过程中需要大量的P作为结构支撑[12],因此可能加剧与土壤微生物对P元素的竞争作用。尽管已开展大量氮磷添加试验研究[13],但受限于不同气候带生态系统具有不同氮磷养分状况,目前很多结论仍存在争议。尤其是在具有爆发式生长特征的毛竹林生态系统中,开展N、P添加试验对我们了解N沉降下毛竹和土壤微生物的响应具有重要的作用。
土壤酶作为土壤中植物根系和微生物协同作用产生的活性物质,在调节土壤碳(C)和养分循环中发挥重要的作用,其常被作为参与土壤中C、N、P转化和养分释放的重要工具,也被作为土壤微生物对全球变化响应的重要指示因子[14—15]。酶的分泌过程需要能量和养分,因此土壤养分状况变化会改变土壤酶产量分配[14]。植物通过根系获取养分,这可能会加剧根系和土壤微生物之间对养分的竞争[16]。根系也会以分泌物的形式和自身周转为微生物生长提供必需的能量[17]。因此,根系输入变化将会通过改变土壤养分状况以及底物数量和质量进而影响与土壤微生物生长相关的C、N、P资源在土壤酶中的分配[18]。在该过程中,土壤微生物通过“优化资源配置”协调分配与C、N、P循环相关的酶产量以满足其对能量和养分的需求[15]。目前,已开展了毛竹林土壤酶活性对N添加响应的研究[19],但基于土壤酶的功能多样性[20],探究土壤C、N、P循环相关酶活性对N、P添加和根系输入变化的响应差异将有助于我们预测全球变化对竹林生态系统C、N、P循环的潜在影响。
毛竹(Phyllostachysedulis)作为我国面积最大,分布最广的竹种,广泛分布于我国亚热带地区[21]。毛竹爆发式生长阶段需要从根系获取大量养分供应,根系输入变化可能会改变毛竹与土壤微生物之间对养分的竞争,进而影响土壤酶活性的变化。壕沟处理作为一种有效的改变根系输入的手段,可在对土壤扰动尽量小的情况下切断植物根系达到根系去除的效果,进而改变植物与微生物之间的养分竞争作用[22]。我们之前研究发现四川长宁地区毛竹林生态系统P相对缺乏[23],根系输入变化是否会改变毛竹林土壤酶活性对N和P添加的响应我们仍不清楚。因此开展毛竹林生态系统N和P添加试验并结合样地内壕沟样方试验,考察土壤C、N、P循环相关酶活性对氮磷添加和根系去除的响应,为深入理解N沉降对亚热带森林生态系统碳和养分循环的影响提供科学依据。
1 研究区概况
研究地点位于四川省宜宾市长宁县蜀南竹海景区(28°15′—28°47′ N,104°44′—105°03′ E),位于云贵高原向四川盆地过渡区,属中亚热带湿润性季风气候,降水丰富,温暖湿润,年均降雨量1141.7 mm,年均气温18.3 ℃[24]。土壤以山地黄壤和紫色土为主(本研究所在区域属山地黄壤)。该区处于西南丛生竹林区,江南混合竹和西南高山竹的分布交界区。研究地点的毛竹林是我国毛竹林成片分布西北缘,林下优势植物有红盖鳞毛蕨(Dryopteriserythrosora)、芒萁(Dicranopterisdichoyoma)、狗脊蕨(Woodwardiajaponica)、乌蕨(Stenolomachusanum)、亮毛蕨(Acystopterisjaponica)、千金子等(Leptochloachinensis)[25]。
2 研究方法
2.1 试验设计
2016年11月采用随机区组试验设计[24],在长势健康的毛竹林设置4个区组,每个区组随机安排对照处理(CK: control)、氮添加处理(N: N addition)、磷添加处理(P: P addition)和氮磷添加处理(N+P: N and P addition)。4个处理安排在4个区组内,共4个重复,共计16块样地。每个样地面积为20 m × 20 m,样地间至少预留5 m缓冲带。同时为防止毛竹鞭根生理整合效应,在每个样地周围埋入0.3 cm厚、80 cm宽的PVC软板。翌年4月在每块样地冠层下空地随机选择3个1 m × 1 m样方进行深60 cm壕沟断根处理(Trench),去掉样方内灌草的地上部分,并用相同规格PVC软板插入以阻隔根系重新长入,整个试验期间保持壕沟样方内无活植物体。同年6月,采用林冠下自动喷灌方式进行外源氮磷添加。其中,N添加量依据我国亚热带地区实际氮沉降量和未来增加趋势设置高氮浓度[26],P添加量参考Cleveland方法[27]按照其与N添加量的相同配比进行。N添加选用NH4NO3,添加量为10 g N m-2a-1;P添加选用NaH2PO4,添加量为10 g P m-2a-1,添加量在每年平均分成6次隔月进行添加。每次添加将NH4NO3或NaH2PO4溶解于100 L水中并通过自动喷施系统均匀喷洒于样地内,对照样地喷施等体积的水,以防止氮磷添加导致的水分效应。样地空间分布图和植被信息分别见图1和表1。
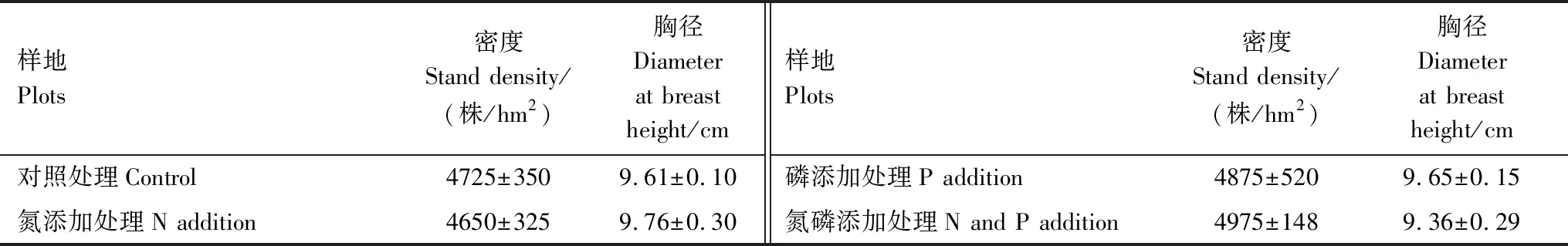
表1 样地信息
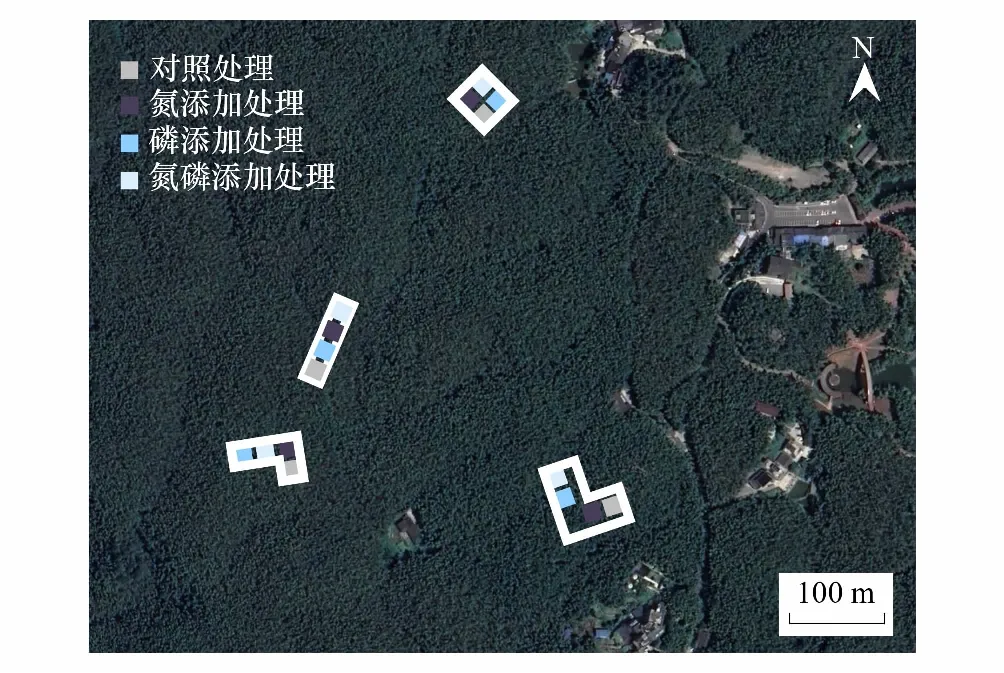
图1 样地空间分布图Fig.1 Spatial distribution of the plots
2.2 土壤样品采集和化学性质测定

2.3 土壤酶活性测定
采用荧光微平板法测定土壤酶活性[29]:把1.00 — 1.25 g鲜土加入125ml的醋酸钠缓冲液中(50 mmol/L pH=4.2),在搅拌机中均质1 min制成土壤悬液。将参与土壤C、N、P循环相关的共7种水解酶底物(表2)取50 μL加入已有200 μL土壤悬液的96孔微平板中作为样品控制,样品控制采用200 μL土壤悬液和50 μL酶底物,对照控制采用200 μL土壤悬液和50μL醋酸钠缓冲液,淬火控制为200 μL土壤悬液和50 μL标准底物,底物控制为200 μL醋酸钠缓冲液和50 μL酶底物。每个土壤样品的每种控制设置1列,共计8个孔。在25 ℃培养箱中暗培养3 h后加入5 μL NaOH(0.5 N)停止反应,并使用酶标仪(LAMBDA 35,PerkinElmer,USA)进行荧光扫描读数。

表2 土壤酶活性、功能和底物信息表
2.4 数据统计分析
根据German等人[30]方法计算AG、BG、BX、CB、NAG、AP和LAP活性,根据Moorhead等人[20]和Jing等人[13]方法进行土壤酶活性矢量分析,以明确土壤微生物受到碳限制还是养分限制。其中:矢量长度(VL,Vector length)表示土壤微生物碳和养分的相对限制,矢量角度(VD,Vector degree)表示土壤微生物N和P的相对限制,矢量角度>45°表示P限制,矢量角度<45°表示N限制。计算公式如下:
X=(BG+CB)/[(BG+CB)+AP]
Y=(BG+CB)/[(BG+CB)+(NAG+LAP)]
Vector length=SQRT(X2+Y2)
Vector degree=DEGREES(ATAN2(X,Y))
采用一般线性模型将氮添加(N)、磷添加(P)和根系去除(Trench)作为固定效应,将区组作为随机效应,检验氮磷添加和根系输入变化的主效应(N、P、Trench)及交互效应(N×P、N×Trench、P×Trench以及N×P×Trench)对未壕沟样地和壕沟样方土壤和细根化学性质、土壤酶活性、和土壤酶活性矢量特征的影响,采用Pearson相关分析分别检验未壕沟样地和壕沟样方土壤酶活性与土壤和细根化学性质相关性。以AG、BG、BX、CB、AP、NAG和LAP作为物种,使用Canoco 4.5进行主成分分析,并以土壤化学性质作为环境因子,使用Canoco 4.5进行冗余分析。所有统计分析均采用SPSS 17.0(SPSS Inc., Chicago, USA)进行。
3 结果与分析
3.1 氮磷添加和根系去除对土壤和细根化学性质的影响
氮添加处理(N)导致土壤碳磷比和氮磷比分别显著降低17.5%和16.2%(P=0.035,P=0.006)(表3),磷添加处理(P)导致细根全磷含量显著增加88.6%(P<0.001),二者交互作用(N×P)显著改变了细根有机碳含量(P=0.003),其中P处理降低了N处理对细根有机碳含量的促进作用。根系去除处理(Trench)导致土壤全氮含量和铵态氮含量分别显著降低33.6%(P=0.004)和66.0%(P=0.014),土壤全磷含量和碳氮比分别显著增加74.4%(P=0.008)和38.8%(P=0.001)。根系去除处理与氮添加交互作用(N×Trench)显著改变了土壤铵态氮(P=0.034)、土壤碳磷比(P=0.003)和土壤氮磷比(P=0.001),Trench处理抑制了N处理对土壤铵态氮的增加,但进一步增加了土壤碳磷比和土壤氮磷比。P处理与Trench处理(P×Trench)及二者与N处理的交互作用(N×P×Trench)对土壤和细根化学性质无显著影响(表3,图2—3)。
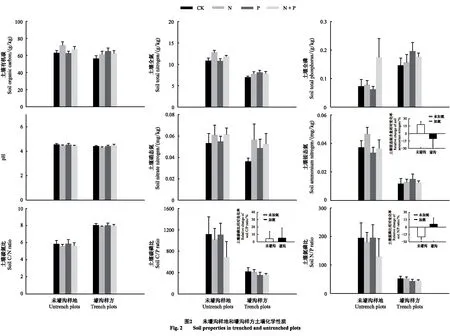
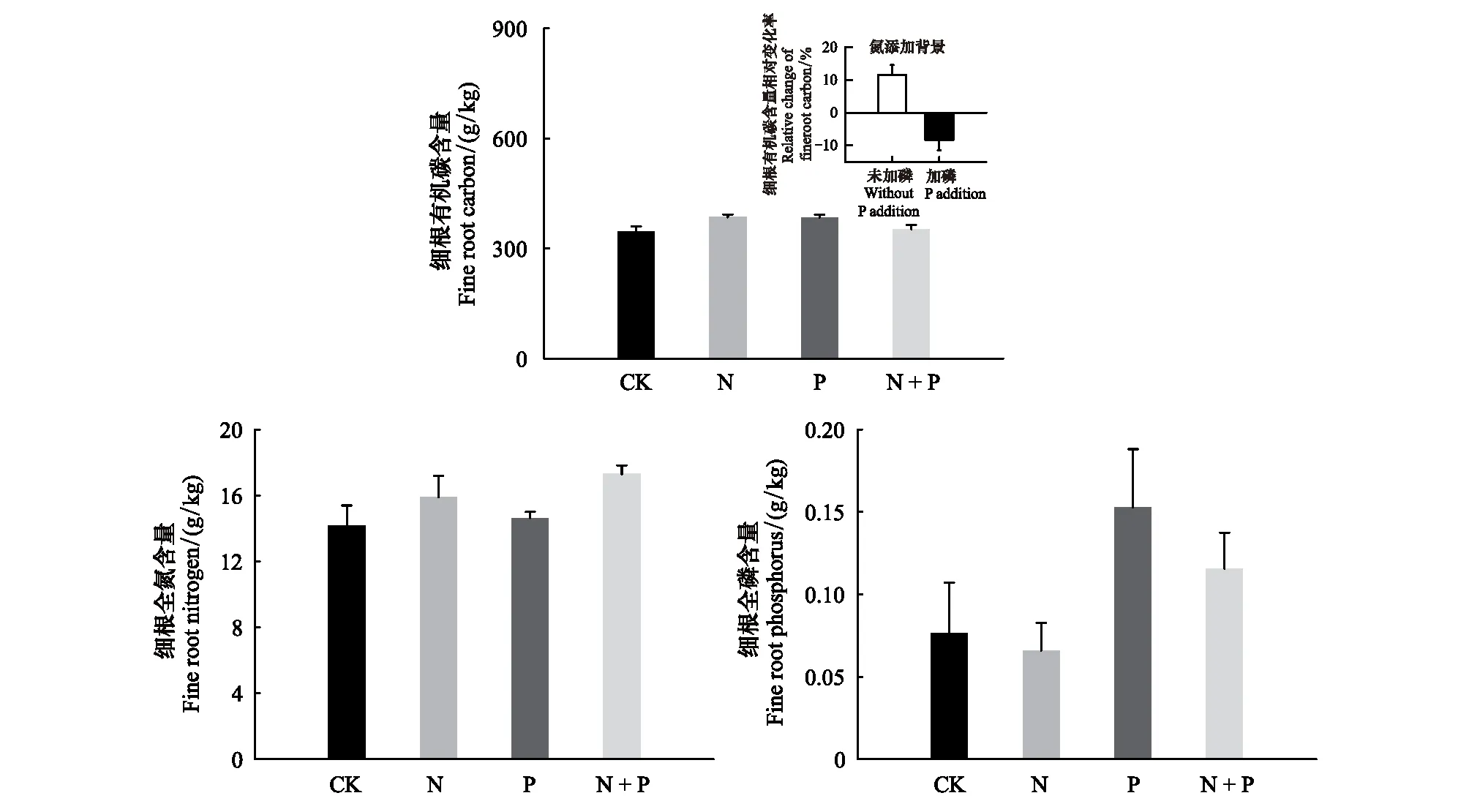
图3 不同处理细根化学性质Fig.3 Fine root properties in different treatments

表3 氮磷添加和根系去除及其交互作用对土壤和细根化学性质的影响(P值)
3.2 氮磷添加和根系去除对土壤酶活性和矢量特征的影响
N处理导致土壤α-糖苷酶(AG)活性显著增加了29.7%(P=0.048),P处理导致土壤酸性磷酸酶(AP)活性显著降低34.0%(P=0.004),二者交互作用显著改变了β-糖苷酶(BG)(P=0.032)和纤维二糖水解酶(CB)(P=0.002)活性,其中P处理降低了N处理对BG和CB的促进作用。Trench处理导致土壤AG、纤维二糖水解酶(CB)和亮氨酸氨基肽酶(LAP)活性分别显著增加了313.4%(P=0.003)、113.7%(P=0.023)和25.6%(P=0.020),AP活性显著降低了62.3%(P=0.024)。Trench处理与N处理(N×Trench)及其与P处理(P×Trench)的交互作用分别显著改变了AG(P=0.011)和AP活性(P=0.048),其中,与未壕沟样地相比,N处理在壕沟样方增加了AG活性而P处理在壕沟样方降低了AP活性。P处理和Trench处理分别导致土壤酶活性矢量角度显著降低4.7%(P=0.013)和11.1%(P=0.005),N处理与P处理交互作用(N×P)显著改变了土壤酶活性矢量长度(P=0.027)和角度(P=0.027),P处理将N处理对矢量长度的促进作用转为抑制作用,而将N处理对矢量角度的抑制作用转为促进作用。N处理与Trench处理交互作用(N×Trench)(P=0.036)及其与P处理三者交互作用(N×P×Trench)(P=0.032)显著改变了土壤酶活性矢量角度(表4,图4)。
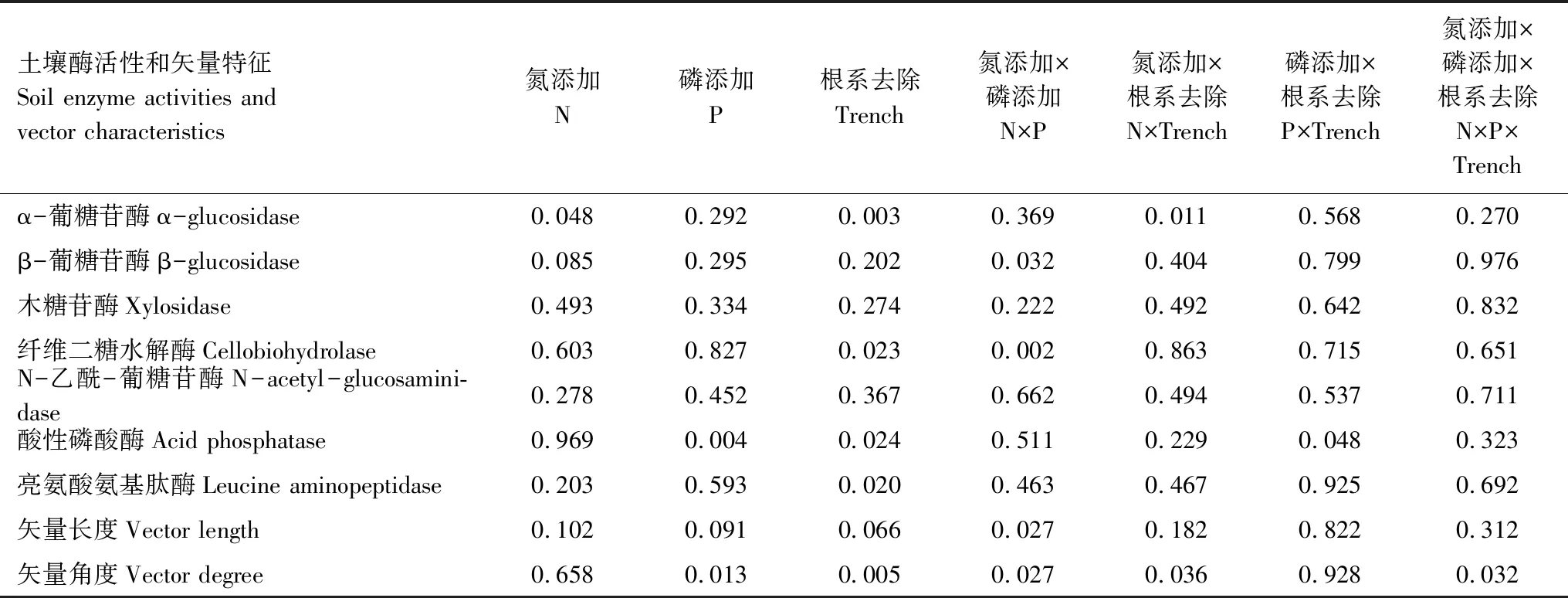
表4 氮磷添加和根系去除及其交互作用对土壤酶活性和矢量特征的影响(P值)
3.3 土壤和细根化学性质对土壤酶活性的影响
综合7种参与土壤C、N、P循环相关酶活性发现:未壕沟样地和壕沟样方以第一主成分轴显著分开,解释率为55.1%,而N处理与其他三种处理以第二主成分轴分开,解释率为30.8%(图5)。RDA分析发现:土壤化学性质共揭示土壤酶活性整体变异的93.6%,其中土壤碳氮比(P=0.001)、有机碳(P=0.007)、硝态氮(P=0.009)、铵态氮(P=0.026)和全氮(P=0.043)含量是影响土壤酶活性变异的主要原因(图6)。通过进一步相关分析发现(表5):在未壕沟样地,土壤养分含量(硝态氮和铵态氮)和细根化学性质(全氮和全磷)是影响土壤酶活性的主要因子;而在壕沟样方,土壤有机碳和全氮含量则是影响土壤酶活性的主要因子。
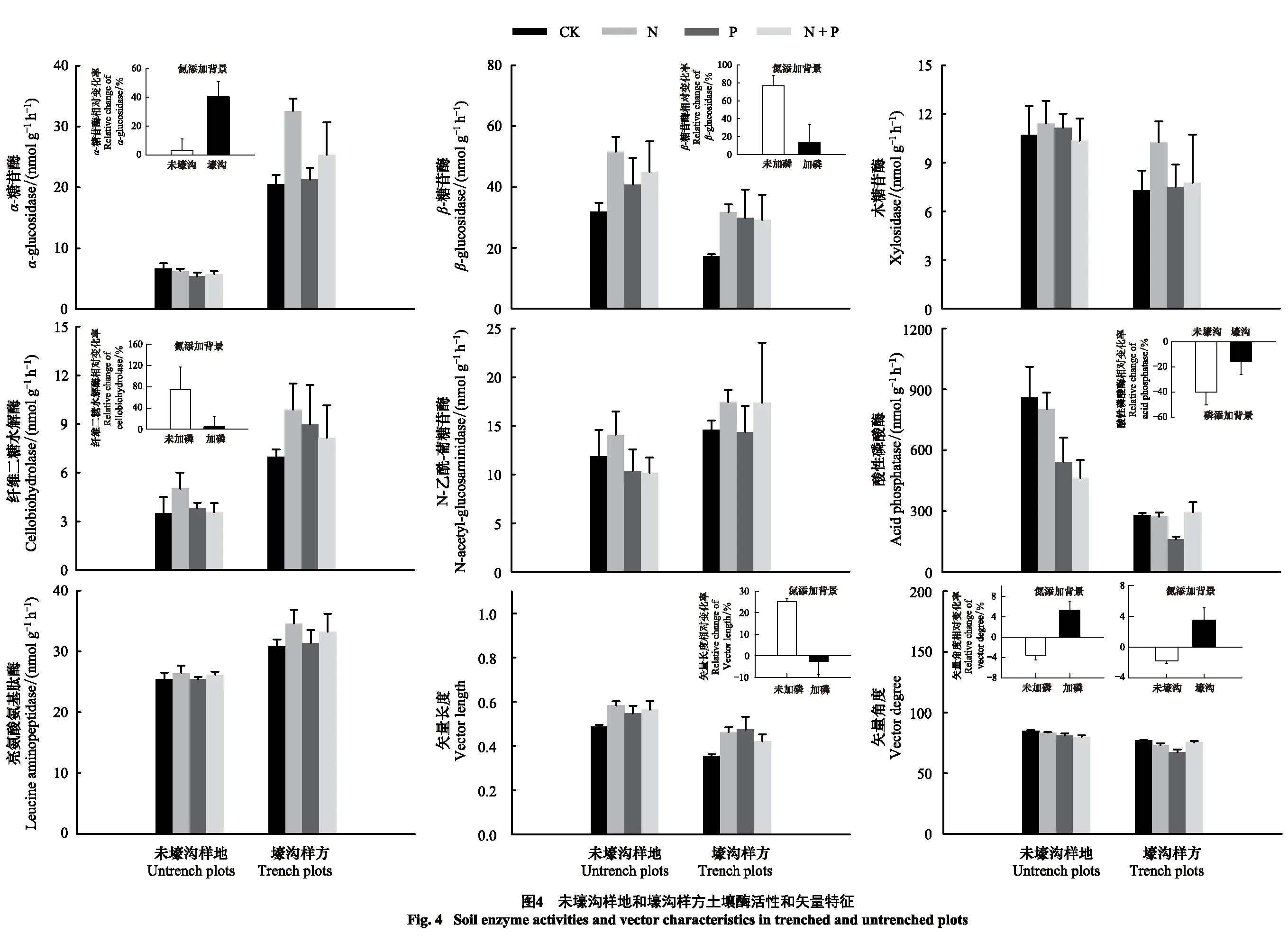
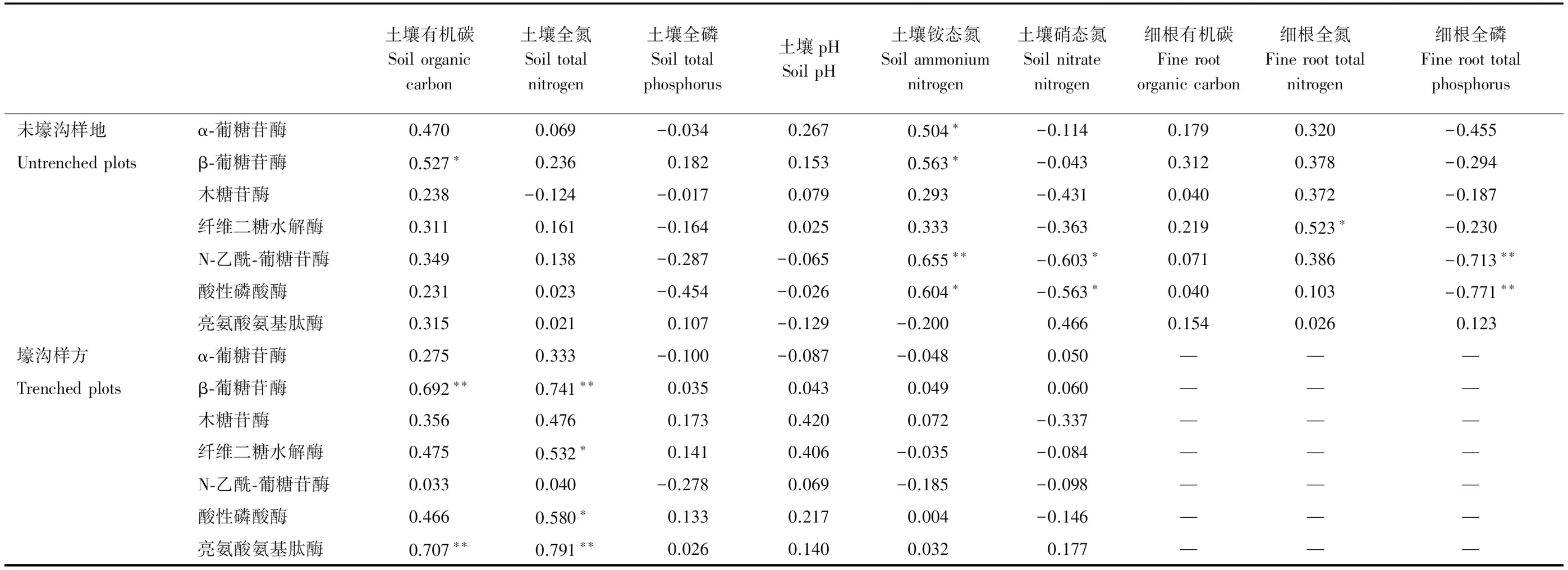
表5 土壤和细根化学性质与土壤酶活性相关分析
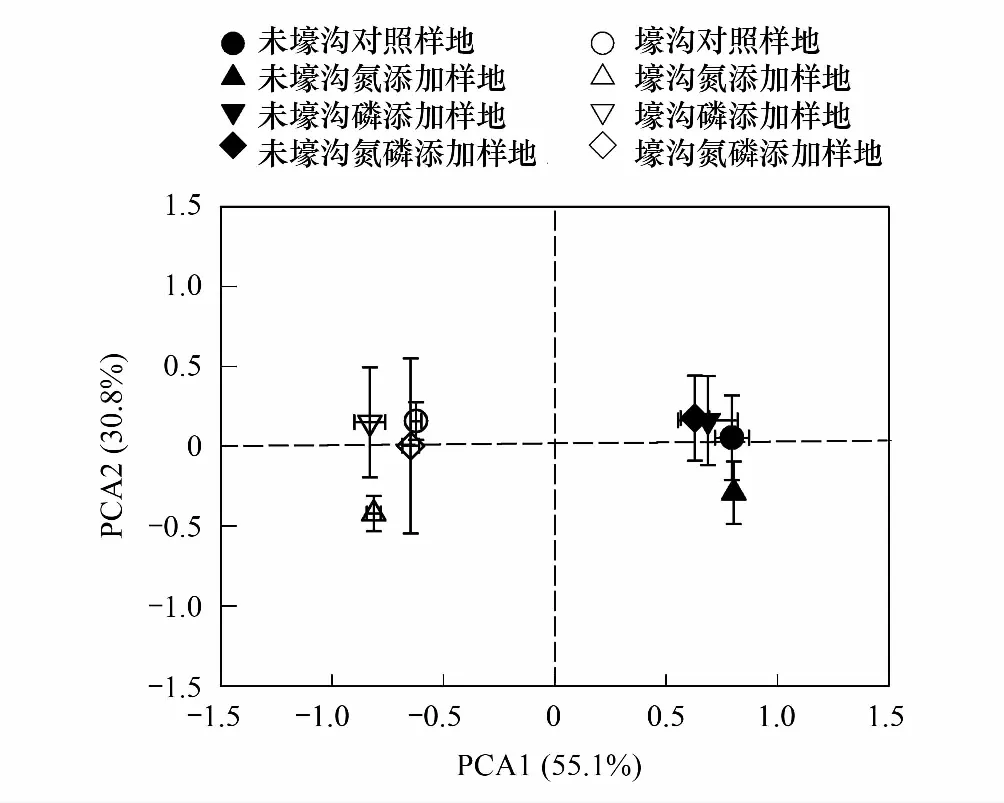
图5 土壤酶活性主成分分析Fig.5 Principle component analysis of soil enzyme activities

图6 土壤酶活性与土壤化学计量特征冗余分析(RDA)Fig.6 Redundancy analysis of soil enzyme activity and soil characteristicsAG:α-葡糖苷酶;BG:β-葡糖苷酶;BX:木糖苷酶;CB:纤维二糖水解酶;NAG:N-乙酰-葡糖苷酶;AP:酸性磷酸酶;LAP:亮氨酸氨基肽酶;TOCsoil:土壤有机碳;TNsoil:土壤全氮;TPsoil:土壤全磷;Soil C:N:土壤碳氮比;Soil C:P:土壤碳磷比;Soil N:P:土壤氮磷比;NO3:土壤硝态氮;NH4:土壤铵态氮;pH:土壤pH值
4 讨论与结论
4.1 氮磷添加对土壤酶活性的影响
氮添加和磷添加主效应对参与土壤C循环相关酶(BG、CB和BX)无显著影响(除AG外)。与Chen等人[31]研究一致,认为短期的养分添加尚未引起土壤C循环相关酶活性的改变[32]。与C循环相关酶活性响应相似,氮添加和磷添加主效应对土壤N循环相关酶活性亦未产生显著影响,这可能是因为在非N限制型生态系统继续添加N素(10 g N m-2a-1)超过了生态系统内植物和微生物对N的吸收[33],故对土壤氮循环过程无影响;此外,赵阳等人[34]研究亦发现短期磷添加尚未改变热带森林土壤氮循环过程。鉴于N获取策略的多样性及其与C循环过程的耦合关系,土壤N循环相关酶分泌将受到土壤底物数量、质量和微生物等多因素调控[31,35],这也会增加N循环相关酶对养分添加响应的不确定性,故养分添加未对NAG和LAP产生显著影响。与土壤C和N循环相关酶活性不同,磷添加主效应显著降低了AP活性。已有大量研究表明磷添加对土壤磷酸酶活性有显著的抑制作用[36—37]。这是因为P添加缓解了生态系统磷元素限制作用,降低了土壤微生物和植物对P的竞争性利用[36],因此土壤微生物和植物的协同互作关系会降低以获取磷为目的的AP分泌量。“资源配置理论”和“最优分配原则”认为养分添加会改变土壤酶活性,且优先分配给缺乏的资源以缓解土壤养分的限制作用[15, 20,38]。研究发现P循环相关酶活性比C和N循环相关酶活性对氮磷添加的响应更敏感,且AP活性远高于C和N循环相关酶活性。这可能是因为我们的研究区域属于P缺乏型生态系统[23],所以在C、N、P资源分配中优先满足用于磷酸酶的分泌,以保证在植物和微生物在低磷环境的生长发育。氮添加和磷添加二者交互作用显著影响了土壤BG和CB活性,主要表现为氮磷共添加降低了单一氮或磷添加对BG和CB的促进作用。这可能是因为单一氮或磷添加可能会相应造成磷和氮元素的限制作用,进而引发土壤微生物对有机质氮磷养分的开采作用[39—40],微生物在该过程中分泌更多的酶以降解大分子有机物并从中获取更多的能量和养分。因此,当氮磷共添加时,氮磷养分的协调供应可能会降低土壤微生物以养分开采为目的的酶产量。
4.2 根系去除对土壤酶活性的影响
与氮磷添加对土壤酶活性的影响不同,壕沟处理显著改变了土壤C、N、P循环相关酶活性(表4)。其中,根系去除显著增加了AG、CB和LAP的活性,但显著降低了AP活性(表4,图4)。作为土壤中重要的生物组分,根系通过自身周转和分泌物的形式向土壤提供底物以供微生物利用[41—42]。壕沟切断根系势必会降低细根周转和根系分泌物等活性有机碳输入,进而改变降解纤维素的CB活性和分解可溶性糖的AG活性[18,43]。根系去除引起土壤活性底物输入减少降低了土壤质量,增加了土壤碳氮比(表3,图2)。土壤微生物需要分泌更多的酶分解较难利用的底物以应对土壤质量降低,故导致AG和CB活性增加。RDA分析(图6)亦表明根系去除引起土壤碳氮比的增加是促使未壕沟样地和壕沟样方土壤酶活性产生分异的主要原因。土壤中含C底物输入的减少也会伴随着含N底物输入的减少[44],可以从壕沟样方中土壤全氮和铵态氮含量的降低得到验证(表3,图2)。土壤氮素状态作为调控LAP活性的重要影响因子[43],根系去除引起土壤全氮和铵态氮含量降低亦是影响土壤酶活性变异的主要原因(图6)。根系去除一定程度降低了土壤氮磷比(表3,P=0.055),增加了土壤氮限制作用,微生物需要分泌更多的LAP酶开采有机质中的氮素供吸收利用。与土壤C和N循环相关酶不同,根系去除显著降低了AP活性(表4,图4)。这主要是因为根系去除降低了根系对土壤中磷元素的吸收,进而间接增加了土壤中全磷含量(表3,图2)。在土壤中磷含量增加的情况下,土壤微生物会降低AP的分泌量以降低其对有机质中磷元素的开采作用[39],故壕沟样方中AP活性显著降低。
4.3 土壤酶活性变异的生物和非生物驱动因素
冗余分析表明除土壤碳氮比外,土壤有机碳、全氮、硝态氮和铵态氮含量也是影响土壤酶变化的重要原因(图6)。通过进一步的相关分析,发现土壤有机碳和全氮是影响壕沟样方土壤C、N循环相关酶(BG、CB和LAP)活性的重要因子,而在未壕沟样地,土壤养分含量(硝态氮和铵态氮)和细根养分含量(全氮和全磷)则是影响土壤C、N循环相关酶(AG、BG、CB和NAG)活性的重要因子(表5)。这可能是因为根系去除加剧了土壤底物输入的限制作用[17],故土壤底物性质(有机碳和全氮)主要调控酶活性变化;而在未壕沟样地内,土壤底物输入并非主要限制因子,毛竹细根和土壤微生物对养分的竞争作用可能造成土壤和细根养分在调控酶活性变化中的重要作用[43]。土壤酶活性对氮添加和磷添加的中性响应主要是因为短期的养分添加并未显著改变土壤有机碳、硝态氮和铵态氮含量(表3)。而根系去除显著降低了土壤全氮含量和铵态氮含量,故根系输入变化对土壤酶活性的影响整体上大于氮磷添加效应(表3和4)。
除土壤C和N循环相关酶活性外,我们发现磷添加和根系去除主效应及二者交互效应均显著改变了土壤P循环相关酶活性(表4),其中磷添加主效应和根系去除主效应均显著降低AP活性,但二者交互效应(P×Trench)则表现出在磷添加背景下未壕沟样地AP活性显著高于壕沟样方,说明毛竹根系可加剧土壤磷元素对微生物的限制作用,故未壕沟样地土壤微生物分泌更多的AP酶。这是因为外源养分添加的磷元素被毛竹细根吸收,磷添加主效应显著增加了毛竹细根全磷含量(图3)。我们亦发现未壕沟样地AP活性与细根全磷含量呈显著负相关关系(表5),磷添加在增加毛竹细根全磷含量的同时降低了AP活性,且壕沟样方磷添加使AP活性降低了73.4%,未壕沟样地磷添加使AP活性降低了58.4%(图3和图4),壕沟样方AP活性降低的更多说明毛竹根系和土壤微生物在对土壤中磷元素竞争性利用中具有优势,因此当有毛竹根系存在时,土壤微生物仍需分泌更多的AP以保证对磷元素的需求。此外,磷添加主效应和根系去除主效应均显著降低矢量角度,但矢量角度仍大于45°(图4),说明短期磷添加和根系去除一定程度缓解了磷缺乏[32],但研究区毛竹林生态系统土壤微生物仍然受到磷限制作用。这也进一步验证了研究区毛竹根系比土壤微生物具有更强的磷竞争能力,因此短期磷添加并未彻底改变土壤微生物的磷限制作用。
短期氮添加和磷添加对毛竹林土壤C、N循环相关酶活性影响较小,但根系去除显著改变了土壤C、N循环相关酶活性。其中,土壤有机碳、全氮和铵态氮含量对短期氮添加和磷添加的中性响应是土壤C、N循环相关酶活性无变化的主要原因,而根系去除降低土壤全氮和铵态氮含量则是调控土壤酶活性变异的主要原因。短期磷添加和根系去除虽显著降低了土壤P循环相关酶活性,但研究区土壤微生物仍受到磷限制作用。这主要是因为在磷缺乏的毛竹林生态系统中,毛竹根系比土壤微生物具有更强的磷吸收能力。在磷缺乏的毛竹林生态系统中,土壤C、N、P循环相关酶活性对土壤环境因子(氮磷养分添加)和生物因子(根系去除)变化的响应具有不同的敏感性。因此,应注重区分环境和生物因子协调调控的土壤酶活性变异,以进一步认识不同功能土壤酶在参与调控土壤碳和养分循环中的作用。

