泡球蚴肝门静脉注射感染小鼠方法的建立
郭宝平,田梦潇,吴川川,张 耀,武 娟,李 军,郭 刚,齐文静,任 远,张文宝
(1.新疆医科大学第一附属医院临床医学研究院,乌鲁木齐 830011;2.新疆医科大学基础医学院,乌鲁木齐 830011;3.新疆农业大学动物医学学院,乌鲁木齐 830052;4.新疆医科大学 省部共建中亚高发病成因与防治国家重点实验室,乌鲁木齐 830011)
泡球蚴病(alveolar echinococcosis,AE)是由多房棘球绦虫(Echinococcusmultilocularis)的幼虫-泡球蚴感染引起的致死性寄生虫病[1],在肝实质内呈弥漫性浸润生长。AE是寄生于人体的一种严重的人兽共患寄生虫病,主要分布在北半球[2-3]。实验室前期发现,AE病人病灶中持久的的炎症反应导致肝坏死,坏死病灶直径可达15~20 cm,出现明显“包囊”的形状,病灶可以使肝脏完全丧失功能,是病人死亡的主要原因[4]。
目前,泡球蚴的动物感染模型,主要是通过腹腔接种实验动物建立的,然而该方法不仅感染率低、死亡率较高,而且原头蚴(Protoscoleces,PSCs)及生发层细胞大部分附着在腹腔生长发育,肝脏仅感染少部分注射的PSCs及生发层细胞[5-6],不能准确计算PSCs的感染量,更不能很好地反映肝脏原发病灶的生长发育情况,以及感染泡球蚴后肝脏的免疫机制,仅能用于传代保种[7-9]。本实验采用肝门静脉注射方式建立了稳定的动物感染模型,采用这种方法不仅能准确定量注射的PSCs数量,并且术后实验鼠成活率较高。
1 材料和方法
1.1 伦理审查 本研究获得了新疆医科大学第一附属医院实验动物使用与管理委员会的批准(批准号为:IACUC-20180329-16),所有的实验及样本取材过程均符合新疆医科大学第一附属医院实验动物伦理委员会要求,并且所有实验均严格遵循动物实验的相关伦理学标准。
1.2 材料 C57实验小鼠购自中国维通利华公司;PBS购自美国Thermo Fisher公司;多聚甲醛购自中国Biosharp公司;二甲苯和无水乙醇购自中国福晨化学试剂有限公司;盐酸乙醇,实验室自配,99 mL无水乙醇中加入1 mL浓盐酸,密封备用;石蜡购自德国Leica 公司;中性树胶购自中国上海标本模型厂;伊红和苏木素购自中国中衫金桥公司;Masson染色试剂盒购自中国福州迈新生物技术开发有限公司。
1.3 PSCs的分离及活性检测 取经腹腔感染泡球蚴的昆明(Kunming,KM)小鼠,颈椎脱臼处死后,浸入75%乙醇中,进行体表灭菌3 min。用灭菌的剪刀打开腹腔,再用剪刀和镊子将腹腔的泡球蚴组织取出,置于无菌平皿中,用生理盐水冲洗2~3次。用剪刀将泡球蚴组织剪碎,置于平皿内,取一部分组织放入研钵中,用杵捣碎,研磨,加入5 mL生理盐水,先用单层纱布过滤至50 mL离心管中,自然沉淀5 min,去掉上清液,沉淀用70目的尼龙网过滤至50 mL离心管中,再自然沉淀。将沉淀置于培养皿中,不断用巴氏管吹打搅拌液体周围,使培养皿中的混合物形成湍流,最后分成三层,内层为包囊及宿主脏器碎片,中间层为淡黄色的PSCs,外层为钙质。用巴氏管将中间层的PSCs吸到另一个培养皿中。重复吹打分离3次以上。将收集的PSCs合并,加入终浓度为1%的胃蛋白酶(pH2.0)中,37℃消化15~30 min,每5 min观察一次,当发现无杂质或非常少时即可停止消化(图1)。消化结束后用生理盐水再洗3~5遍,以去除角质层碎片和未成熟或活力不好的PSCs[10]。取一定量消化后的PSCs于1.5 mL EP管中,以0.1%的亚甲基蓝染色1 min后弃去染液,用PBS洗1~2遍,弃去上清液。将沉淀置于载波片上,在显微镜下观察PSCs的活性、形态、数量并计算活力[6]。
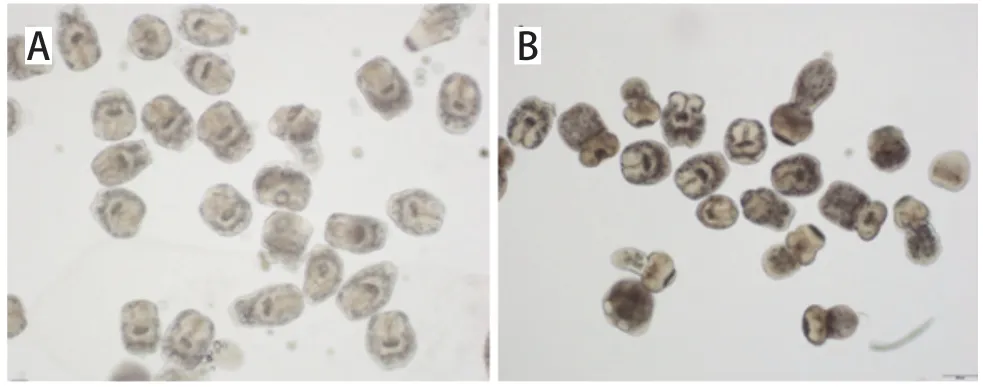
图1 胃蛋白酶消化前后的PSCsFig.1 PSCs before and after pepsin digestion
1.4 PSCs经肝门静脉注射感染小鼠方法 根据感染小鼠模型的时间效应和致病力的大小,设3个时期,分别为1个月(M)、3个月和6个月,同时设对照组(CON组)。将实验小鼠开腹后,经肝门静脉注射2000个PSCs,CON组注射200~300 μL生理盐水。具体操作如下:小鼠在手术前12 h禁止给食,麻醉前1 h禁止给水。实验鼠称重,并用推子剃掉腹部被毛,防止术后感染。用10%水合氯醛麻醉剂(原浓度:0.1 g/mL)对小鼠进行腹腔注射麻醉,将等体积的10%水合氯醛与0.9%生理盐水混匀后,每只实验小鼠按6 μL/g体重进行注射[11]。大约20 min后,当小鼠不能自由翻身并处于昏迷状态时将小鼠固定于解剖台上,碘伏消毒腹部。沿小鼠腹部正中剪开皮肤,用手术剪小心剪开真皮层,创口约为2~3 cm。将小鼠肠、胃等暴露出来,在近肝端可见颜色较深且粗的静脉血管(图2),即为肝门静脉,稍提肝门静脉前端的脂肪组织,使用24 G的头皮针穿刺,透过静脉管壁可看到针头。按照2000/100 μL PSCs的浓度,混匀后注射100 μL的悬浮混合物后,再注射总体积100~200 μL盐水以冲洗头皮针内残留的PSCs,使PSCs混合物总体积达到200~300 μL。注射完成后迅速拔出针头,用半干的棉签压迫止血1~2 min,将小鼠所有器官回归原位。由于手术过程中,小鼠腹腔会少量失水,因此缝合前需要给小鼠腹腔注射少量生理盐水。用可吸收缝合线缝合创口处,4~5针即可,用碘伏消毒缝合处,将小鼠放回笼内,置于23℃的加热台上或电热毯上,上下各垫一层纱布以保持体温,并注意监测小鼠体温,笼中保持干燥,无积水或粉尘,防止小鼠误吸窒息。悉心饲养,每日观察记录。

图2 小鼠肝门静脉注射感染方法示意图Fig.2 Sketch map of PSCs infection by hepatic portal vein injection
1.5 肝脏组织标本包埋和切片观察 于感染后不同时间处死并剖检实验鼠,观察并记录肝脏表面病灶,再将肝脏组织固定、包埋、切片、展片、烤片和HE染色等步骤[6]。将切片置于100倍显微镜下,观察肝脏组织病理变化,随机选择5个无重复的视野,观察并记录每个视野的病理变化及PSCs的数量。
1.6 肝脏组织标本Masson染色观察 根据Masson试剂盒操作手册,将切片分别置于二甲苯Ⅰ和二甲苯Ⅱ中脱蜡10 min;再将切片依次放入100%、95%、85%、70%乙醇中,每次5 s,用蒸馏水冲洗残余的乙醇,用滤纸吸干多余的水分,再用干净的吸水纸小心擦去组织边缘多余水分,切记不可使组织表面干燥;滴加1滴染色液(试剂A),染色5 min,用蒸馏水冲洗残余的染液;滴加1滴磷钼酸(试剂C),染色5 min,甩干;滴加1滴苯胺蓝(试剂D),染色5 min,用蒸馏水冲洗残余的染液;滴加1滴分化液(试剂B),分化30~60 s(2次);以二甲苯Ⅰ和二甲苯Ⅱ透明约5 s,再用中性树胶封片并加盖玻片;在显微镜下观察肝脏组织纤维化染色结果,100倍视野下,随机选择5个无重复的视野,利用Olympus光学显微镜的cellSens扫描软件分析染色结果,计算每张切片阳性染色面积占总视野面积的比值[12]。
1.7 统计分析 用Graphpad Prism 7.0软件进行作图及统计分析,所有的计量资料均以mean±SEM表示,两组数据比较采用独立样本t检验方法。
2 结果
2.1 实验鼠术后成活率 肝门静脉感染小鼠后,小鼠手术存活率达到85.00%(34/40),能够保证后续实验的顺利进行。
2.2 病灶特点 小鼠感染后1个月,可以看到感染组实验鼠肝脏表面均存在不透明黄灰色点状病灶,整个肝脏充满了不透明黄灰色点状病灶,犹如“满天星”,直径约1 mm;感染后3个月,肝脏表面可见少量明显的、直径5 mm×5 mm大小的续绦期小泡[13],而对照组实验小鼠肝脏无任何明显病灶(图3a,3b)。
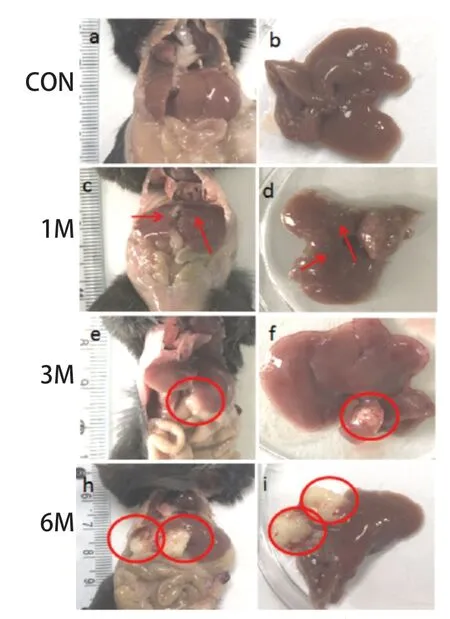
图3 小鼠感染PSCs后肝脏病变Fig.3 Liver lesions in different groups of mice infected with PSCs
2.3 成“泡”率 小鼠感染后6个月,感染组肝脏小“泡”比较明显,成“泡”率达到了50.00%,对照组则无明显变化(表1)。
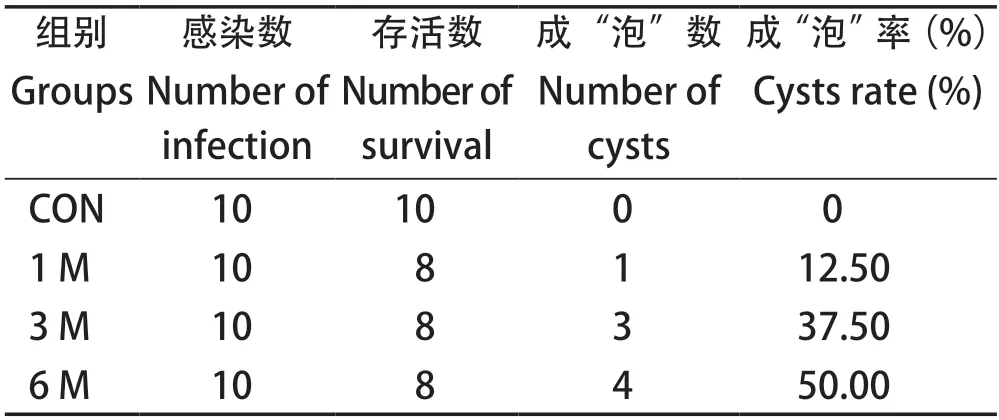
表1 肝门静脉注射感染实验鼠包囊数及感染率Table 1 The cyst number and infection rate of mice infected by hepatic portal vein injection
2.4 实验鼠肝脏病变 PSCs感染小鼠后不同时间,肝脏病理表型和病变程度在一定差异,结果如图4A所示。感染后1个月,仅发生纤维化反应,感染的肝脏局部坏死,肝小叶结构紊乱,汇管区有炎性细胞浸润,感染的肝脏未见成“泡”反应,仅可见少量点状炎性灶。感染后3个月,有纤维化反应伴有炎性细胞浸润,周围有大量的炎性细胞浸润;肝脏急性炎症反应增强,肝细胞肿大,汇管区有大量的炎性细胞浸润,包括淋巴细胞、巨噬细胞、浆细胞和嗜酸性粒细胞。感染后6个月,成“泡”感染的肝脏病灶继续向外侵袭性生长,可见病灶部位有明显的生发层结构,周围炎性细胞浸润进一步加重,纤维组织大量增生,并出现胆管增生,可见多个空泡状结构,呈多蜂窝状空腔,病灶内形成大量生发层,周围存在大量的慢性炎症细胞浸润,以淋巴细胞、单核细胞和粒细胞等为主;同时大量的小肉芽肿结节环绕,形成类似肿瘤样结节,并伴随大量的纤维化组织增生;在肝脏汇管区周围产生大量的纤维化反应,病灶呈现弥漫性纤维增生、大量的肝细胞被纤维组织包围缠绕,并且在炎性带周围有大量的肝细胞部分发生坏死。

图4 小鼠感染PSCs后肝脏病理变化(A)及病灶数差异(B)Fig.4 The changes of liver histology (A) and the number of lesions (B) in different groups of mice infected with PSCs
HE染色发现,PSCs感染小鼠后不同时期,肝脏病灶数量存在差异(图4B),其中6个月时候病灶数最多,1个月时病灶数最少。3个月时病灶数居中。不同时期病灶数的多少依次为6个月(32.75±7.98)>3个月(20.86±6.10)>1个月(13.25±1.83)>CON(0.75±0.88)。统计分析表明,6个月组与3个月组病灶数量差异显著(P<0.05),与3个月及CON组差异显著(P<0.05,P<0.001);3个月组与1个月组差异极显著(P<0.001),与CON组差异极显著(P<0.001);1个月组与CON组差异极显著(P<0.001)。
2.5 实验小鼠肝纤维Ⅲ型胶原酶(Collagen type ⅢalphaⅠ,COL3A1)的变化 使用Masson染色试剂盒对不同时期感染泡球蚴小鼠肝脏纤维化程度进行染色。结果发现,在1个月时感染的肝脏病灶存在少量的胶原纤维沉积,肝脏病灶周围炎性带也出现一定的纤维化发生;3个月时与6个月时感染的肝脏病灶附近有大量胶原沉积,一部分纤维组织延伸至小叶间,呈同心圆状排布,可见明显的纤维化病灶,主要以胶原沉积为主(图5A)。利用cellSens软件扫描分析显示,其中6个月时纤维化最严重,1个月时纤维化较轻,3个月时病灶数居中。不同时期病灶数的多少依次为6个月(28.04±15.48)>3个月(22.88±5.17)>1个月(8.58±3.89)>CON(0.65±0.18)。统计分析表明,6个月时与3个月时差异极显著(P<0.001),与3个月时及CON组均差异极显著(P<0.001);3个月时与1个月时及CON组均差异极显著(P<0.001);1个月时与CON组差异亦极显著(P<0.001)(图5B)。
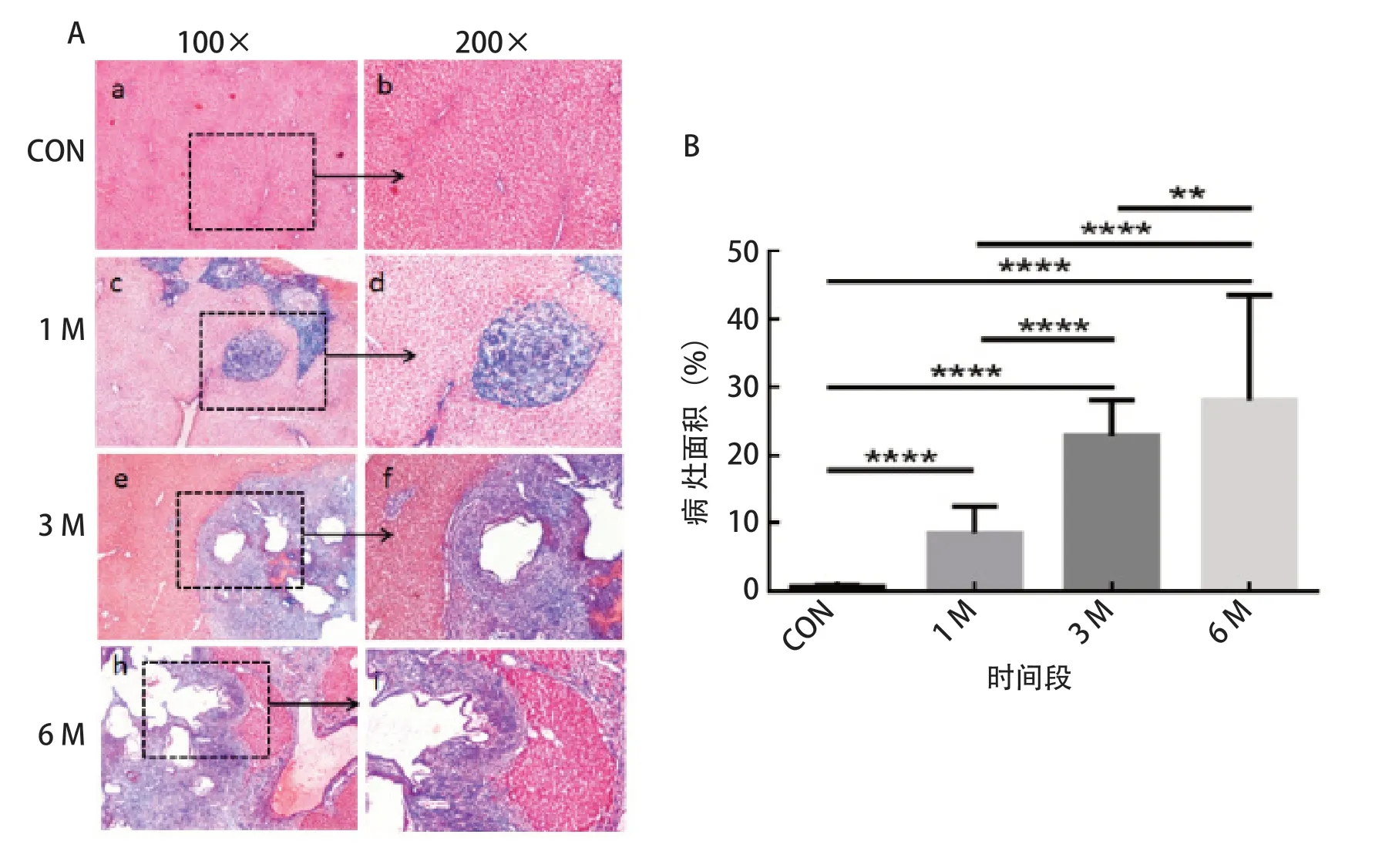
图5 不同组小鼠感染PSCs后肝脏纤维化程度(A)及病灶数差异(B)Fig.5 The changes of liver fibrosis (A) and the number of lesions (B) in different groups of mice infected with PSCs
3 讨论
目前已经报道的泡球蚴感染方法包括开腹直视肝脏穿刺法、腹腔皮下接种法、肝门静脉接种法、口服虫卵感染法及腹腔注射感染法等[14-15],除口服虫卵感染法外,其余均为继发感染模型,存在感染率低,死亡率较高,不能准确定量PSCs等缺点,并且这些方法不能用作动物模型来研究PSCs感染后肝脏的病理变化,更不能评价不同时间段PSCs致病差异的研究。虽然口服虫卵感染能模拟自然感染,且感染率较高,但是这种方法受虫卵、实验室条件及安全等因素的限制,不适合在实验室推广使用。先前已有肝门静脉实验[11,13],但是由于对分离的PSCs未做消化处理,注射的PSCs混有宿主和包囊组织碎片及大量活性不高的PSCs,造成宿主非特异性免疫反应,所以需用胃蛋白酶消化,去掉组织碎片及活性不高的PSCs[6]。本研究使用肝门静脉注射方式感染小鼠,成功建立了泡球蚴小鼠感染模型,该模型能较好地模拟原发感染和肝脏病理变化,可作为泡球蚴感染宿主免疫应答机制差异的研究,为包虫病在中间宿主肝脏免疫研究提供了一个非常稳定的动物模型。
本研究术后成活率较高,达到85.00%,成活率能保证后续是研究的开展,造成死亡的原因主要是术后出血,主要是门静脉穿刺后按压时间不够及缝合时造成穿刺部位再次出血造成死亡。另外,肠漏是造成死亡的一个重要原因,由于缝合线打结不紧以及两针之间距离较大,术后肠漏导致死亡。与腹腔注射相比,腹腔注射后,包囊在腹腔生长较快,感染3个月开始出现死亡,半年后已有20%以上的死亡率,加之腹腔为继发感染,所以无论从成活率以及感染方式上,肝门静脉感染非常适用于小鼠感染模型的建立。
实验鼠感染PSCs肝脏后,许多非常小的病灶聚集在一起,并向肝组织周围膨胀浸润,引起肝脏局部组织病变,例如肝纤维化、增生、变性、萎缩、坏死等[16-18]。在感染后的发展过程中,主要的病理变化是病灶周围纤维化及大量的炎症细胞聚集。在肝纤维化的形成过程中,当有炎症或者感染时,肝星状细胞(hepatic stellate cell,HSK)会被激活,最终分化为肌成纤维细胞,该细胞可分泌大量细胞外基质成分(extracellular matrix,ECM),包括COL3A1蛋白,同时使胶原酶的活性降低,造成细胞ECM的产生和降解不平衡,进而造成肝纤维化,COL3A1蛋白高表达,因此,COL3A1蛋白可以作为肝纤维化的标志物[18]。本实验选用COL3A1作为小鼠感染PSCs后肝脏病理变化的检测指标,结果表明:小鼠感染PSCs后,COL3A1表达量出现了不同程度的变化,并且变化的趋势一致,6个月时组肝脏病灶周围表达量最高,1个月时组表达量最低,与对照组相比,均出现显著性差异(P<0.05)。
小鼠感染PSCs后,会形成典型的肝脏病理变化,包括肉芽肿的形成及肝纤维化[13],在早期炎症的发生和发展中使感染的组织附近形成囊泡。在肉芽肿周围,胶原蛋白定位于肉芽肿周围并大量表达。在PSCs感染后,一般分为3种较为明显的反应:仅存在纤维化反应,伴有炎性细胞浸润及病灶肉芽肿伴纤维化[19-20]。与之前的研究相似[6,13],本研究发现大量的胶原蛋白在虫体病灶周围表达,并伴有纤维化和炎性细胞浸润,尤其是6个月时,有4只实验小鼠肝脏成“泡”样感染,成“泡”数量及成“泡”率高于其他实验组,在成“泡”的同时,病灶周围产生大量的肌动蛋白A(Actin alpha,smooth muscle aorta,α-SMA)及数量不等的病灶数。肉芽肿周围形成的胶原沉淀会影响的门静脉血液流动,从而诱发门静脉高压[21-22]。肉芽肿的形成是把“双刃剑”,一方面肉芽肿破坏、隔离PSCs的感染,另一方面使宿主肝脏组织受到破坏,导致大量的肝纤维化出现,并且在肝表面形成大量的病灶[23]。在感染进程中,肉芽肿变大的同时,炎症的数量细胞也在增加,并且大量的纤维细胞出现在病变的边缘,胶原纤维变得更长、更厚,尤其在成“泡”感染后,感染的组织周围尤为明显,肉芽肿在后期也比较多,在感染比较严重时,纤维化反应伴有大量的炎性细胞浸润;肝脏急性炎症反应增强,并且肝脏细胞肿大,汇管区有明显的炎性细胞浸润,包括Mφ、淋巴细胞、浆细胞和嗜酸性粒细胞[24-25]。胶原蛋白在病灶区包围并浸润到卵肉芽肿中,聚集在纤维化附近区域,并延伸到纤维间隔[25]。
综上所述,本研究从实验动物、注射方式,PSCs感染量、PSCs处理方式以及麻药剂量等相关因素探索了肝门静脉接种方法,成功建立了稳定的C57小鼠感染模型,为今后包虫病免疫学、分子生物学、药物筛选等后续研究的开展提供了基础。

