稳定表达PRRSV GP2蛋白的Marc-145细胞系的构建
乌东高娃,温永胜,郭 昊,刘春羽,赵洪哲,王凤雪,温永俊
(1.内蒙古农业大学兽医学院,呼和浩特 010018;2.内蒙古元山生物科技有限公司,呼和浩特 010018)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种高度传染性疾病,也是全球最重要的动物病原体之一[1-2]。其临床症状为母猪严重的繁殖障碍,断奶仔猪普遍发生肺炎、生长迟缓以及死亡率增加[3-4]。自从发现该病毒以来,在流行病学和分子学研究方面已经取得了重大进展,但是尚无有效的防治措施来消除这种病毒的感染[5]。在PRRSV中,全长单链基因组RNA的长度为15 kb左右,带有5'帽子结构和3'聚腺苷酸化尾巴结构。具有10个开放阅读框(ORF1a、ORF1b、ORF2a、ORF2b、ORF3、ORF4、ORF5、ORF5a、ORF6和ORF7),分别编码PP1a、PP1ab、GP2a、E、GP3、GP4、GP5、ORF5a、M和N蛋白,两侧为5'和3'非翻译区[6-9]。
GP2a蛋白由ORF2a编码,分子量为29~30 kDa[10],GP2a与GP2为同一种蛋白,只是不同文章的表述差异。GP2a为具有Ⅰ端信号序列和C端膜锚的推定的Ⅰ类整合膜蛋白,包含两个预测的N-糖基化位点[11]。PRRSV GP2通过二硫键和GP3、GP4在包膜表面组装形成同源或异源多聚体(GP2-GP3-GP4复合物),对于病毒进入易感宿主细胞至关重要[10]。与GP3、GP4等其他结构蛋白相比,GP2蛋白的异质性较低。它由预测的N端信号序列,168个残基的胞外域,一个跨膜(TM)螺旋和20个残基的内域组成[12]。
Bautista等[13]使用痘苗病毒为表达载体,验证了GP2多肽可以诱导T淋巴细胞增殖。Das等[14]研究表明小包膜糖蛋白GP2a和GP4与受体CD163特异性相互作用。Welch等[15]利用感染性基因克隆的研究缺失ORF2基因,发现GP2蛋白对病毒的复制必不可少。刘益民[16]发现GP2羧基端10个氨基酸的缺失,不影响重组病毒Marc-145细胞上的生长复制,也不改变重组病毒的中和抗原,推断GP2蛋白可能与PRRSV侵染宿主细胞和调控宿主免疫反应有关。
1 材料和方法
1.1 质粒和细胞 Marc-145细胞、HEK293FT细胞、慢病毒载体pLV-EF1a -EGFP-2A、pMD2.G质粒、pSPAX2质粒均由内蒙古农业大学兽医学院传染病实验室保存;Trans5α感受态细胞购自TOLOBIO公司。
1.2 主要试剂 PrimeSTAR®GXL DNA Polymerase购自TaKaRa公司;限制性内切酶、T4 DNA Ligase购自NEB公司;Plasmid Mini Kit、Gel Extraction Kit购自OMEGA公司;Lipofectamine 3000购自Invitrogen公司;TIANamp Genomic DNA Kit购自天根生化科技(北京)有限公司;细胞培养基DMEM、细胞培养基MEM、新生胎牛血清GIBCON FBS购自Invitrogen公司;胎牛血清FBS(CLARK)购自Bioscience公司;0.25%胰酶、0.05%胰酶购自Biological Industries公司。
1.3 重组慢病毒质粒的构建 根据慢病毒载体pLVEF1a-EGFP-2A序列选取单一的酶切位点NotⅠ和BamHⅠ,并根据PRRSV感染性克隆pJXwn06设计ORF2的特异性扩增引物:ORF2-F:5'-AAGGA AAAAAGCGGCCGCATGAAATGGGGTCTATGC AA-3',ORF2-R:5'-CGCGGATCCTCACCATGA GmTTCAAAAG-3',下划线为限制性内切酶识别位点。以感染性克隆pJXwn06为模板,通过特异性引物PCR扩增PRRSVORF2基因序列。PCR反应条件:94℃预变性2 min;98℃变性10 s,60℃退火15 s,68℃延伸50 s,35个循环;68℃再延伸7 min。扩增的PCR产物进行琼脂糖凝胶电泳,胶回收目的条带。将慢病毒载体pLV-EF1a-EGFP-2A以及胶回收产物用NotⅠ和BamHⅠ双酶切,胶回收酶切产物并用T4 DNA连接酶连接,转化于Trans5α感受态细胞,取100 μL涂布于氨苄抗性的LB培养平板。12 h后挑取单个菌落接种到液体培养基中进行摇菌,菌液提取质粒后进行双酶切鉴定,将鉴定正确的阳性样品进行双向测序。将测序正确的质粒命名为pLVEF1a-EGFP-2A-GP2。
1.4 慢病毒的包装 将HEK293FT细胞接种到T25小瓶,当细胞密度达到90%时进行转染。设置pLVEF1a-EGFP-2A质粒为阳性对照,按照Lipofectamine 3000试剂盒说明,将pLV-EF1a-EGFP-2A-GP2(10 μg)、pMD2.G(5 μg)、psPAX2(5 μg)三质粒共转染HEK293FT细胞,6 h后更换新鲜2%FBS DMEM维持液。观察48 h,收集病毒上清液后更换新鲜维持液,72 h再次收集病毒上清液。离心去除细胞残渣,于-80℃保存。
1.5 测定嘌呤霉素的杀灭曲线 嘌呤霉素在哺乳动物细胞上的推荐使用浓度为1~10 μg/mL,不同细胞嘌呤霉素的工作浓度也不同,因此需要杀灭曲线来确定。将Marc-145细胞接种到24孔板,12 h后弃掉原培养基,加入新鲜的不同浓度嘌呤霉素(1~10 μg/mL,共设置10个梯度浓度)筛选培养基进行孵育。根据细胞的生长状态,每2~3 d更换一次含有嘌呤霉素的10%FBS MEM培养基。每日监测细胞生长状态,观察细胞存活率,从而筛选4~6 d内有效杀死所有非转导细胞的嘌呤霉素最低工作浓度。
1.6 慢病毒转导和细胞克隆 将状态良好的Marc-145细胞接种到6孔板,当细胞密度达到80%时进行转导。将收集的慢病毒液放置冰上慢慢融化,弃掉6孔板中原有的培养基,加入混有1/2病毒原液的新鲜培养基感染细胞,37℃感染4 h,补齐培养基。24 h后弃掉孔内的原有培养基,加入新鲜维持液继续培养。感染48 h后弃去原培养基,更换为新鲜的含有嘌呤霉素的10%FBS MEM培养,每天观察细胞状态,待阴性对照的细胞全部死亡后终止筛选。将筛选出来的细胞制成细胞悬液,取样进行台盼兰染色和计数。取部分细胞进行有限稀释并加入96孔板,使细胞含量分别2个/孔、1个/孔和0.5个/孔。每天观察细胞克隆的生长情况,选择只有一个细胞生长的孔,弃掉两个以上和没有细胞生长的孔,两周后将生长状态良好的细胞扩大培养并传代,传至10代后对细胞系进行鉴定。
1.7 细胞系的PCR鉴定 将Marc-145 细胞作为阴性对照,用TIANamp Genomic DNA Kit提取Marc-145细胞以及细胞系的DNA并进行PCR扩增,鉴定ORF2基因是否成功整合到宿主细胞染色体。PCR 反应条件参考步骤1.3。将PCR扩增的产物混合10× loading buffer进行1%琼脂糖凝胶电泳,并使用凝胶成像系统检测分析结果。
1.8 细胞系的蛋白免疫印迹(Western blot)鉴定 本实验设置空载转染Marc-145细胞及Marc-145细胞作为对照。挑选PCR鉴定阳性的细胞系,用高效RIPA裂解液裂解,混合 5×loading buffer 高温煮样后进行12%的SDS-PAGE电泳,转移至 PVDF膜,5%脱脂乳室温封闭4 h,PBS洗涤3遍,GP2单克隆抗体(1∶1000倍稀释)37℃孵育2 h,PBST洗涤3次,每次15 min。HRP 标记山羊抗小鼠IgG(1∶2000 倍稀释)37℃孵育1 h,PBST洗涤3遍,每次15 min。用凝胶成像系统曝光并分析结果。
2 结果
2.1 重组慢病毒质粒的构建及包装 以pJXwn06为模板扩增ORF2基因序列并纯化回收。用NotⅠ和BamHⅠ双酶切纯化后的PCR产物以及pLV-EF1a-EGFP-2A载体,胶回收酶切产物后连接、转化、涂板、挑菌并进行摇菌,菌液提取质粒进行NotⅠ、BamHⅠ双酶切鉴定,并设置pLV-EF1a-EGFP-2A为阴性对照,双酶切得到约9452 bp和771 bp的条带(图1),成功获得重组的慢病毒质粒pLV-EF1a-EGFP-2A-GP2。将慢病毒pLV-EF1a-EGFP-2A质粒设置为阳性对照,将重组的慢病毒表达质粒pLVEF1a-EGFP-2A-GP2与辅助质粒pMD2.G、pSPAX2共转染293FT细胞。24 h后通过倒置荧光显微镜观察荧光,如观察到绿色荧光则表明慢病毒载体中GFP表达,慢病毒包装成功。

图1 质粒双酶切验证Fig.1 Plasmid double restriction digestion verification
2.2 嘌呤霉素杀灭曲线的确定 将Marc-145细胞接种到24孔板孵育过夜,弃掉原培养基并加入不同浓度嘌呤霉素(1~10 μg/mL)筛选培养基继续孵育。每日观察细胞的生长状态,每2~3 d更换一次新鲜的含有嘌呤霉素的筛选培养基。最终确定4~6 d内有效杀死非转导细胞的最低嘌呤霉素浓度为6 μg/mL。
2.3 慢病毒的转导及细胞系的筛选 将包装好的慢病毒颗粒转导Marc-145细胞,用6 μg/mL嘌呤霉素进行筛选,通过有限稀释法,将筛选后的细胞稀释到96孔板中,挑选只有1个细胞生长的孔继续孵育培养,两周左右细胞已克隆成团后可以扩大培养,成功筛选得到目的细胞株。
2.4 细胞系的PCR及Western blot鉴定 提取细胞系的DNA,PCR扩增ORF2基因序列,经琼脂糖凝胶电泳检测,结果显示在771 bp左右处有特异性条带(图2)。裂解细胞系,提取细胞系总蛋白并进行Western blot鉴定,经凝胶成像系统显示在28 kDa左右处有目的条带(图3)。PCR、Western blot鉴定结果表明成功获得稳定表达PRRSV GP2蛋白的Marc-145细胞系。
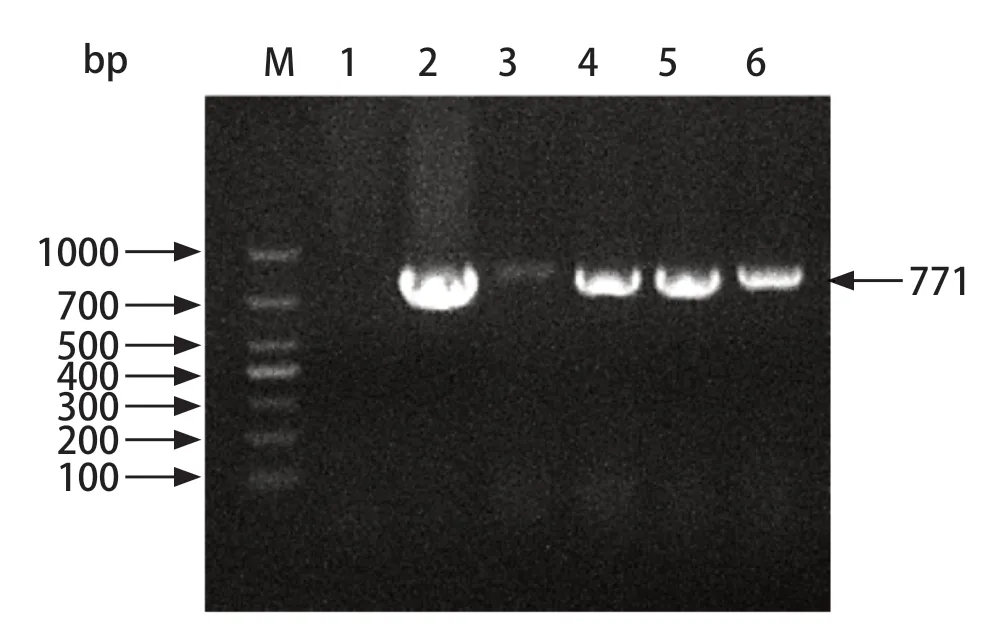
图2 PCR检测细胞系中ORF2基因Fig.2 PCR amplification of ORF2 gene in cell lines

图3 Western blot检测细胞系中GP2蛋白的表达Fig.3 Western blot detection of GP2 protein expression in cell lines
3 讨论
逆转录病毒载体是一种可用于人类基因治疗的有吸引力的工具。目前所应用的慢病毒属于复制缺陷型病毒,对分裂细胞和非分裂细胞均具有感染能力,慢病毒载体还可以将外源基因有效地整合到宿主染色体上,从而实现持久表达,是一种理想的用于筛选稳定细胞系的基因转移载体[17-18]。建立稳定的细胞系,在研究基因功能、药物开发等生物研究中具有重要作用[17]。
针对PRRSV相关细胞系的研究,Lee等[19]建立了可以稳定表达CD163的PAM细胞系,该细胞株完全允许1型和2型PRRSV株。这种允许PRRSV的PAM细胞系将不仅是促进病毒繁殖的重要工具,而且是推进病毒发病机理的体外研究的宝贵工具。Song等[20]构建了稳定表达N蛋白的BHK-21细胞系,同时构建缺失部分ORF7的PRRSV感染性克隆,通过反式互补成功拯救出复制缺陷型的PRRSV病毒。Pujhari等[21]利用星形孢菌素处理诱导了细胞的凋亡,发现Marc-2a细胞系中凋亡细胞的数量显著减少,推测GP2蛋白可能有抑制细胞凋亡的作用。
慢病毒过表达载体pLV-EF1a-EGFP-2A可以使EGFP蛋白和GP2蛋白在同一个启动子下表达,但互不影响分别发挥作用。因此我们可以通过观察细胞的荧光表达情况确定转染是否成功以及GP2是否整合到宿主染色体中。
在本研究中,我们旨在生成一组稳定的Marc-145-GP2细胞系,通过荧光显微镜观察细胞呈绿色荧光。利用ORF2特异性引物PCR扩增到ORF2序列,表明ORF2基因已成功整合到靶标染色体中。采用Western blot技术,利用GP2单克隆抗体证实GP2蛋白的恒定高水平表达。本试验成功构建了稳定表达PRRSV GP2蛋白的Marc-145细胞系,为研究PRRSV蛋白的结构功能,特别是研究GP2蛋白的免疫学特性和功能奠定了基础;同时为研制抗PRRS的新型复制缺陷型疫苗奠定了基础。

