猪流行性腹泻病毒上海株PEDV/CHSH/2019的分离鉴定及遗传分析
王 娜,纪立凯,王 建,严亚贤
(1.上海交通大学农业与生物学院 上海市兽医生物技术重点实验室,上海 200240;2.上海市动物疫病预防控制中心,上海 200240)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)是引起不同年龄段猪严重腹泻病的主要病毒性病原体,感染猪以呕吐、水样腹泻和食欲下降为主要病症,具有发病急、传播快、仔猪致死率高等特点[1-3]。我国最早于1984年发现PEDV在猪场中存在,随后暴发的猪腹泻病疫情中,PEDV均呈现出较高的阳性[4]。为防控PEDV的传播,PEDV疫苗被广泛使用并取得了较好的效果。2010年以来我国再次暴发猪流行性腹泻病,并呈现出不断扩散的流行趋势,给我国的养猪业带来了巨大的经济损失[5-6]。病原学调查发现PEDV基因组发生了突变,导致高致病性变异毒株出现,且存在地区间差异性,强毒株的出现降低了早期疫苗的保护效果,使得防控难度越来越大,严重威胁养猪业的健康发展[7]。基于目前对PEDV基因遗传变异研究,PEDV可分为G1和G2两个基因型。G1群是以CV777株为主的PEDV经典毒株,并可分为经典野毒株G1-a亚群和经典弱毒株G1-b亚群。G2群为近年的流行毒株,分为变异毒株G2-a亚群和重组毒株G2-b亚群。不同基因型在致病性、毒力以及交叉保护等方面存在差异[8-9]。因此,掌握我国各地区当前流行毒株变异情况,制备特异性疫苗成为防控PEDV持续传播的关键[10]。
本研究从2019年上海地区猪临床腹泻样品中成功分离了1株PEDV毒株,基于MEGA 7.0、BLAST等软件对该分离株与国内外流行毒株进行同源性比对和遗传进化分析该毒株的遗传变异情况,将为了解该地区流行毒株的变异趋势,制备高效疫苗和制定防控策略提供基础依据。
1 材料与方法
1.1 猪腹泻样品与细胞株 2019年2月采集自上海地区的临床猪腹泻PEDV阳性样品(粪便或小肠内容物),由本实验室置于-80℃冻存;非洲绿猴肾细胞系(Vero E6细胞)购自ATCC,由本实验室保存。
1.2 主要试剂 Gibco高糖DMEM培养基、Gibco 0.25%胰酶、磷酸盐缓冲液、胎牛血清均购自赛默飞世尔科技(中国)有限公司;反转录试剂盒购自Sigma公司;Primer STARTM聚合酶购自宝日医生物技术(北京)有限公司;凝胶回收试剂盒与无内毒素质粒抽提纯化试剂盒购自OMEGA公司;Alexa Fluor488标记山羊抗鼠荧光抗体、细胞核染料DAPI、免疫染色通透液(Triton X-100)、4%多聚甲醛均购自上海碧云天生物科技有限公司;抗PEDV S蛋白单克隆抗体由本实验室制备和保存。
1.3 病毒的分离及TCID50测定 将PEDV阳性的粪便和小肠内容物分别经无菌化处理后,接种至单层生长的Vero E6细胞,维持培养基含10 μg/mL胰酶,盲传3代后,将病毒液再次接种到Vero E6细胞,于37℃、5% CO2细胞培养箱中继续培养,每天观察细胞病变。收集病变明显的细胞样品反复冻融3次后,1500 ×g离心15 min,收集上清液,继续接种于Vero E6细胞连续传代培养。取扩增培养的PEDV上海分离株,利用含10 μg/mL胰酶的维持培养基将病毒按照10倍倍比稀释至10-11,每个稀释度设置8孔重复,以未感染的Vero E6细胞作为对照组,连续观察72 h,记录每个稀释度的病变孔数,利用Karber法计算病毒的TCID50。根据病毒的TCID50和细胞的计数,按照如下公式:MOI=(0.7×TCID50×V)/N(V:病毒体积,N:细胞数)计算获得病毒的MOI。
1.4 间接免疫荧光试验 (indirect immunoinfluscent assay,IFA) 将Vero E6细胞传代到12孔细胞培养板,待细胞长至单层,感染待检病毒24 h左右,在显微镜下观察细胞有明显的多合胞体病变现象且细胞未脱落,使用PBS轻柔清洗细胞板两遍,用4%多聚甲醛固定10 min,PBS轻柔清洗两遍,使用免疫染色通透液(Triton X-100)通透10 min,PBS轻柔清洗两遍,使用1%胎牛血清进行室温封闭1 h,抗PEDV S蛋白单克隆抗体4℃孵育过夜后使用PBS清洗4~5遍,常温孵育Alexa Fluor488标记山羊抗鼠荧光抗体2 h,使用PBS清洗4~5遍,DAPI染色2 min,弃掉染液加PBS在荧光显微镜下观察实验结果。
1.5 电镜观察 将感染PEDV的Vero E6细胞培养板反复冻融3次后收集细胞上清液,4℃、3000 ×g离心30 min,去除细胞碎片,收集上清液4℃,150 000 ×g冷冻超速离心3 h,离心完成后用ddH2O重悬沉淀,用磷酸钨负染后在120 kV透射电镜下观察病毒粒子形态。
1.6 全基因组测序及分析 以分离毒株的RNA为模板,利用逆转录试剂制备cDNA,根据GenBank上发表的PEDV的基因序列,分别设计了15对特异性PEDV引物序列(表1),对分离毒株进行全基因组分段扩增,将扩增得到的DNA产物利用胶回收试剂盒进行纯化,纯化产物连接pTOPO载体,连接产物转化到DH5α感受态细胞中,PCR鉴定为阳性的菌液送北京六合华大基因科技有限公司上海分公司进行测序。
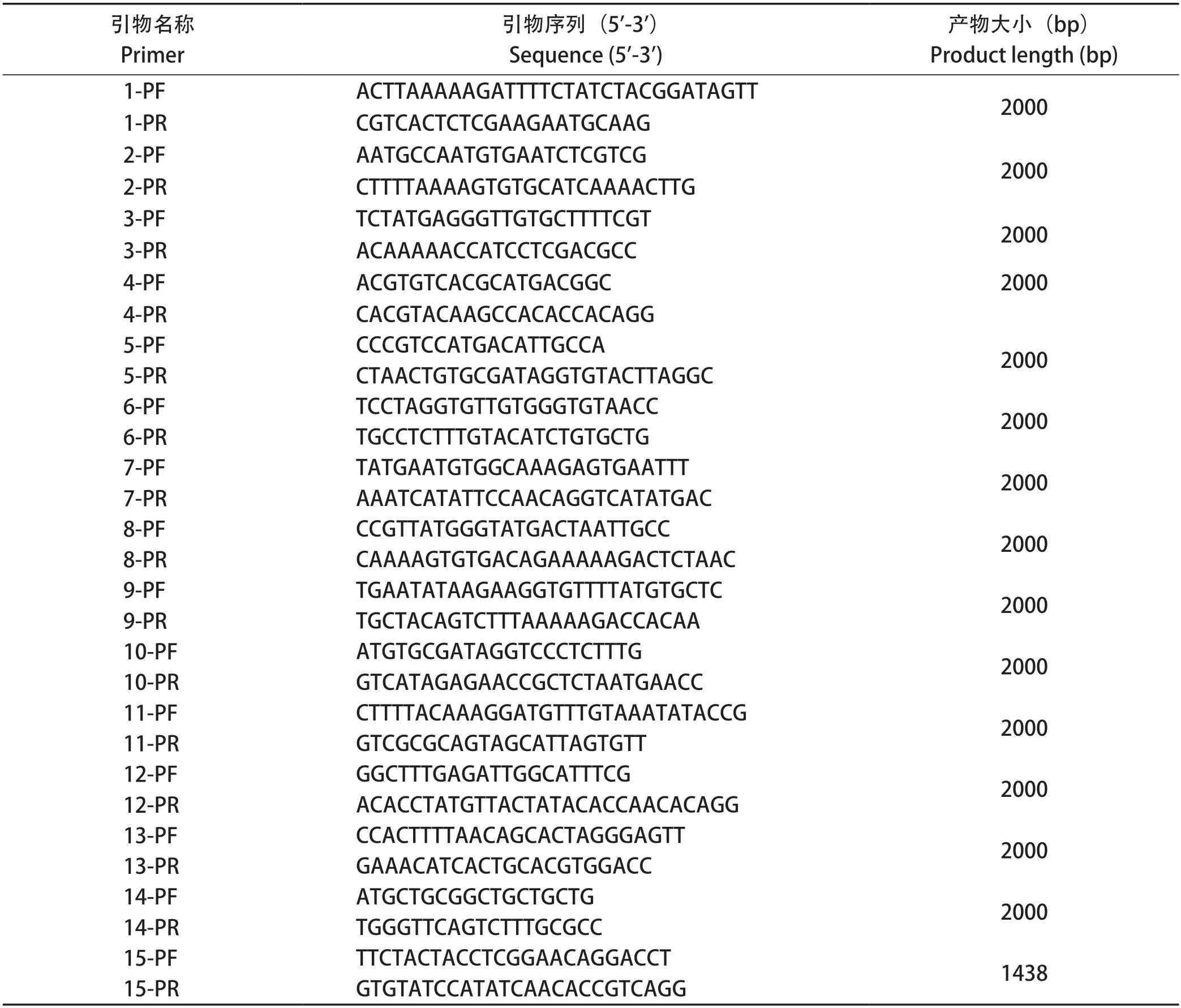
表1 扩增PEDV全基因组引物序列Table 1 The primers sequence of the whole PEDV genome
1.7 病毒的进化与变异分析 基于NCBI国内外PEDV流行毒株的基因组参考序列,利用Clustal Omega对全基因组核苷酸序列或S基因序列进行多序列比对,采用邻接法(Neighbor-Joining method)使用MEGA7.0软件构建系统发育进化树。基于S蛋白的多序列比对结果分析上海分离株的突变位点。
2 结果
2.1 病毒的分离培养与电镜观察 在长满单层的Vero E6细胞接种适量的病毒液感染一段时间后,在显微镜下观察,与未感染细胞比较,感染细胞可见明显的多合胞体病变现象,随着感染时间的增加,细胞脱落死亡。利用Karber法测定扩增后的病毒TCID50为10-6.25/0.1 mL。将病毒液经超速离心后,利用磷酸钨负染后,在120 kV透射电镜下观察,具有典型的冠状病毒粒子形态,直径为95~190 nm(平均130 nm)的病毒粒子(图1D)。以上结果表明该分离毒株为一种冠状病毒。
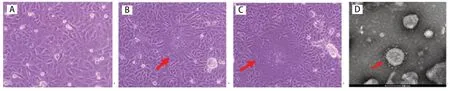
图1 PEDV/CHSH/2019株接种Vero E6细胞后产生的细胞病变及电镜观察结果Fig.1 The CPE of the PEDV/CHSH/2019 strain on Vero E6 cells and electron micrograph
2.2 IFA鉴定PEDV上海分离株结果 将分离的病毒分别按照MOI=0.05、MOI=0.1、MOI=1接种于Vero E6细胞,感染24 h后,利用间接免疫荧光方法检测PEDV S蛋白的表达水平。结果显示,未感染组细胞未见明显的细胞病变和荧光信号;随着感染剂量的增加,荧光信号增强,明场下观察到细胞融合形成的多核包体更加明显(图2)。进一步证实了该分离毒株为PEDV,并将其命名为PEDV/CHSH/2019株。
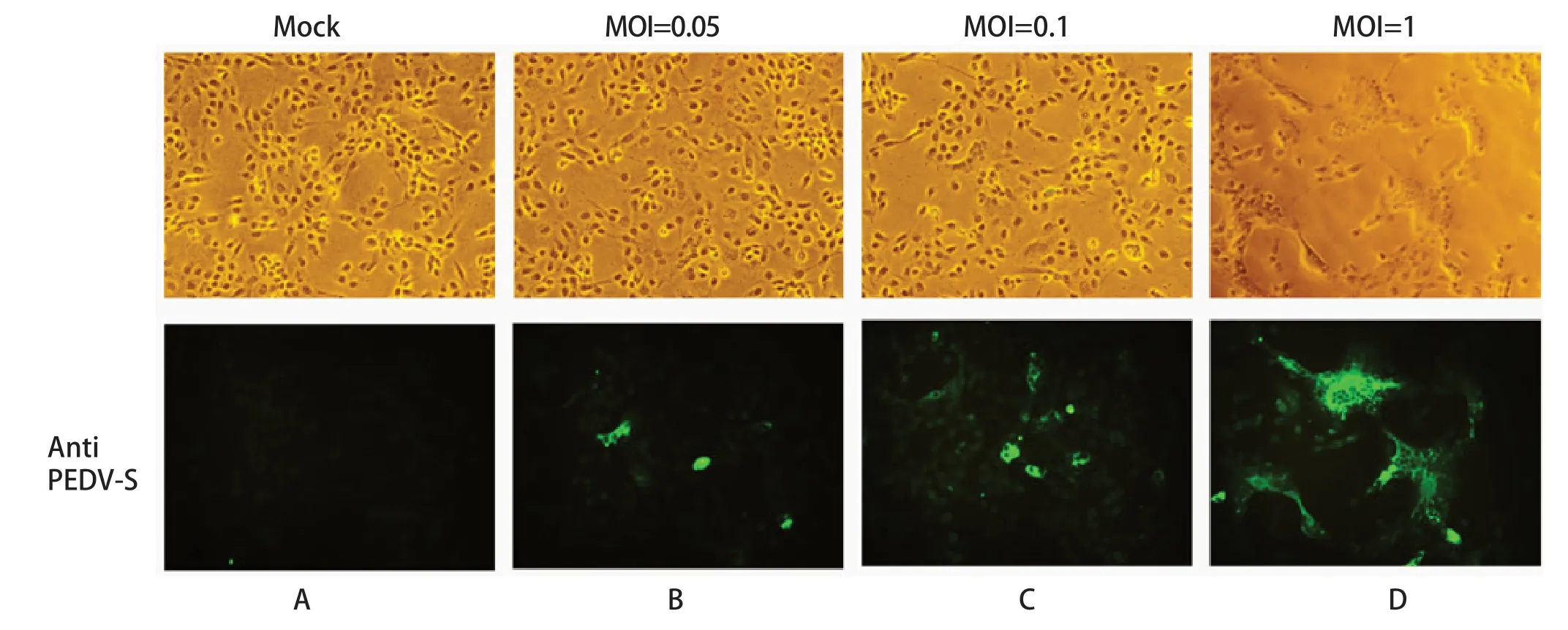
图2 PEDV/CHSH/2019株的间接免疫荧光检测Fig.2 Immunofluorescence assay of PEDV/CHSH/2019 isolate strain
2.3 PEDV/CHSH/2019株的全基因组测序及注释 本研究参考PEDV CHN/SH-2012毒株基因组序列,合成15对特异性引物对分离毒株进行全基因组分段扩增(图3)。将获得的片段经第二代测序后进行拼接,获得了PEDV/CHSH/2019毒株基因组全长为28 038 bp。如表2所示,完成了该毒株的全基因组注释,依次包含5'UTR-ORF1a/ORF1b-S-ORF3-E-MN-3'UTR。
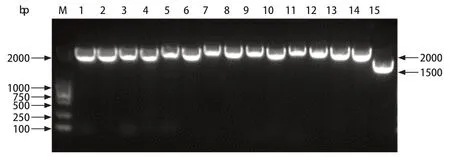
图3 PEDV/CHSH/2019各片段的RT-PCR扩增结果Fig.3 Amplification of all fragments of PEDV/CHSH/20191 by RT-PCR
2.4 基于PEDV/CHSH/2019全基因组及S基因的系统进化分析 参考国内外共34株PEDV毒株的基因组序列,利用MEGA 7.0软件构建基于全基因组序列的系统进化树。结果显示:PEDV/CHSH/2019位于中国近年来流行毒株分属一支,属于G2-b亚群,与该亚群参考毒株的同源性为97.71%~99.96%,其中与2012年上海地区的鉴定毒株CHN/SH-2012同源性为99.56%,而与CV777等经典毒株所属的G1群存在显著的分支差异(图4)。进一步基于不同毒株S基因序列,利用MEGA 7.0构建系统进化树。结果显示与全基因组进化分类具有一致性(图5)。以上结果表明,PEDV/CHSH/2019毒株与近年来国内外流行的PEDV强毒株亲缘关系较近,与早期经典毒株亲缘关系较远,是1株PEDV流行性强毒株。
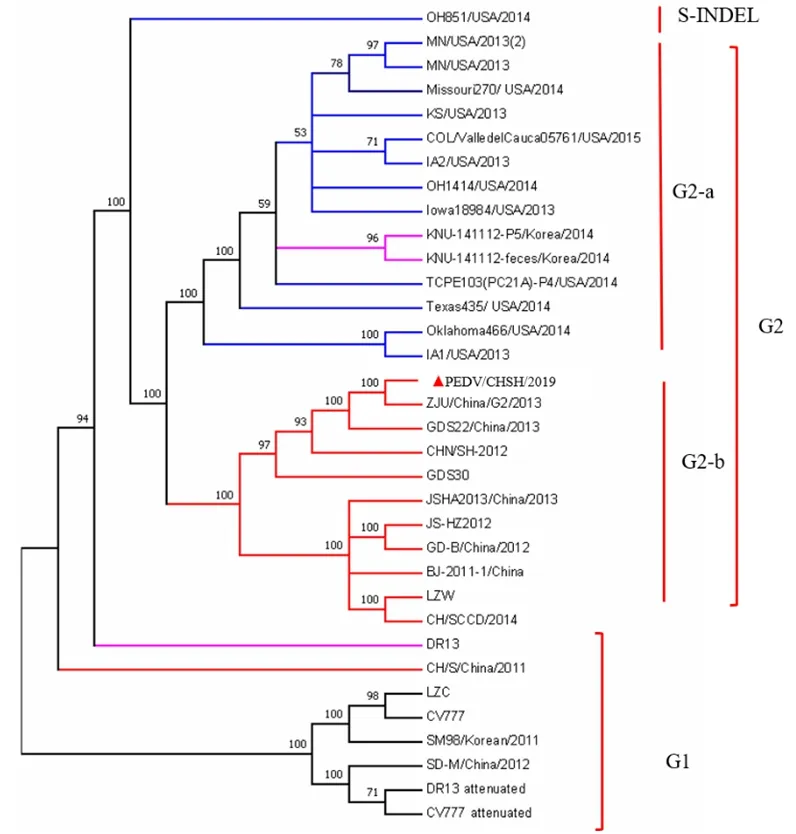
图4 PEDV/CHSH/2019株全基因组序列系统进化分析Fig.4 Phylogenetic analysis of the complete genome sequences of PEDV/CHSH/2019 strain
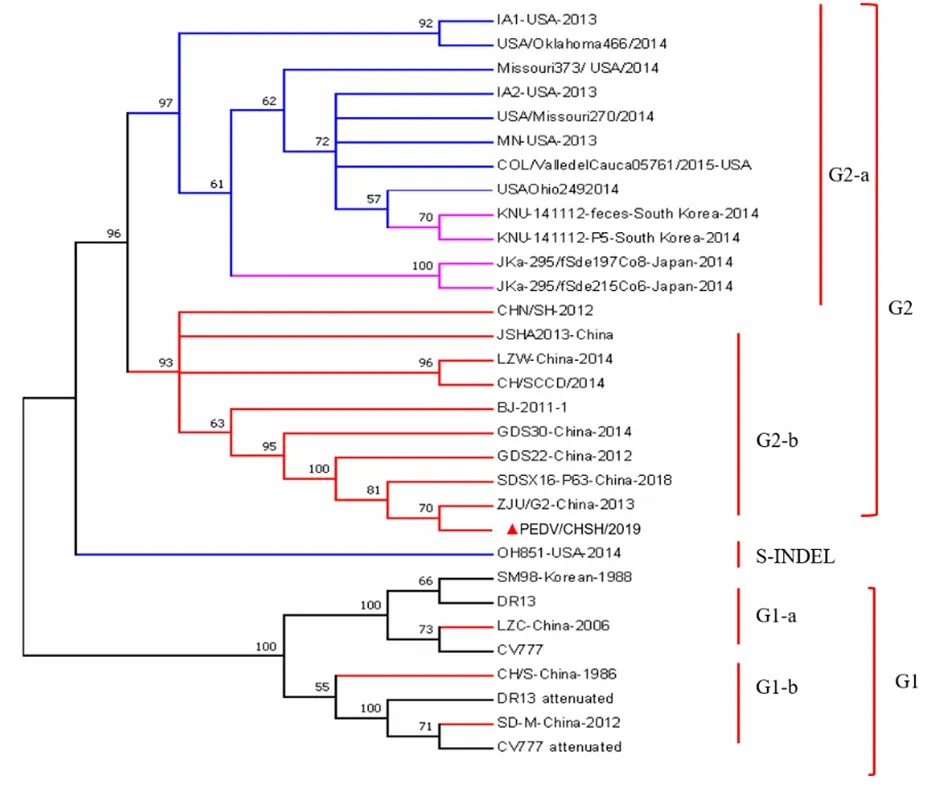
图5 PEDV/CHSH/2019株 S基因序列系统进化分析Fig.5 Phylogenetic analysis of the S gene sequences of PEDV/CHSH/2019 strain
2.5 PEDV/CHSH/2019 S蛋白的突变分析 PEDV S蛋白分为S1和S2两个亚基,其中S1位于病毒衣壳外侧,包含了病毒的主要抗原特征。因此,本研究对PEDV/CHSH/2019毒株S1亚基的氨基酸序列进行分析,结果显示:PEDV/CHSH/2019的S1蛋白与近年来中国、美国、韩国分离的变异毒株亲缘关系较近,S1氨基酸序列一致性较高,其中与中国地区目前流行株之间的同源性为97.82%~99.59%,与韩国、美国的流行毒株的同源性为98.77%~99.05%。基于同源序列比对分析发现,PEDV/CHSH/2019与较早时期的GDS30-China-2014存在多位点的氨基酸插入(第58~61位、第139位)和缺失(第161~162位);而与上海地区2012年流行性强毒株CHN/SH-2012相比,仅在第610位氨基酸发生了单点突变现象,且该位点突变后与其它地区流行的强毒株保持一致(表3)。这些变异毒株与经典疫苗株的S1氨基酸序列已有差异较大,亲缘关系较远,与CV777、DR13、LZC、CH/S等经典毒株的序列一致性较低为89.56%~92.58%,存在显著的插入、缺失以及单位点的氨基酸突变等变异(表3)。以上结果表明2019年上海地区PEDV流行毒株S蛋白发生了一定的突变,且与其他地区流行性强毒株序列趋于一致。
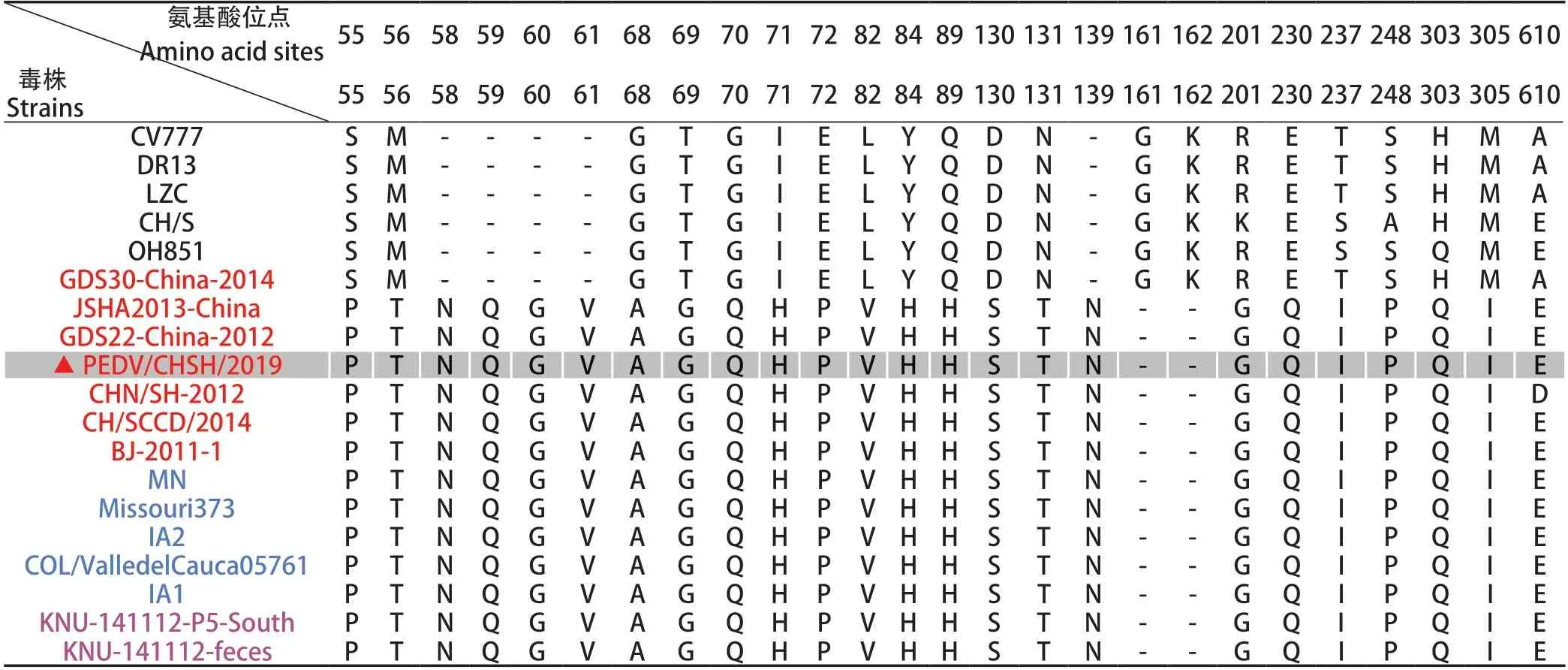
表3 S1亚基氨基酸突变位点分析Table 3 Alignment of amino acid sequences of S1 genes
3 讨论
PEDV是危害养猪业健康发展的重要病原体,近年来PEDV已在我国很多省份广泛流行,给我国养猪业乃至全球公共卫生事业造成巨大的损害和威胁[11-12]。本研究成功分离获得了上海地区最新的流行毒株PEDV/CHSH/2019,感染Vero E6细胞可引起明显的多合胞体样细胞病变,且能够被PEDV S蛋白的特异性单克隆抗体所识别,病毒效价较高可达10-6.25TCID50/0.1 mL。上海地区最新PEDV流行毒株的体外成功分离,为探究PEDV在该地区的毒株特征,制备特异性弱毒或灭活疫苗提供的材料基础。
基于全基因组多序列比对分析得出PEDV/CHSH/2019株属于G2-b基因型,与近年来国内流行的PEDV毒株亲缘关系较近,与PEDV国外流行毒株和经典毒株亲缘关系较远。该结果表明上海地区PEDV毒株可能源于其附近地区之间的交互传播。PEDV/CHSH/2019株与经典PEDV毒株进化上已有较大距离,表明其发生了较大的基因组变异,也是临床猪场中使用的常用疫苗保护效果不佳的原因。因此,应该根据上海地区流行毒株的特征选择进化关系最近的疫苗毒株实施免疫保护猪群。此外,由于PEDV传播途径多样,且与其他致猪腹泻病病毒(如传染性胃肠炎病毒和猪丁型冠状病毒)混合感染情况严重,增加了防控难度。因此,各猪场应严格执行生物安全防控措施,加强我国各地区之间生猪流通的防疫、检测,切断病毒传播途径。
冠状病毒S蛋白是识别宿主细胞受体蛋白的主要结构蛋白,它的变异往往与病毒毒力的改变密切相关[13-15]。PEDV S蛋白由S1和S2两个亚基组成,研究发现S1较S2更容易发生突变[16]。对PEDV/CHSH/2019株 S1蛋白的多序列比对分析显示S1蛋白与近年来中国、美国、韩国分离的变异毒株亲缘关系较近,而这些变异毒株与经典疫苗株的S1氨基酸序列已有差异较大,存在多处氨基酸突变和缺失(表3),这些突变和缺失可能会影响S蛋白的构象,以及病毒对宿主的致病作用,影响疫苗效果或引起免疫逃避,造成免疫失败,使得PEDV的防控难度不断加大。综上对上海地区最新流行毒株全基因组及S基因的变异分析,将有助于了解PEDV在该地区的遗传变异趋势,为特异性疫苗的研发提供理论依据。

