狂犬病、犬瘟热和犬细小病毒病三联灭活疫苗免疫效果评价
龚成燕,陈 杰,潘虹军,罗国良,刘梦佳,胡 博,赵建军
(1.中国农业科学院特产研究所 农业农村部经济动物疫病重点实验室,长春 130112;2.黑龙江八一农垦大学动物科技学院,大庆 163319;3.西北农林科技大学,杨凌 712100;4.吉林农业大学中药材学院,长春 130112;5.济南海关,济南 250200)
狂犬病是由弹状病毒科(Rhabdoviridae)狂犬病毒属(Lyssavirus)的狂犬病病毒(Rabies virus,RABV)引起的急性中枢神经系统症状的人兽共患传染病[1]。RABV可以感染几乎所有温血哺乳动物,对公众健康具有重大威胁,狂犬病造成死亡人类中99%以上是由感染家养犬咬伤造成的,目前国内犬类狂犬病发病率仍在不断上升[2]。犬瘟热是由副黏病毒科(Paramyxoviridae)麻疹病毒属(Morbillivirus)的犬瘟热病毒(Canine distemper virus,CDV)感染引起的一种热性、高度接触性传染病[3]。其自然宿主近些年来不断扩增,包括犬科、鼬科、浣熊科等,甚至可能具有感染人的潜在风险[4-5]。CDV通过口鼻入侵宿主,并迅速在淋巴组织中复制,引起感染动物严重的免疫抑制[6]。犬细小病毒病是由细小病毒科(Parvoviridae)细小病毒属(Parvovirus)的犬细小病毒(Canine parvovirus,CPV)感染引起的一种急性、致死性传染病[7]。犬细小病毒于1978年首次在澳大利亚和美国被发现,并在几个月内传播到世界各地[8],CPV主要感染幼龄犬,短时间潜伏期后可引起严重的出血性胃肠炎症状,白细胞显著减少为其临床特征,并具有高传染性和高致死率[9-10],对养犬业造成了较大的损失。
狂犬病、犬瘟热和犬细小病毒病严重影响着犬科动物的健康,目前解决这些问题最有效、直接的方法是疫苗接种。狂犬病活病毒疫苗通常比灭活疫苗能更好地保护犬[11],但弱毒活疫苗可能因毒力返强而致病,并对免疫系统不健全或抑制状态的犬造成潜在风险[12],基因工程疫苗研制周期较长且不能完全控制流行毒株[13]。1911年,Liu等[14]首次通过活体脑内增殖RABV,并用石炭酸做灭活剂来制备灭活RABV疫苗,后期发现在体外BHK-21细胞上繁殖RABV具有同等效力;1923年,Franke等[15]用感染犬的脑组织灭活后首次研制出犬瘟热灭活苗,但免疫犬不能有效抵抗CDV强毒株攻击,后期发现在Vero细胞上培养的减毒CDV免疫原性要高于组织灭活疫苗[16]。1981年,Smith等[17]首次用CPV灭活疫苗免疫犬,免疫犬虽获得攻毒保护,但不能完全阻止免疫犬排毒。随着CDV受体信号淋巴细胞激活分子(signaling lymphocytic activation molecule,SLAM)的鉴定,稳定表达犬SLAM受体的细胞系,如Vero/DogSLAM(VDS)细胞,可用增殖CDV弱毒株和野毒株,增殖后病毒效价大大提高[18-20],从而解决了CDV在体外细胞中增殖效价不高,制备灭活疫苗免疫原性低的问题。
在灭活疫苗中加入佐剂,可以延长疫苗的免疫保护期,促进机体特异免疫应答反应。目前,已研究的佐剂种类非常多,根据其来源可分为化合物和天然物两大类[21]。市场上犬用疫苗佐剂多为合成的水佐剂和油佐剂,有研究结果显示油佐剂疫苗相对于水佐剂疫苗,相同时间内,油佐剂疫苗免疫犬产生的抗体水平较低[22]。李敏等[13]制备的佐剂MONTANIDE GEL 01犬细小病毒灭活疫苗连续两次免疫幼犬后,有效抗体可维持5个月;舒秀伟等[23]发现铝胶(Al(OH)3)佐剂灭活疫苗(Flury株)免疫动物后能提高狂犬病病毒抗体效价,增强疫苗的免疫效果;张菲等[24]在制备猫用RABV灭活疫苗时采用特制的水包油佐剂,发现其可显著提高疫苗的免疫效力。
目前,我国商品化联苗中尚未有获批的狂犬病-犬瘟热-犬细小病毒病三联疫苗上市。尤其是狂犬疫苗,目前多为单独免疫[25-26],导致在免疫预防过程中需要重复对动物进行免疫接种,不但增加了工作强度,也容易造成动物的应激反应。犬瘟热疫苗多为弱毒疫苗,免疫原性虽高于灭活疫苗,但灭活疫苗相对活毒疫苗具有更好的安全性[27]。因此,本研究旨在通过比较不同佐剂对狂犬病-犬瘟热-细小病毒病三联灭活疫苗的免疫效果,从而开发出一种安全、有效的犬用三联灭活疫苗,可同时针对狂犬病、犬瘟热与细小病毒病三种犬病提供免疫保护。
1 材料与方法
1.1 细胞、病毒和实验动物 稳定表达犬SLAM受体的非洲猕猴肾细胞Vero/DogSLAM (VDS)、猫肾细胞(F81)和乳仓鼠肾细胞(BHK-21)由中国农业科学院特产研究所和黑龙江八一农垦大学保存。疫苗生产用CDV野毒株LN(10)1[28]、CPV强毒株JL(18)1-Beagle[29]、RABV弱毒株HEP-Flury[30]和病毒攻毒用CDV强毒SD(14)7株由国农业科学院特产研究所和黑龙江八一农垦大学保存鉴定[4]。实验用6周龄比格犬57只,由中国农业科学院特产研究所比格犬养殖基地提供。
1.2 主要试剂 胎牛血清、DMEM细胞培养基购自南京WISENT生物技术公司;ADJ-801(W)佐剂由河南通商进出口有限公司惠赠,MONTANIDE GEL 02佐剂购自上海SEPPIC生物技术公司,Al(OH)3铝盐佐剂购自吉林正业生物制品有限公司;灭活剂β-丙内酯购自Ferak Berlin GmbH公司;狂犬病病毒抗体ELISA试剂盒为北京金诺百泰生物技术有限公司(兽药生字010678829)产品;4%多聚甲醛购自BBI生命科学生物公司;FITC标记的抗RABV N蛋白的单克隆抗体由中国农业科学院特产研究所保存。
1.3 病毒培养 待VDS在T-75 cm2细胞培养瓶中长成单层细胞,接种CDV LN(10)1株1 mL(106.0TCID50/mL),并于37℃、5% CO2的培养箱中培养72 h,每日观察细胞状态,待细胞病变达到80%左右,反复冻融细胞3次后收取病毒液;将F81细胞均匀铺于T-75 cm2细胞培养瓶中,同时接种CPV JL(18)1-Beagle株1 mL(106.0TCID50/mL),培养、收毒与检验病毒方法与增殖CDV的方法一致;待T-75 cm2细胞培养瓶BHK-21细胞长成单层细胞时,接种RABV弱毒HEP-Flury株1 mL(105.67TCID50/mL),并置于37℃、5% CO2培养箱中进行病毒扩增培养,96 h后通过反复冻融3次后收获病毒液。
1.4 病毒含量测定与纯净性检验 将VDS细胞均匀铺于96孔板中,待细胞长成单层时,将待测病毒液LN(10)1以10倍系列稀释到7个梯度(10-1~10-7),并依次加入96孔板中,每个梯度4个重复孔,置于5% CO2培养箱内37℃培养4 d~5 d,逐日观察细胞病变情况并记录结果,按照Reed-Muench法计算病毒含量[22]。将F81细胞均匀铺于96孔板中,同时将待测病毒液JL(18)1-Beagle以10倍系列稀释到7个梯度(10-1~10-7),后续步骤与测LN(10)1方法一致。
将BHK-21细胞均匀铺于96孔板中,待细胞长成单层时,将待测病毒液HEP-Flury以10倍系列稀释到7个梯度(10-1~10-7),依次加入96孔板中,每个梯度4个重复孔,置于37℃、5% CO2温箱中培养72 h后,PBS温和洗涤2次,4%多聚甲醛4℃固定细胞30 min,弃液,干燥10 min,加入FITC标记的抗RABV N蛋白的单克隆抗体,37℃孵育1 h,PBS洗涤3次后,加入适量的80%甘油,荧光显微镜下观察结果[31]。
分别取收获的3种病毒混合液,按《中华人民共和国兽药典》(2015年版三部)(以下简称《中国兽药典》)[32]进行无菌检验和支原体检验。
1.5 病毒灭活与疫苗制备 3种病毒分别应用PBS按CDV(106.0TCID50/mL)、CPV(106.0TCID50/mL)、RABV(105.67TCID50/mL)的比例进行病毒抗原液配制,按1∶2000比例加入β-丙内酯,彻底混匀后4℃灭活24 h后37℃水解1 h,即成灭活病毒液。取灭活CDV、CPV和RABV用DMEM培养基1∶5稀释后分别接种VDS、F81和BHK-21细胞,细胞置37℃培养3 d后再传1代,观察3种细胞有无细胞病变,未见细胞病变即判定病毒灭活合格。
将MONTANIDE GEL 02、ADJ-801(W)和Al(OH)33种佐剂分别与灭活病毒液(RABV∶CDV∶CPV=1∶1∶1)按1∶4比例混合均匀,制备成三联灭活疫苗,保存于4℃备用。
选取CDV、CPV和RABV抗原和抗体均为阴性的健康6周龄比格犬15只,每只皮下注射疫苗3 mL,连续观察至第14 d,每天记录是否出现局部或全身不良反应(表1)。

表1 比格犬疫苗接种分组及相关信息Table 1 Vaccination group and related information of Beagles
1.6 比格犬免疫试验 选取RABV、CDV、CPV抗原和抗体均为阴性的6周龄比格犬30只,连续免疫制备的三联疫苗3次,每次每只接种1 mL,每次间隔4周,并在每次免疫前和最后一次免疫后4周采集比格犬后肢静脉血液于促凝管中,分离血清于-20℃备用(表2)。

表2 比格犬免疫分组信息Table 2 Immunized group of Beagles
1.7 病毒抗体效价测定 三联灭活疫苗免疫比格犬后,血清中和法测定CDV中和抗体效价,血凝抑制试验测定CPV抗体水平变化,ELISA试剂盒测定RABV抗体水平。
1.7.1 血清中和试验 将分离后的血清用DMEM两倍倍比稀释10个梯度,56℃灭活30 min,滤过除菌后置-20℃保存备用。将CDV SD(14)7株病毒液用无血清的DMEM培养基稀释成100 TCID50每100 μL。分别取病毒液和待检血清各100 μL,37℃孵育1 h。将上述液体加入已长成单层VDS细胞的96孔板内,每个稀释度4个重复孔,置于5% CO2培养箱内37℃培养4~5 d,并逐日观察记录结果,同时设置正常细胞对照组,采用Reed-Muench法计算结果[33-34]。
1.7.2 血凝抑制试验 取25 μL待检血清,加入血凝板第1孔,以2倍倍比依次稀释至第10孔,每孔加入25 μL病毒抗原,于微型振荡器上振荡约1 min,将第11孔设置为病毒对照,第12孔设置为红细胞对照,37℃静置30 min;每孔加入1%的新鲜猪红细胞25 μL,震荡混匀,4℃静置2 h后观察结果。以能够100%抑制红细胞凝集的最高血清稀释度为该血清的滴度,即血清血凝抑制效价[27,35]。
1.7.3 ELISA检测抗RABV抗体 按照RABV抗体ELISA试剂盒说明书的操作方法检测抗RABV抗体水平。
1.8 比格犬攻毒 在免疫接种3个月后,MONTANIDE GEL 02、ADJ-801(W)和Al(OH)3三组比格犬分别应用CDV强毒SD(14)7株和CPV强毒JL(18)1-Beagle株攻毒,其中SD(14)7采用肌肉联合鼻内接种方式进行攻毒,每只1 mL,含100个半数致死量(LD50);JL(18)1-Beagle采用口服方式攻毒,每只1 mL,含100个LD50(表3),每天观察比格犬食欲、精神状态等临床指标。
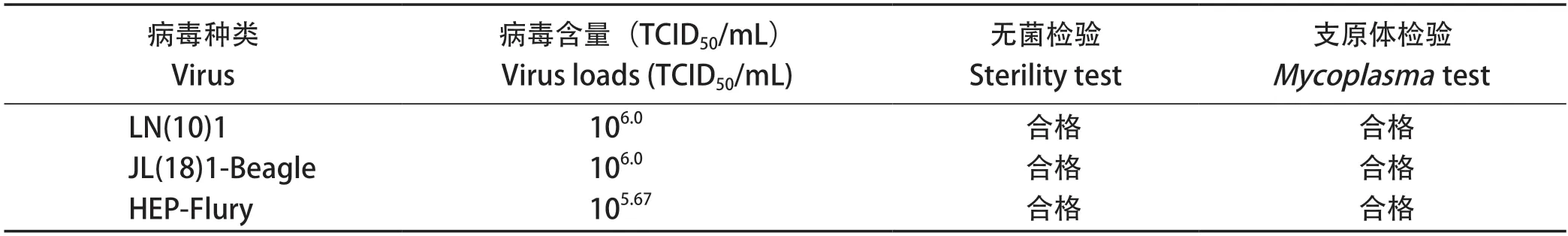
表4 病毒含量与质量检验结果Table 4 Virus loads and quality test
2 结果
2.1 病毒含量测定结果 CDV、CPV和RABV三种病毒含量均超过105.67TCID50/mL,符合制备三联灭活疫苗的毒种标准。对无菌、支原体检测结果为阴性,均符合《中国兽药典》(2015年版)规定[32]。
2.2 三联灭活疫苗安全性检验结果 疫苗对比格犬进行3倍免疫剂量进行安全性检验,动物接种疫苗14 d内体温、食欲和精神状态均无异常,表明3批不同佐剂的三联疫苗对比格犬具有较好的安全性(表5)。
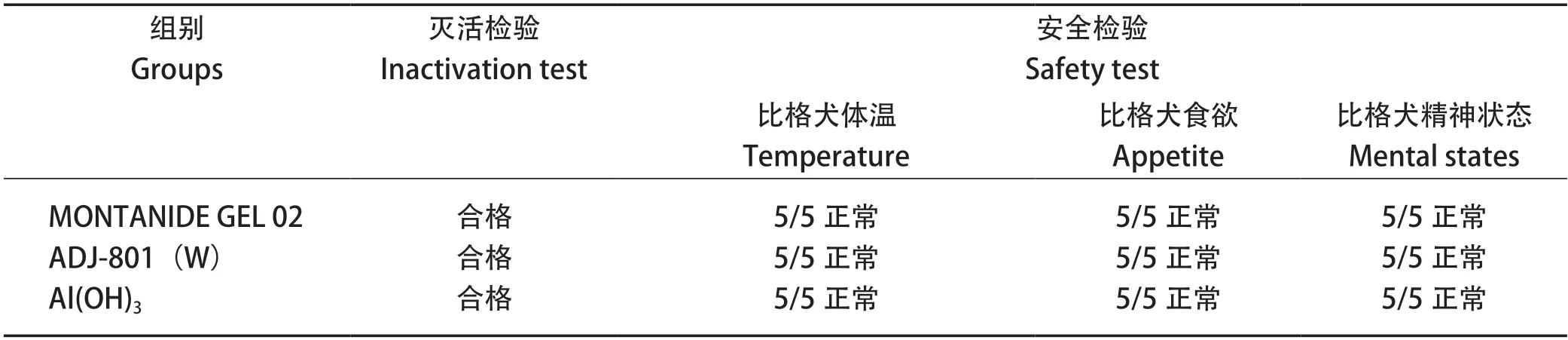
表5 三联疫苗灭活与安全性检验Table 5 Safety test of triple vaccine
2.3 三联灭活疫苗免疫比格犬后抗体效价 比格犬在连续3次免疫期间,血清CDV中和抗体水平持续升高。ADJ-801(W)组,二免和三免后CDV平均抗体效价分别为1∶8.6和1∶50,三免后CDV抗体水平极显著高于二免;而三免后MONTANIDE GEL 02和Al(OH)3组CDV平均抗体效价分别为1∶10.6和1∶6,极显著低于三免后的ADJ-801(W)组。MONTANIDE GEL 02和Al(OH)3组在3次免疫期间,CDV抗体水平升高但差异不显著(图1A)。比格犬3次免疫期间,CPV血凝抑制抗体效价在一免后即开始上升,三免后ADJ-801(W)组CPV平均抗体效价可达1∶1024(图1B)。随着免疫次数增加,RABV抗体水平不断升高,第二次免疫后,三组抗体水平均有所升高,MONTANID E GEL 02和ADJ-801(W)组RABV平均抗体效价分别为4.60 EU/mL、6.09 EU/mL,显著高于首免;第三次免疫后,MONTANIDE GEL 02和ADJ-801(W)组RABV平均抗体效价分别为6.9 EU/mL和7.4 EU/mL(图1C)。
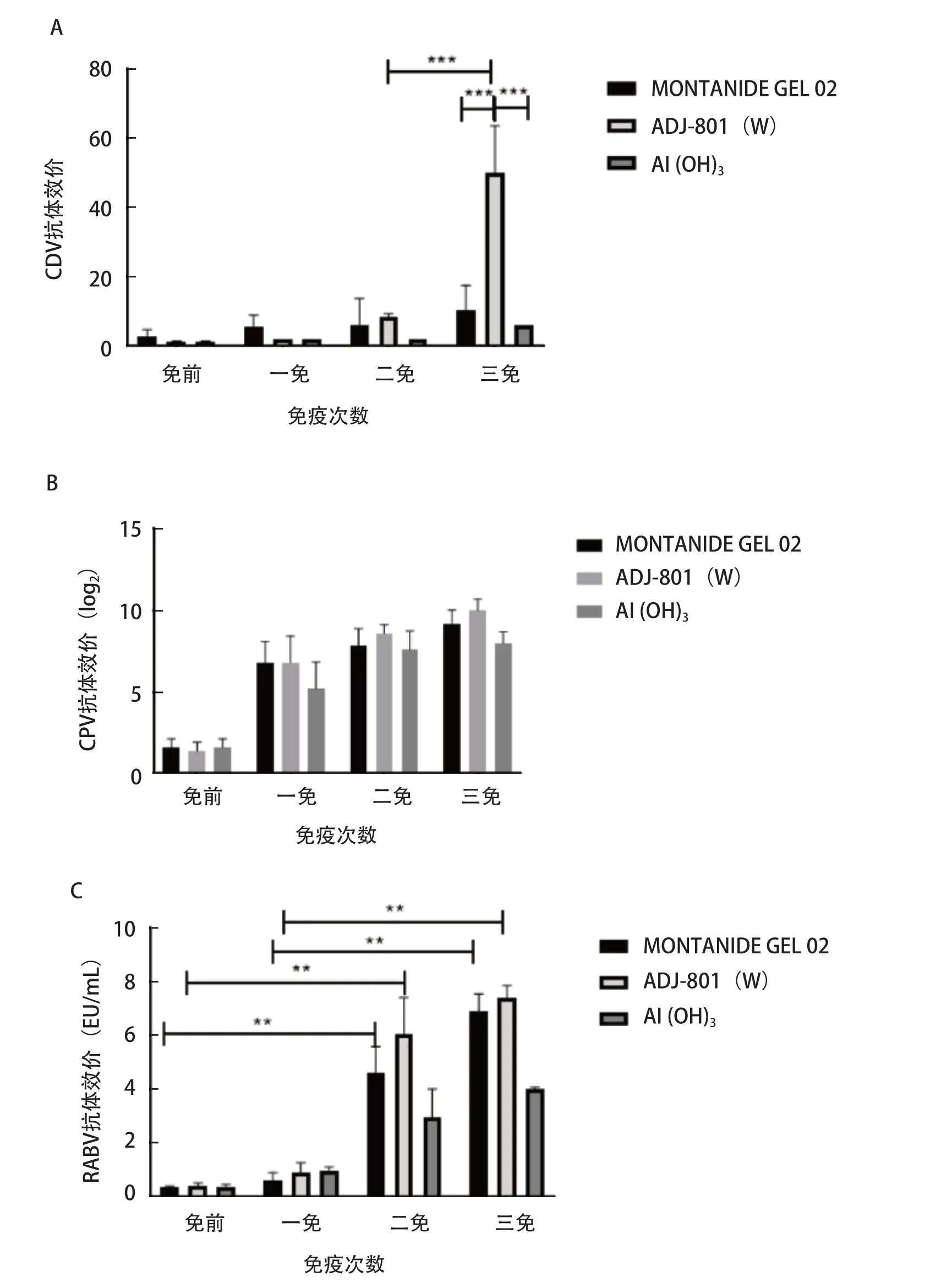
图1 免疫后比格犬血清抗体的测定Fig.1 Determination of serum antibodies in beagle dogs after immunization
2.4 比格犬攻毒后保护情况 免疫动物攻毒实验结果表明,三联灭活疫苗MONTANIDE GEL 02组对CDV和CPV的攻毒保护率均为60%;三联灭活疫苗ADJ-801(W)组比格犬对CDV和CPV的攻毒保护率均为100%,存活比格犬健康状态良好,无临床症状出现;Al(OH)3组比格犬在连续3次免疫3个月后攻毒,攻毒犬均出现精神沉郁、食欲不振甚至废绝症状,其中CDV攻毒组出现眼鼻分泌物增多等犬瘟热症状;CPV攻毒组出现腹泻等细小病毒病症状,最终100%死亡,结果见表6。
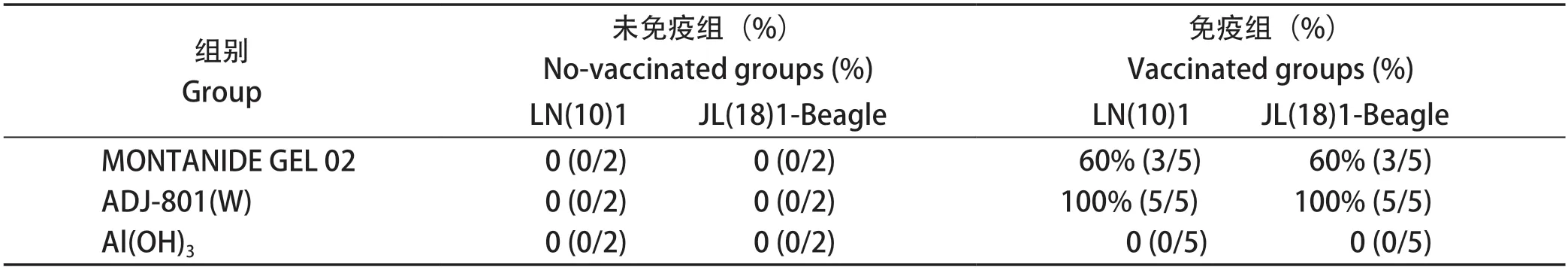
表6 疫苗免疫比格犬攻毒CDV和CPV后存活率Table 6 The protective rate of beagles after challenge with CDV and CPV
3 讨论
目前,MONTANIDE GEL 02、ADJ-801(W)和Al(OH)3为用于动物疫苗制备的三种商品化水溶性佐剂[34],本研究将经β-丙内酯灭活后的RABV、CDV和CPV分别与上述三种佐剂按一定比例混合,联合免疫比格犬后进行疫苗免疫效果评价。因比格犬的成本比较高,本研究受限于实验动物数量,选择免疫评价中重要的指标进行评价,即重点比较了三种佐剂的效果,因此只设置了免疫(抗原分别与三种不同的佐剂搭配)组和未免疫(既不含有抗原也不含佐剂)组。疫苗连续三次免疫比格犬后,ADJ-801(W)组CDV中和抗体水平显著高于MONTANIDE GEL02和Al(OH)3组。CPV血凝抑制抗体效价在第三次免疫后达到最高值,ADJ-801(W)组在第三次免疫后,CPV抗体平均效价可达1∶1024,据秦海斌等报道,当CPV血凝抑制抗体效价低于1∶80时,幼犬有感染CPV的风险,抗体高于1∶160时犬有可能出现隐性带毒而不表现明显临床症状,当效价高于1∶640时能够达到完全保护[36]。在疫苗第三次免疫后,ADJ-801(W)、MONTANIDE GEL 02和Al(OH)3组RABV抗体效价平均值分别为7.4 EU/mL、6.9 EU/mL及4.0 EU/mL,均显著高于世界动物卫生组织(OIE)制定的标准,即被检动物血清抗体大于0.6 EU/mL,则判定为具有保护水平[37]。综上所述,ADJ-801(W)佐剂疫苗的免疫效果最佳。
为了评价研制的灭活三联灭活疫苗能否对犬提供免疫攻毒保护,本研究在三次免疫比格犬3个月后对比格犬接种CDV强毒SD(14)7株和CPV强毒JL(18)1-Beagle株。从结果可以看出,MONTANIDE GEL 02组和Al(OH)3组三联灭活疫苗对比格犬均起不到较好的免疫保护作用;而ADJ-801(W)组免疫犬获得很好的保护。狂犬病毒需在生物安全三级实验室操作,因此受实验条件影响,本次没有进行比格犬RABV攻毒试验。薛素强等[37]研究发现狂犬灭活疫苗(dG株)在免疫家犬后12个月抗体效价达3.55 EU/mL,抗体阳转率为80.0%,明显高于OIE要求标准;李婷婷等[38]使用狂犬灭活疫苗(r3G株)免疫比格犬,测定3批疫苗的效价,结果显示效价分别为5.06、5.38和5.30 EU/mL,均符合疫苗质量标准的要求且批次之间的稳定性较强。本研究三联灭活疫苗在第一次免疫比格犬体后,RABV抗体含量已达到保护水平。在三次免疫比格犬后,三组组RABV抗体效价平均值分别为6.9、7.4及4.0 EU/mL,明显高于OIE标准。说明本研究制备的三联灭活疫苗免疫比格犬可提供较强的RABV免疫保护作用。
颜淑芹等[39]通过研究不同浓度氢氧化铝对人用狂犬病纯化疫苗效力的影响,发现氢氧化铝免疫增强作用与很多因素有关,佐剂本身可刺激吞噬细胞活性,但过多的铝佐剂反而会抑制抗原的释放且对吞噬细胞有细胞毒的副作用也会降低免疫力。本研究Al(OH)3佐剂灭活三联灭活疫苗免疫效果不佳,可能是在制备三联灭活疫苗时Al(OH)3的添加量过高或过低,也有可能是温度等因素对Al(OH)3佐剂性状的影响[34]。有研究报道称Al(OH)3不能有效诱导细胞免疫应答[40-41],并且本研究仅测定了CPV血凝抑制抗体而不是中和抗体,而血凝抑制抗体水平不能完全反映血清对病毒的中和能力。因此,三次免疫后Al(OH)3组虽然产生了较高水平的血凝抑制抗体但也没能阻止细小病毒对犬的致死性感染。同时,本研究攻毒时间是最后一次免疫后的3个月,抗体检测时间为最后一次免疫后4周,时间间隔2个月,攻毒后Al(OH)3组比格犬100%死亡的原因亦可能是Al(OH)3组动物抗体水平下降过快所致。近几年来,犬细小病毒疫苗免疫后仍然有CPV发病的报道,亦可能是由于上述原因引起[42-44]。
本研究ADJ-801(W)佐剂免疫比格犬后较其他两种佐剂提高了CDV、CPV和RABV抗体水平,比格犬在CDV和CPV攻毒后获得较好的免疫保护。ADJ-801(W)的主要成分包括卡波姆(Carbomer)增稠剂和CPC,CPC(因生产企业保密要求,暂未获得其主要成分)是佐剂的主要功能成分。在对成品疫苗进行安全检验与后期三次连续免疫比格犬期间,并未发现比格犬有任何不良临床反应。因此,ADJ-801(W)是一款良好的疫苗免疫佐剂,安全性高,为研制犬三联灭活疫苗以及预防和控制狂犬病、犬瘟热及犬细小病毒病的流行提供帮助。灭活疫苗具有研制工艺简单、安全性高等优点,并可与其他灭活病毒联合免疫动物,通过减少接种针次,避免对动物造成应激反应。未来在研制三联灭活疫苗时,建议重点关注如何提高免疫效力和降低免疫接种次数,达到在较少免疫次数下,免疫动物能得到较好的免疫保护。

