犬细小病毒河南方城株分离及VP2基因序列分析
林瑜婷,翟 颀,翟少伦,吕殿红,周秀蓉,贾春玲,霍 玮,温肖会,魏文康,3
(1.仲恺农业工程学院动物科技学院,广州 510225;2.广东省农业科学院动物卫生研究所 广东省畜禽疫病防治研究重点实验室 农业农村部兽用药物与诊断技术广东科学观测实验站,广州 510640;3.广东省农业科学院农业生物基因研究中心,广州 510640)
犬细小病毒病是由细小病毒科(Parvoviridae)细小病毒属(Parvovirus)的犬细小病毒(Canine parvovirus,CPV)感染犬只引起的致命性传染病[1],该病常以出血性肠炎、白细胞含量显著减少、腥臭血便和严重脱水等为主要临床特征,部分表现为突然死亡的急性心肌炎型[2]。犬细小病毒病传染性强,死亡率较高,全年都可以流行,严重危害犬只健康,给我国宠物饲养业造成巨大的经济损失。CPV基因组全长5233 bp,含两个开放阅读框,分别编码两个结构蛋白(VP1、VP2)和非结构蛋白(NS1、NS2)[4],VP1基因全长2181 bp,编码726个氨基酸,而VP2基因完全包含在VP1的序列中,全长1755 bp,编码584个氨基酸。VP2蛋白是CPV病毒衣壳的主要组成部分,在病毒的感染和复制过程中起着重要作用[6],其几个关键碱基和氨基酸的改变就可能导致病毒发生变异[7],自1970年CPV被成功分离以来,病毒不断发生突变形成了新的基因型CPV-2a、CPV-2b和CPV-2c,并在不同地区之间流行,形成了具有不同地理特征的毒株[8]。
本研究于2019年收集8份河南省方城县某动物医院疑似CPV感染犬粪便样品,并在猫肾细胞(Crandell-Rees feline kidney cell,CRFK)上接种培养,通过PCR检测、细胞病变(cytopathic effct,CPE)情况、电镜检测、TCID50测定以及VP2基因序列分析,对病毒进行分离鉴定和毒株亚型的确定,为了解河南省CPV的变异状况和流行趋势提供参考和依据。
1 材料与方法
1.1 样品、细胞和主要试剂 样品采集于河南省方城县某动物医院犬粪便;CRFK细胞由广东省农业科学院动物卫生研究所动物疫病诊断中心实验室保存;DMEM培养液、胎牛血清购自Gibco公司;pMD-19T克隆载体、DL2000 DNA marker、DNA凝胶回收试剂盒、Top10感受态细胞、DNA提取试剂盒、质粒提取试剂盒购自TaKaRa公司。
1.2 样品处理 向样品中加入含0.1%双抗的DMEM培养液,混合均匀,反复冻融3次,8000 ×g离心10 min后取上清液,0.22 μm滤膜过滤上清液,收集滤液于-80℃保存,待用。
1.3 样品PCR检测 将处理好的样品按照DNA提取试剂盒说明书进行DNA提取。参考本实验室已建立的犬瘟热病毒(Canine distemper virus,CDV)、犬副流感病毒(Canine parainfluenza virus,CPIV)和CPV的多重PCR检测方法[9]鉴定CDV、CPV、CPIV。具体引物序列见表1,引物由生工生物工程(上海)股份有限公司合成。反应体系为:DNA模板 2 μL,所有引物各0.5 μL,2×TaqPCR MasterMix 12.5 μL,ddH2O补至25 μL。PCR反应程序:50℃反转录30 min;95℃预变性2 min;95℃变性30 s,53℃退火30 s,72℃延伸60 s,共30个循环;72℃再延伸7 min,12℃保存。PCR产物于1.2%琼脂糖凝胶中进行电泳,检测样品中是否有犬细小病毒。
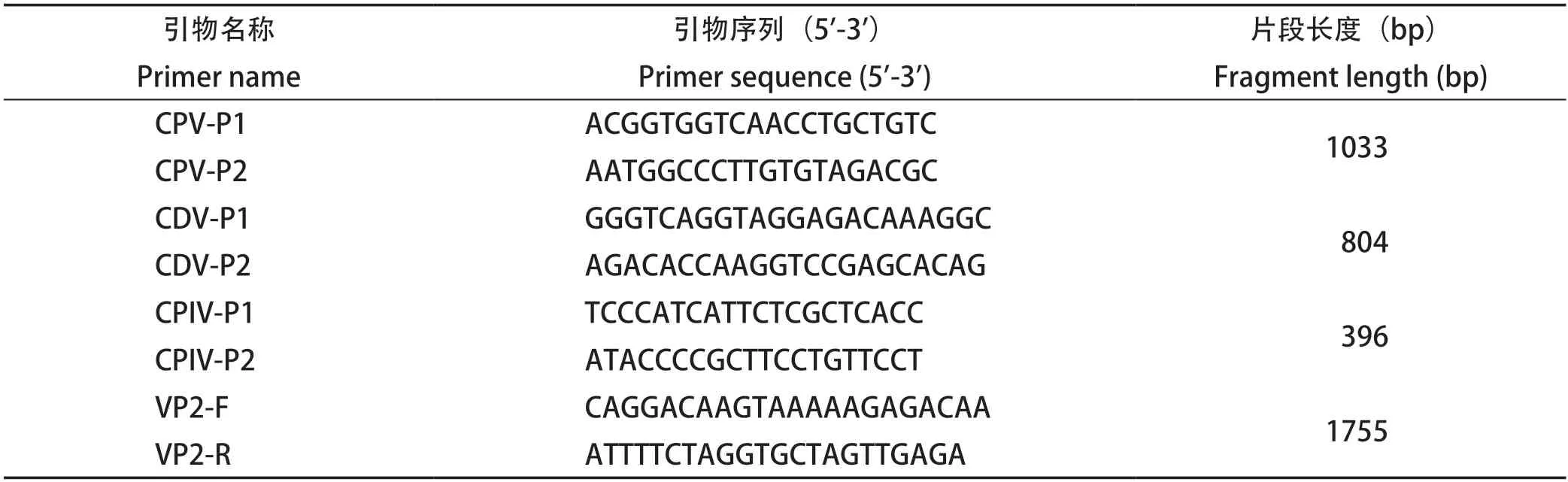
表1 PCR引物序列Table 1 Primers used for PCR Assay
1.4 病毒增殖 将处理好的样品上清液接种于CRFK细胞中,细胞长成单层后加入含2% FBS的DMEM细胞培养液,于37℃、5% CO2细胞培养箱进行培养,另设不接种病毒的CRFK细胞作为阴性对照。每天观察细胞生长情况和细胞病变并记录,弃掉盲传3代无CPE的细胞;产生CPE的细胞继续盲传3代,当出现80%的CPE时,收获病毒,于-80℃保存待用。
1.5 病毒电镜观察 超速离心纯化病毒液,吸附铜网1 min,1%磷酸钨染液负染后,透射电镜下观察病毒粒子形态。
1.6 病毒TCID50测定 调整CRFK细胞悬液浓度接种于96孔板,并对病毒样品的F6代细胞毒10倍倍比稀释,同步接种,每个稀释度接种8孔,同时设置正常细胞作为对照,每天观察并记录CPE孔数,按Reed-Muench法计算病毒的TCID50。
1.7 CPVVP2基因PCR扩增 对5份样品的F6代细胞毒按照DNA提取试剂盒说明书进行DNA提取,参考GenBank中已发表的CPVVP2基因序列,利用Primer Premier 5.0软件设计特异性引物,序列见表1,引物由生工生物工程(上海)股份有限公司合成。反应体系为:DNA模板 2 μL,VP2-F/R各0.5 μL,2×TaqPCR MasterMix 12.5 μL,ddH2O补至25 μL。PCR反应程序:95℃预变性2 min;95℃变性30 s,56℃复性30 s,72℃延伸90 s,共35个循环;72℃再延伸10 min,12℃保存。PCR产物于1.2%琼脂糖凝胶中进行电泳鉴定,并用DNA凝胶回收试剂盒进行回收纯化。将纯化后的回收产物连接到pMD-19T载体上,送生工生物工程(上海)股份有限公司测序。
1.8 CPVVP2基因序列分析 运用DNAMAN软件对测序结果进行拼接,将所获得的VP2基因序列与NCBI上已公布的CPV的标准毒株(GenBank登录号:M24003.1)、疫苗株(GenBank登录号:GU21279.1、FJ197846.1)、22株国内外不同基因型的CPV分离株进行比对分析,运用MEGA 7.0进行核苷酸序列同源性比对,运用DNAStar分析氨基酸序列,分析氨基酸变异情况并确定所分离的CPV毒株基因型[10](表2)。运用MEGA 7.0 Neighbor-joining程序(参数设置为1000 replications)绘制系统进化树。
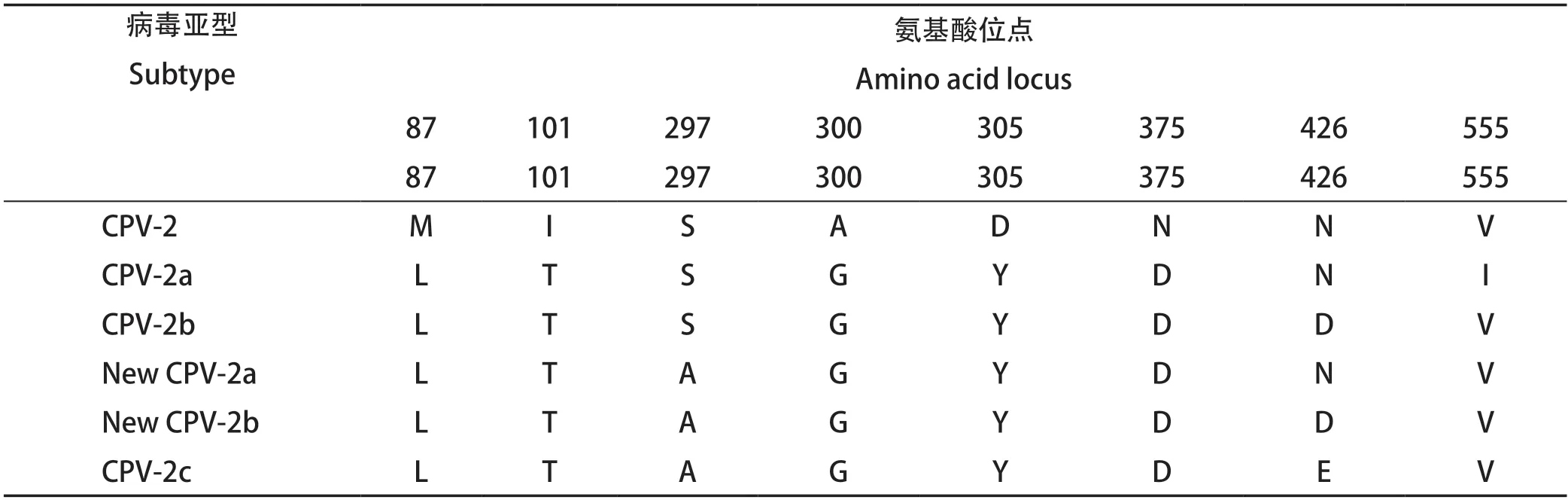
表2 犬细小病毒基因分型方法Table 2 Genotyping method of Canine parvovirus
2 结果
2.1 样品PCR检测 参考本实验室已建立的PCR检测方法进行检测,将PCR扩增产物经1.2%琼脂糖凝胶电泳。结果显示,本次收集的8份样品中,1、2、5、6、7号样品采用CPV扩增引物均能扩增出1033 bp目的条带,其余3、4、8号样品未出现目的条带,8份样品采用CDV和CPIV特异性引物扩增未出现目的条带(图1)。
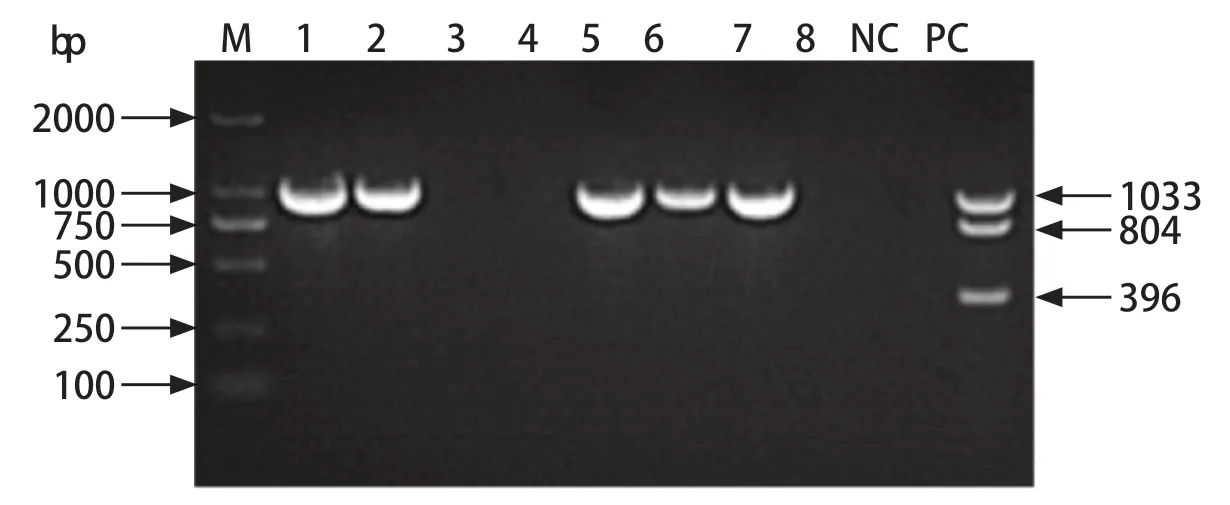
图1 粪便样品PCR鉴定结果Fig.1 PCR result of stool samples
2.2 病毒增殖 将5份阳性样品分别接种于单层培养的CRFK细胞,观察细胞病变。接毒细胞均出现拉网、空泡和变圆脱落的典型细胞病变,对照组细胞正常(图2)。接毒细胞继续盲传3代,观察到稳定的细胞病变现象,证明成功分离到5株病毒,将出现CPE的样品分别命名为China-HN-01、China-HN-02、China-HN-05、China-HN-06、China-HN-07。

图2 感染CPV的CRFK细胞和健康CRFK细胞Fig.2 Healthy CRFK cell and CRFK cell infected with CPV
2.3 电镜形态学观察 取纯化后的CPV病毒液进行1%磷酸钨负染,透射电镜下5株CPV分离株均可观察到外形结构呈圆形或二十面体结构、直径为20~25 nm的无囊膜病毒粒子(图3),符合细小病毒的形态大小特征。
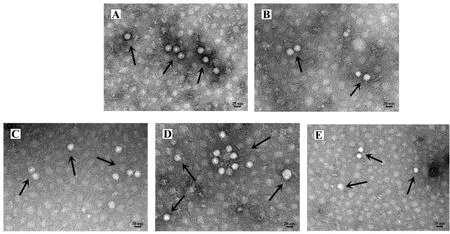
图3 病毒粒子电镜下形态观察Fig.3 Electron microscopy image of virus particles
2.4 TCID50测定结果 将5株CPV分离株的细胞毒倍比稀释后同步接种于CRFK细胞,每日观察CPE情况,处理数据后按照Reed-Muench法计算毒株的TCID50(如表3)。
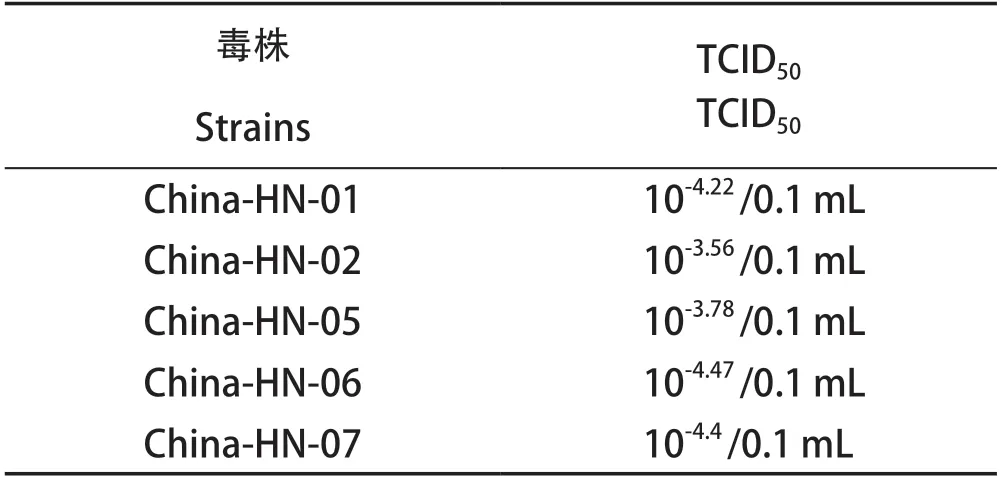
表3 CPV毒株TCID50测定结果Table 3 TCID50 of CPV isolates
2.5 CPVVP2基因PCR扩增 提取5株CPV毒株的F6代细胞培养液中DNA,对其VP2基因进行扩增,通过1.2%琼脂糖凝胶进行电泳检测。结果表明,5份样品均在1755 bp处出现目的条带(图4)。
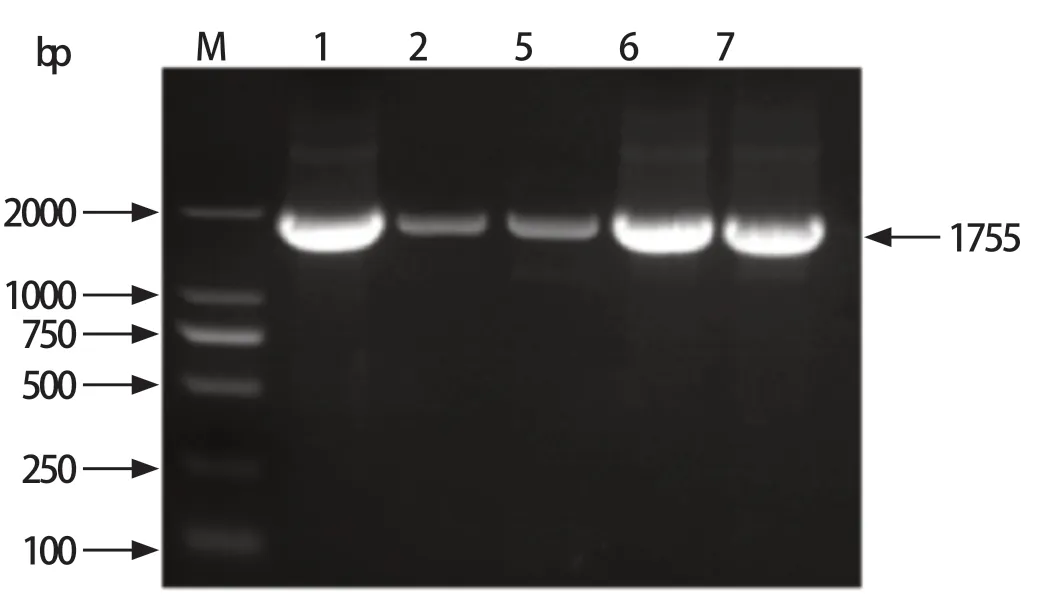
图4 CPV VP2 PCR鉴定结果Fig.4 The PCR result of CPV VP2
2.6 CPVVP2基因序列分析
2.6.1 CPV毒株亚型分析 根据测序所获得的CPVVP2基因序列翻译获得其氨基酸序列,参考分型标准确定CPV毒株亚型。对CPV毒株进行氨基酸突变分析,发现5株CPV毒株的第297位氨基酸都由S突变为A,且China-HN-01、China-HN-02、China-HN-05、China-HN-07毒株中第426位氨基酸为N,故其属于New CPV-2a亚型,China-HN-06发生了5A→G、370Q→R、426N→E和440A→T的突变,通过和参考毒株的比对以及参考分型标准,确定China-HN-06为CPV-2c亚型。
2.6.2 CPV VP2主要氨基酸位点突变分析 CPVVP2基因全长为1755 bp,共编码584个氨基酸。通过核苷酸序列翻译5株CPV毒株及参考毒株的氨基酸序列,运用MEGA 7.0软件进行比对分析,结果见表4。与4株基因型为New CPV-2a的参考毒株相比,China-HN-01、China-HN-05较为保守,VP2蛋白没有发生氨基酸突变,China-HN-02、China-HN-07发生了不同程度的氨基酸突变。与5株基因型为CPV-2c的参考毒株相比,China-HN-06在VP2蛋白上发生了4处氨基酸突变。New CPV-2a亚型毒株的突变情况为China-HN-02的T101A、I357T和China-HN-07的P74L,CPV-2c亚型毒株China-HN-06发生氨基酸突变的位点较多,有R16G、R191G、T223I、L294S共4处突变。
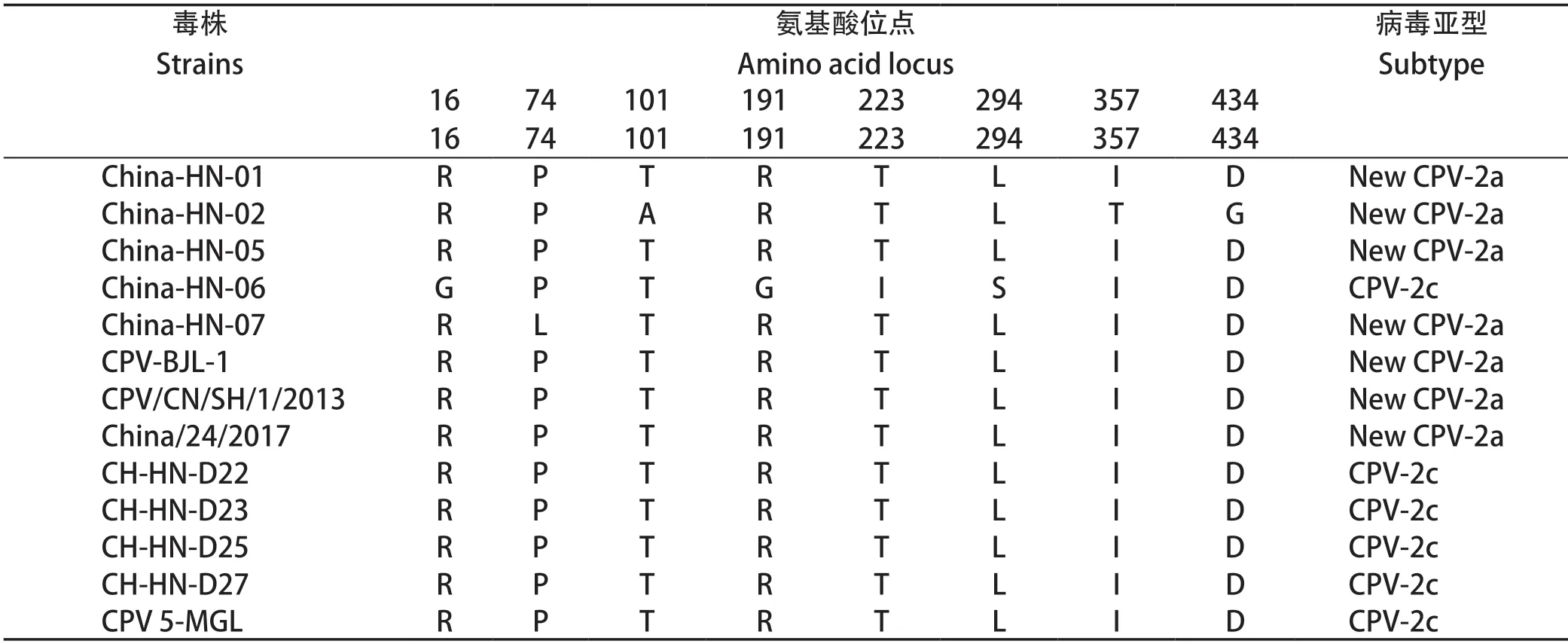
表4 CPV VP2蛋白氨基酸突变位点Table 4 Variable amino acid sites of VP2 protein
2.6.3 同源性分析 将此次分离得到的5株CPV毒株和GenBank上已发表的国内14株和国外11株CPV的基因序列进行比对。结果可知,5株CPV毒株之间的核苷酸同源性为95.1%~99.7%,与商品化疫苗株GU212791.1和FJ197846.1的同源性为97.8%~98.7%,与其他参考毒株的同源性为94.0%~99.0%(图5)。
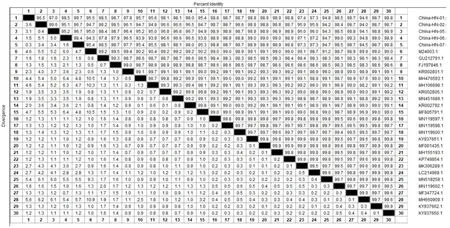
图5 CPV毒株VP2基因核苷酸同源性比对分析Fig.5 Nucleotide homology alignment analysis of VP2 gene of the CPV isolate
2.6.4 系统进化树分析 运用MEGA 7.0软件,对5株CPV毒株以及GenBank数据库中14株国内和11株国外CPV的VP2基因序列进行比对,绘制系统进化树。由结果可知,China-HN-01、China-HN-02、China-HN-05、China-HN-07与国内四川地区分离到的同为New CPV-2a亚型毒株的亲缘关系较近;China-HN-06与蒙古国的CPV-2c亚型分离株位于同一分支,亲缘关系较近,与我国河南地区分离到的其中1株CH-HN-D27亲缘关系接近但不同属一支,与河南地区的CH-HN-D22、CH-HN-D23、CH-HN-D25株CPV-2c分离株亲缘关系较远,5株CPV毒株与疫苗株Nobivac DHPPL和Vanguardplus5属于不同分支,亲缘关系较远(图6)。
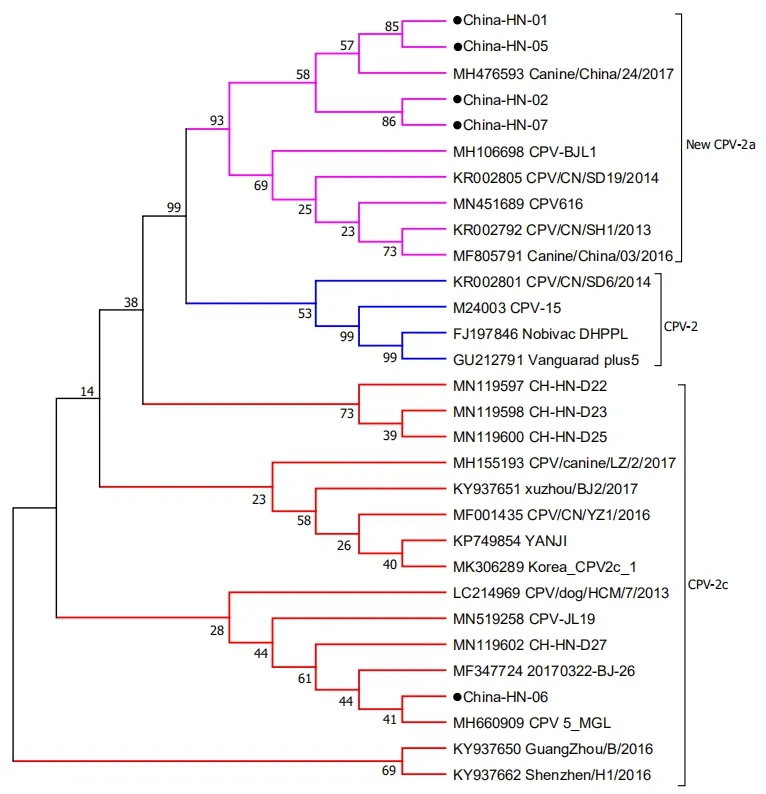
图6 CPV VP2核苷酸序列遗传进化树Fig.6 The nucleotide sequence genetic tree analysis of VP2 gene of CPV
3 讨论
本实验从8份疑似CPV感染的犬只粪便中检测出5份CPV阳性样品,后经PCR检测、电镜检测、细胞病变观察和VP2基因测序分析确定所增殖的病毒为CPV。根据CPV亚型分型标准对毒株进行分型和命名,确定China-HN-01、China-HN-02、China-HN-05、China-HN-07为New CPV-2a亚型,China-HN-06为CPV-2c亚型。目前全球流行的CPV毒株主要为2a、2b和2c亚型,我国以New CPV-2a亚型为主要流行毒株[11],2000年,CPV-2c于意大利首次被报道[12],其后,CPV-2c逐渐成为欧美国家的主要流行亚型。2010年,我国首次检测到CPV-2c[13],2014年成功分离第一株中国CPV-2c毒株[14],随后,我国多个城市陆续发现CPV-2c型,包括吉林、黑龙江、北京、广西等地[15],本研究从河南方城地区再次检测到CPV-2c毒株,说明CPV-2c亚型毒株在我国的流行呈上升趋势。
VP2基因是CPV的特异性基因,是最主要的毒力基因,可以诱导机体产生中和抗体。本试验根据VP2基因参考序列设计合成特异性引物,对VP2基因进行了克隆分析。结果显示,5份样品的细胞培养物均能扩增出1755 bp的目的片段,测序比对显示目的序列与已发表的CPV同源性均达99%以上,从分子水平证明了5株均为CPV毒株。经过氨基酸序列比对,发现China-HN-02株的VP2基因发生了T101A突变,但是China-HN-02株的VP2蛋白功能是否发生改变还有待后续研究。CPV-2c亚型的China-HN-06毒株与疫苗株的核苷酸同源性稍低为97.8%和97.9%,且该毒株与参考毒株比对有4个氨基酸位点突变:R16G、R191G、T223I、L294S,但这四个非同义位点的突变是否会对病毒的生物学特性产生影响还有待进一步研究。系统进化树分析表明,CPV在进化过程中形成不同的分支,4株New CPV-2a亚型毒株与四川分离株的亲缘关系最近,属于同一分支,推测4株New CPV-2a的毒株可能由四川分离株进化而来。CPV-2c亚型的China-HN-06毒株与另外3株河南地区的CPV-2c分离株不在同一分支,亲缘关系较远,说明CPV仍在不断进化突变,河南地区目前已经存在不同突变的CPV-2c亚型的分离株,因此有必要及时监测CPV的变异情况,加强对CPV-2c亚型的监测。
本实验对河南方城地区发现的CPV毒株进行分析,为研究CPV变异株在河南地区的传播和宠物疫病防控提供了理论依据。

