定安母猪流产病原检测
王 弘,黄承峰,张 艳,刘海隆*
(1. 海南省定安县龙门农业服务中心,海南 定安 571226;2. 海南省农业科学院畜牧兽医研究所,海南 海口 571100)
定安猪是海南省地方优良畜禽品种之一,主要产于海南省定安县雷鸣、龙门、龙河等镇,分布于全县各地,目前是海南猪中群体规模最大的类群,饲养的群众基础好[1],但其体型小、生长发育慢,当地一般利用定安母猪与杜洛克公猪杂交[2],生产二元黑猪。 定安母猪经过长期的选育留种,非常适应当地自然条件和经济条件,具有敏捷、觅食性强、耐粗饲、耐热、抗逆性强、繁殖力较强等优点[3-4],虽然如此,如果饲养条件太过于粗犷,饲养管理不当及疫病预防措施不到位的话,也经常会发生怀孕母猪产死胎及流产的现象,大幅降低了定安母猪的繁育利用水平。
引起妊娠母猪流产、产死胎的原因很多:除了产科性疾病、饲养管理不当、损伤性、药物性等原因外,大部分感染性因素占主导地位。 比如,蓝耳病、细小病毒病、日本乙型脑炎、猪衣原体病、猪瘟、钩端螺旋体病、猪伪狂犬病等,这些都可能造成母猪流产、死胎[5-8]。 为了解定安母猪发生流产、死胎主要病因,笔者从当地32 个养殖场及养殖户总共收集到267 例定安母猪无明显临床症状或轻微症状发生流产及产死胎的案例,开展了猪圆环病毒2 型(PCV2)、猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)、猪伪狂犬病病毒(PRV) 及猪乙型脑炎病毒(JEV) 5 种主要病毒性繁殖障碍疫病病原的检测,并分析其病原感染情况,以期为有效防控定安母猪繁殖障碍疫病提供科学参考。
1 材料与方法
1.1 试验材料
定安母猪流产胎儿或流产未成形的组织排泄物,在2021 年11 月份至2022 年10 月份采自海南省定安县32 个定安母猪养殖场及养殖户。 样品信息见表1。

表1 样品采集信息表
1.2 主要仪器设备
全自动核酸提取仪(型号VNP -32P),南京诺唯赞生物科技股份有限公司制造;全自动样品快速研磨机(型号JXFSTPRP -32),上海净信实业发展有限公司制造;荧光定量PCR 仪(型号CFX-96 touch),美国Bio-Rad 制造。
1.3 主要试剂
病毒 DNA/RNA 提取试剂盒 ( 批号20220120),购自上海凡济生物科技有限公司;反转录试剂购自大连宝生物工程有限公司;猪圆环病毒2 型 (PCV - 2) 核酸检测试剂盒(荧光PCR 法,批号20220225),上海帛科生物技术有限公司;猪蓝耳病病毒通用型(PRRSV-U) 核酸检测试剂盒(荧光PCR 法,批号20220310),上海初态生物科技有限公司;猪细小病毒(PPV) 核酸检测试剂盒(荧光PCR 法,批号20220120),上海初态生物科技有限公司;猪伪狂犬病病毒检测试剂盒(荧光PCR 法,批号20220320),深圳子科生物技术有限公司;日本乙型脑炎病毒(JEV) 核酸检测试剂盒(荧光PCR 法,批号20220408),上海初态生物科技有限公司。 以上试剂盒均符合国家要求,其引物的设置也是根据国家标准、行业标准等标准要求设计的特异性引物和引物序列。
1.4 方法
现场采集母猪的流产排泄物或成形的胎儿,20 ℃保存,冷藏送至实验室检测。 将流产胎儿的脏器或母猪流产的组织样品,加入一定比例的生理盐水,在组织研磨器内充分研磨并保证浆液均匀,反复冻融3 次,4 ℃、12 000 r/min 离心5 min 后取上清,按照病毒基因组DNA/RNA 提取试剂盒使用说明书对样品上清进行DNA/RNA 提取。 RNA 病毒反转录成cDNA,所获得的DNA/cDNA 按照各种疾病的病原试剂盒使用说明直接进行荧光PCR 检测。
2 结果与分析
2021 年11 月至2022 年10 月,在海南省定安县32 个养殖场及养殖户共采集到267 份定安母猪流产临床病例,在不同的月份及母猪妊娠的不同阶段流产发生率不同,见图1、图2。 经过实验室检测,最终有98 份病例样品检出了至少一种病原,病原的检出率为36.70%(98/267) 。5 种病毒性繁殖障碍疫病病原的检测结果见表2,其中有不少样品中可以检出2 种或2 种以上病原,5 种病原单独感染和混合感染的情况中见图3、图4。

图1 定安母猪不同月份流产病例分布
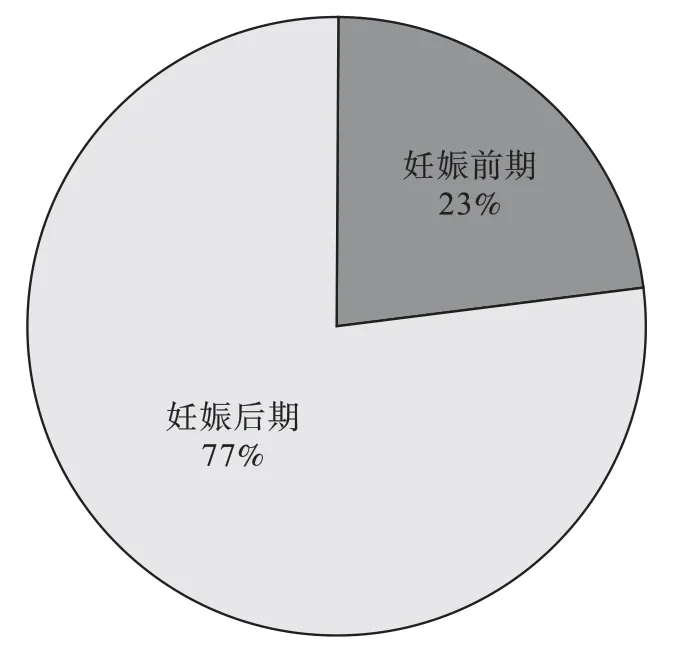
图2 定安母猪不同妊娠阶段流产病例分布

图3 定安母猪5 种繁殖障碍疫病病原单一感染情况

图4 定安母猪5 种繁殖障碍疫病病原混合感染情况

表2 5 种病毒性繁殖障碍疫病病原检测结果
由表1 数据分析可得图1、图2,可知定安母猪流产病例样品主要发生在海南气温相对较低、天气冷热变化较大的月份,2021 年11 月至2022 年3 月,共采集到169 例,占比63%(169/267)。 另外定安母猪怀孕2 个月以后,在妊娠后期发生流产的样本占比77% (206/267)。
由表2 可知,定安母猪发生流产、死胎的病例5 种病毒性繁殖障碍疫病病原检出率从高到低依次为 PRRSV ( 17.98%)、PCV2(11.61%)、JEV (9.74%)、PRV (6.37%)、PPV (4.49%)。
由图3 可知,定安母猪5 种繁殖障碍疫病病原单一感染共65 例,占总感染数的66.33%(65/98),占比最高的是PRRSV (20.41%,20/98),其次分别是PCV2 (13.27%,13/98)、JEV (12.24%,12/98)、PRV (11.22%,11/98)、PPV (9.18%,9/98)。
由图4 可知,定安母猪5 种繁殖障碍疫病病原混合感染共33 例,占总感染数的33.67%(33/98)。 混合感染情况以双重病原感染较为常见,共30 例,占总感染数的30.61% (30/98),其中以PRRSV +PCV2、PRRSV +JEV 感染病例较多,分别占总感染数的12.24%(12/98)、8.16% (8/98)。 多种病原混合感染情况仅发现3 例。
3 讨论
妊娠母猪无症状或轻微临床症状发生流产,不但减少了猪场产仔数,还会损害母猪健康,缩短利用年限,使养猪场生产成本加大,养殖效益降低[9],而且很难分析病因、病情及做出正确的治疗。 对此要采取何种预防措施?是否要及时淘汰母猪? 给养殖场及养殖户带来巨大困扰。 从样本采集信息初步分析,定安母猪流产死胎病例绝大多数发生在海南当地气温相对较低、冷热变化较大的11 月到次年的3月。 定安母猪妊娠后半阶段(怀孕2 个月之后) 较前半阶段更容易出现流产、死胎的情况,这可能是因为在妊娠的早期和中期流产的胚胎被吸收或者流产组织物被母猪采食掉而不易被察觉,在养殖过程也会被认为是配种不成功,最终会导致母猪出现不规律发情[10],降低母猪利用率。
传染性因素是引起母猪流产的主要原因,但是母猪流产病原的确诊存在很大的困难,很多流产病例的致病原在流产发生时已不存在。本次病原检测检出率仅为36.70% (98/267),说明剩余病例还有很多其他病原存在或者检测不出任何病原及其他非传染因素导致流产。
从样品检测的结果来看,采集的病例样品PRRSV、PCV2、JEV、PRV、PPV 5 种主要病毒性繁殖障碍疫病病原以单一病原感染为主,说明各养殖场及养殖户母猪免疫程序存在不合理或者免疫失败的现象。 据报道规模化养猪场中,免疫失败引起的疾病性流产是母猪流产的主要原因之一[11]。 混合感染情况以双重感染较为常见,三重感染情况仅出现3 例,综合分析PRRSV、PCV2、JEV 是目前引起定安母猪流产死胎的主要病毒性病原,提示养殖户要做好母猪流产的记录工作,注意观察母猪产死胎的现象,及时送检,确定母猪流产是否为传染性流产还是非传染性流产,按照科学的免疫流程做好免疫预防工作,将养殖场的卫生管理工作做到位,夏天减少蚊虫滋扰,冬季做好保温措施,减少母猪流产的发生率。
4 结论
本研究结果表明,定安母猪流产及死胎大部分发生在海南气温相对较低的月份及母猪妊娠后期。 PRRSV、PCV2、JEV、PRV、PPV 5种病原从高到低依次均有检出,病原以单一感染为主,混合感染以双重感染为主,多种病原感染少见。 PRRSV、PCV2、JEV 是目前引起定安母猪流产死胎的主要病毒性病原。

