PEDV Nsp10 基因真核表达载体的构建及蛋白的表达
牛欣雨,郑亮,魏佳琪,武峰峰,吴志军,3,张华,,3,曹宏伟,,3
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.黑龙江八一农垦大学动物科技学院;3.盐城师范学院)
猪流行性腹泻是由猪流行性腹泻病毒引起一种急性肠道传染病,主要以高度接触性传染而广泛传播[1]。感染此病毒的猪多伴有严重的腹泻、呕吐、脱水等特征,多感染哺乳仔猪,且具有较高的感染率和死亡率。不同年龄段的猪感染率不同,但一般年龄越小的猪感染率越高,死亡率也越高[2]。猪流行性腹泻首次爆发于欧洲英国,但目前已经成为威胁到包括中国、韩国、日本等在内的亚洲各个国家养猪业的严重传染性疾病,给亚洲乃至世界各国养猪业造成了致命性的打击[3]。
PEDV 是一种正链单股RNA 病毒,基因组全长约为28 kb[4-6]。PEDV 基因组共编码蛋白21 种,其中包括4 种结构蛋白(E 蛋白、M 蛋白、N 蛋白及S 蛋白)和16 种非结构蛋白Nsp1-16 以及一个辅助蛋白ORF3[7-9]。这些蛋白共同协调着病毒的复制与增值。
Nsp10 是PEDV 编码的非结构蛋白,由135 个氨基酸残基构成,是一种具有核苷-2-O’-甲基转移酶活性的辅助蛋白[10]。生物信息学分析发现Nsp10 蛋白是一种锌指结合蛋白,在冠状病毒(包括Ⅰ、Ⅱ、Ⅲ型)中,和锌螯合的所有氨基酸均比较保守[11]。此外,也有研究表明,SARS-Cov Nsp10 蛋白可以与DNA或单双链RNA 中非特异性的核苷酸结合并且可通过与多种蛋白如Nsp1、Nsp7 等相互作用来参与复制复合体的形成[12-13];SARS-Cov-2 Nsp10 蛋白可以拮抗Ⅰ型干扰素产生的免疫应答反应[14];MHV Nsp10蛋白可以结合锌离子并且在体外与ssDNA、dsDNA、ssRNA 及tRNA 结合[15];冠状病毒的Nsp10 蛋白是一种可以激活多种复制酶的关键辅助因子,它可以与Nsp14 和Nsp16 相互作用,并调控它们各自的外显子和核糖-2’-O-甲基转移酶的活性[16-17];猪δ 冠状病毒Nsp10 蛋白以一种不依赖于锌指结构域的方式拮抗β-干扰素的产生[18]。这些结果说明,对于冠状病毒来说Nsp10 蛋白对基因组和亚基因组RNA 合成以及病毒多聚蛋白的加工有着极其重要的作用[19-20]。
到目前为止,对于冠状病毒Nsp10 作用机制研究的报道还相对较少,对于PEDV Nsp10 蛋白的研究也相对较少。研究通过构建PEDV Nsp10 基因真核表达载体,利用免疫印迹技术(Western Blot)与间接免疫荧光技术鉴定其表达及亚细胞定位情况,为进一步探究PEDV Nsp10 蛋白的生物学功能以及特性奠定了一定的基础。
1 材料与方法
1.1 材料
IPEC-J2 细胞由生物技术中心509 实验室于-80 ℃冻存复苏;小鼠抗Myc 单抗(mAb)、小鼠抗β-actin单抗(mAb)、山羊抗小鼠辣根酶标记IgG 以及FITC标记的山羊抗小鼠IgG 均购自北京中衫金桥生物技术公司;DMEM 培养基、胎牛血清(fetal cattle serum,FBS)和LipofectamineTM2000购自英潍捷基(Invitrogen)上海贸易有限公司;质粒小提试剂盒和胶回收试剂盒均购于Omega 公司;限制性内切酶EcoRⅠ和XhoⅠ、2×Seamless 无缝克隆酶、PCR 及反转录试剂盒购自TaKaRa 公司;特异性引物合成及重组质粒的序列测定均由擎科生物(北京)公司完成;病变组织猪小肠由生物技术中心509 实验室保存;试验选用的DH5α 感受态细胞及所需的pCMV-Myc 载体均由生物技术中心509 实验室保存。
1.2 引物设计及表达载体构建路线
找出已经发表在NCBI-GeneBank 上的PEDV(NC_003436.1)标准序列作为模板序列,利用primer 5 软件设计PEDV Nsp10 基因的特异性上下游引物,特异性上游引物序列:GCCA TGGAGGCCCGAATTCGGATGGCTGGTAAACAAACAGAACAGGCTAT-3(含EcoR Ⅰ位点),特异性下游引物序列:CGCGGCCGCGGTACCTCGAGATTGCATAATGGAT -CTGTCACAAG TG(含XhoⅠ位点)。利用酶切连接的方式将PEDV Nsp10 基因插入pCMV-Myc 的EcoRⅠ/XhoⅠ位点之间。构建以pCMV-Myc 为载体的PEDV Nsp10 蛋白融合表达载体。
1.3 扩增PEDV Nsp10 基因
将病变组织猪小肠用液氮进行研磨,将其放于1.5 mL EP 管中,剧烈摇晃1 min 后静止10 min,加入冰冷的三氯甲烷试剂,快速摇晃20 s。静止15 min后,在转速为12 000 r·min-1,4 ℃离心机中离心15 min。离心停止后,取离心管中的上层澄清液于新的EP 管内,将600 μL 异丙醇加入装有上述澄清液的EP 管中,轻轻摇晃15 s,让两者混匀,静止时间为10 min。随后4 ℃离心机中离心10 min,转速为12 000 r·min-1。倒掉上清,向沉淀中加入75%的乙醇(用DEPC 水现配现用)600 μL,静止10 min。倒掉上清,吹干剩余液体,向EP 管中的沉淀加入20 μL 的DEPC 水助溶,静止10 min,在-80 ℃冰箱中保存。试验过程中所用的耗材需要提前用DEPC 水处理,4 ℃离心机需提前预冷。
RNA 提取完毕后,加入Oligo(dT)1 μL、Specific Primer 2 μL、DEPC 水2 μL;反应条件为70 ℃10 min。向上述管中加入以下试剂混合液,dNTP mix(10 mM)0.5 μL、RNase Inhibitor 0.5 μL、5×M-MLV buffer 2 μL、RNase M-MLV 1 μL、DEPC 水1 μL,总反应体系5 μL;将上述液体混匀后放入PCR 仪中,PCR 程序为:30 ℃10 min,42 ℃保温60 min,70 ℃保温15 min。以此得到的cDNA 为模板,加入上下游引物各0.2 μL,buffer 3 μL,dNTP 2 μL,PCR 酶0.13 μL,去离子水13.47 μL,总反应体系为20 μL;将上述液体混匀后放入PCR 仪中,PEDV Nsp10 基因PCR 程序为:94 ℃10 min;94 ℃45 s,60 ℃45 s,72 ℃1 min(共35 次循环);72 ℃10 min。结束后点样跑胶,之后切下本试验的目的条带,利用试剂盒对目的产物进行回收,回收到的目的片段溶在20 uL 去离子水中-20 ℃冷冻冰箱中保存。
1.4 Nsp10 基因真核表达载体的构建及鉴定
将Nsp10 基因片段和pCMV-Myc 载体分别用EcoRⅠ与XhoⅠ双酶切,试验条件为37 ℃,2 h,利用Omega 试剂盒进行胶回收。将切下的DNA 胶用700 μL Binding Buffer 于60 ℃水浴锅中溶解10 min。将溶解后的混合液体倒入收集柱,于离心机中12 000 r·min-1离心1min,该过程重复一次。随后弃掉下管液体,向上柱加入300 μL Binding Buffer 将其溶解,12 000 r·min-1离心1 min。弃去下层液体,向上管中加入700 μL Wash Buffer,12 000 r·min-1离心1 min。丢弃下管液体13 700 r·min-1空离2 min。离心后向上管加入30 μL 已经加热到60 ℃左右的去离子水,静止溶解5 min 后13 700 r·min-1离心2 min,得到纯化的基因片段和载体片段。将上述两种纯化所得到产物,加入2×Seamless 无缝克隆酶及去离子水,总体系为10 μL,于PCR 仪中50 ℃15 min。连接产物转化涂板,于培养箱培养12 h。挑取大小饱满的单一菌落,于37 ℃摇床培养10-12 h 后,提取质粒。经PCR 和双酶切鉴定成功后,于-20 ℃保存。取出10 μL 质粒送至公司进行测序,将正确质粒命名为pCMV-Myc-Nsp10。
1.5 Western Blot 检测
将IPEC-J2 细胞均匀铺在24 孔板中,待细胞密度长到80 %左右时,进行转染,步骤如下:用Lipofectin2000分别将pCMV-Myc 和pCMV-Myc-Nsp10 质粒转染至细胞中,将转染后的细胞板于37 ℃5%CO2培养箱培养。培养6 h 以后,将原24 孔板中的DMEM 换为10% FBS,继续培养18 h 后,收取蛋白样品。收样:PBS 轻轻清洗细胞2~3 次后,每孔加入30~50 μL RIPA 裂解液裂解细胞半个小时,该过程需要在4 ℃低温下进行,用枪头刮取细胞,4 ℃离心机12 000 g 离心10 min,吸取上清裂解液至新的EP 管中。加入5×Loading Buffer,100 ℃沸水浴煮样10 min,随后12 000 g 离心10 min。跑胶:配胶,等待胶凝固以后,组装胶和电泳槽,在确定不漏的情况下倒入1×SDS 电泳液,插上电极,分离蛋白样品;转膜:将胶板撬开,按照条带大小切下对应胶条,组装转膜装置,用PVDF 膜吸附蛋白,冰水混合物中转膜电压200 V,电流240 A,时间为2 h。封闭:取10 mL 1×TBST,向里面添加0.5 g 脱脂奶粉。将PVDF 膜放入混匀后的封闭液中,摇床封闭孵育2 h。结束后用1×TBST 溶液洗膜2 h,期间需要更换1×TBST。孵育抗体:用鼠源β-actin 单抗(1∶1 000)、鼠源Myc 单抗(1∶1 000)作为一抗,山羊抗小鼠辣根酶标记IgG(1∶1 000)作为二抗各孵育2 h,每次孵育结束后需用1×TBST 溶液洗膜2 h,洗膜时间,每次15 min;每次洗膜均在摇床上进行。曝光:用AI600 仪器曝光,保存结果图片。
1.6 间接免疫荧光
细胞传代爬片,待细胞密度长到60%左右时,用Lipofectin2000分别将pCMV-Myc 和pCMV-Myc-Nsp10 质粒转染至IPEC-J2 细胞中,于37 ℃5% CO2培养箱培养,6 h 后将DMEM 更换为10% FBS。继续培养18 h 后,吸弃上层细胞培养基,之后用灭菌后的PBS 洗细胞2 次,每孔加入500 μL 4%的多聚甲醛,室温固定20 min;PBS 洗细胞共3 次,15 min·次-1。加入0.1% Triton X-100,室温透膜20 min;PBS 清洗细胞3 次,15 min·次-1;加入5% BSA 封闭2 h(5% BSA需要现用现配),用鼠源Myc 单克隆抗体(1:500)作为一抗孵育1 h;PBS 洗3 次;加入荧光素标记的山羊抗小鼠IgG(1∶500)作为二抗室温避光孵育2 h;孵育结束后PBS 洗3 次。最后取干净且灭菌后的载玻片,滴少量的封片剂,用针头挑出爬片,将带有细胞的面放在封片剂上,用纸巾轻轻将多余的液体吸干,压紧,再将指甲油均匀涂抹在爬片周围,阻止细菌进入细胞中。将载玻片在避光处晾干,待片子干燥后用荧光显微镜观察拍照,并保存图片。
2 结果与分析
2.1 Nsp10 基因片段的PCR 扩增
在研究中,利用设计的PEDV Nsp10 的特异性上、下游引物对其进行PCR 扩增,电泳后在大约在400 bp 处出现目标条带,即为特异的Nsp10 基因片段,结果如图1 所示。
2.2 真核表达载体pCMV-Myc 的双酶切
通过借助pCMV-Myc 真核表达载体连接目的基因来完成重组质粒的构建,需对两者产生相同的酶切位点,借助EcoRⅠ与XhoⅠ对上述两种基因同时进行双酶切。结果如图2 所示,目的基因与载体双酶切成功。

图2 Nsp10 基因片段与pCMV-Myc 载体的双酶切Fig.2 Double enzyme digestion of Nsp10 gene fragment and pCMV-Myc vector
2.3 重组质粒pCMV-Myc-Nsp10 的PCR 鉴定
利用无缝克隆酶2×Seamless 将目的基因和载体的酶切产物进行连接,得到重组质粒pCMV-Myc-Nsp10。利用PCR 的方法对所得的重组质粒进行初步鉴定,电泳结果发现在400 bp 附近处出现目标条带,结果如图3 所示。

图3 重组质粒pCMV-Myc-Nsp10 的PCR 鉴定Fig.3 PCR Identification of recombinant plasmid pCMV-Myc-Nsp10
2.4 重组质粒pCMV-Myc-Nsp10 的双酶切鉴定
为了鉴定重组质粒pCMV-Myc-Nsp10 是否构建成功,将质粒进行双酶切鉴定,加入EcoRⅠ酶,XhoⅠ酶,Buffer,去离子水,总体系10 μL 置于37 ℃水浴锅中2 h。双酶切产物电泳后在3 000 bp 和405 bp左右处出现两条条带,条带大小与理论大小相符,结果如图4 所示。

图4 重组质粒pCMV-Myc-Nsp10 的双酶切分析Fig.4 Double enzyme digestion analysis of recombinant plasmid pCMV-Myc-Nsp10
2.5 重组表达载体序列比对
为了鉴定重组质粒序列与NCBI 公布的Nsp10基因序列的同源性,取10 μL 重组质粒pCMV-Myc-Nsp10,送至擎科生物(北京)公司进行测序,将NCBI网站上公布的PEDV Nsp10 原始序列与所得到的重组质粒测序结果进行了多序列比对,结果如图5 所示其同源性高达99%。
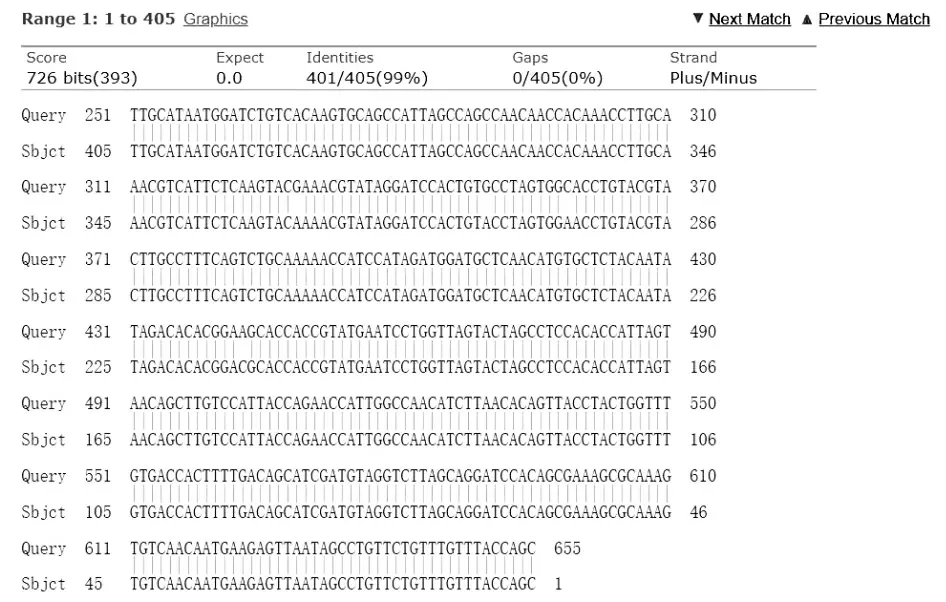
图5 pCMV-Myc-Nsp10 与CV777 毒株序列比对Fig.5 Sequence alignment between pCMV-Myc-Nsp10 and CV777 strains
2.6 重组表达载体在细胞中的分布
研究主要以间接免疫荧光技术探究了pCMVMyc-Nsp10 在IPEC-J2 细胞中的分布情况以及定位的情况。免疫荧光结果显示,重组表达载体pCMVMyc-Nsp10 质粒在IPEC-J2 细胞中成功表达,大部分分布在细胞质中少数分布在细胞核,结果如图6 所示。

图6 Nsp10 蛋白在IPEC J2 细胞中的表达Fig.6 Expression of Nsp10 protein in IPEC-J2 cells
2.7 Western Blot 检测IPEC-J2 细胞中表达的重组蛋白
为了确定重组质粒pCMV-Myc-Nsp10 在IPECJ2 细胞中的表达情况,先后利用小鼠抗Myc 标签单抗及FITC 标记的山羊抗小鼠二抗对空载体pCMVMyc 及重组表达载体pCMV-Myc-Nsp10 进行Western Blot 检测,其结果显示,重组pCMV-Myc-Nsp10在IPEC-J2 细胞中成功表达,结果如图7。

图7 Western Blot 鉴定蛋白融合表达Fig.7 Western Blot Determination of fusion protein expression
3 讨论
PEDV 是引起猪流行性腹泻的一种单股正链RNA 病毒,该病毒能引起不同年龄段的猪出现厌食、腹泻、脱水,并引起不同年龄段的哺乳仔猪大量死亡,死亡率高达百分之九十以上[21]。猪流行性腹泻首次爆发于英国,2010 年在我国大规模的爆发,给我国养猪业带来了前所未有的打击[22]。当PEDV 感染猪小肠上皮(IPEC-J2)细胞后,会破坏机体的免疫系统,并调控先天免疫应答,从而引起细胞损伤[23]。
在PEDV 全基因组中,除5’端帽子和3’端poly(A)尾等结构,还包含5’非翻译区(UTR)结构、七个开放阅读框(ORF1a,ORF1b 和ORF2-6)和3’非翻译区(UTR)结构[24-25]。其中,两个较大的开放阅读框ORF1a 和ORF1b 占据了PEDV 全基因组将近三分之二的部分,用来编码基因组的非结构蛋白(Nonstructural proteins,Nsps),即Nsp1-Nsp16,这些非结构蛋白不仅调控着各种病毒复制相关的酶活性,而且对宿主免疫系统也有着一定的影响[26]。
在这些非结构蛋白中,有很多具有酶活性的重要蛋白,这些蛋白是保证PEDV 复制的主要关键酶[27]。例如:Nsp11、Nsp12、Nsp13、Nsp14 和Nsp15 等。其他的非结构蛋白分别在病毒的成熟、转录调节、复制、代谢和出芽等方面都有一定的作用效果,但是还未见有研究报道其具体地作用机制[28]。有研究报道,PDCov 的Nsp10 蛋白可以以不依赖于其锌指结构域的方式拮抗β 干扰素的产生[29];冠状病毒Nsp10/Nsp16 甲基转移酶可被Nsp10 衍生肽靶向以减少病毒的复制和发病机制[30]。但目前关于PEDV 以及其编码的非结构蛋白Nsp10 的表达及生物学功能研究的试验或者文献相对较少。所以,探究PEDV Nsp10 蛋白在调控病毒复制或影响细胞免疫方面具有重要的意义。因此,PEDV Nsp10 重组质粒的构建为后续研究其在PEDV 复制过程中具有重要的作用。
4 结论
研究主要利用RT-PCR 的方法,扩增得到长度为405 bp 的PEDV Nsp10 基因,与GenBank 上已经公布的PEDV Nsp10 基因序列的同源性高达99%。随后,将PEDV Nsp10 基因插入到pCMV-Myc 表达载体中,成功构建了pCMV-Myc-Nsp10 重组表达载体。试验为后续研究关于PEDV Nsp10 蛋白的生物学功能和其在抗病毒反应中所发挥的作用等方面奠定了研究基础。

