A25Δ43K OMP 基因缺失株和亲本株对坏死杆菌生物被膜和耐药性影响的比较与分析
蒋凯,赵鹏宇,贺显晶,郭东华
(黑龙江八一农垦大学,大庆 163319)
坏死杆菌(Fusobacterium necrophorum,F.necrophorum)是一种无鞭毛、无芽孢、严格厌氧的革兰阴性细菌,多以长杆状存在于自然界中[1]。坏死杆菌感染动物可造成反刍动物腐蹄病、犊牛白喉、牛肝脓肿、奶牛乳房炎和子宫内膜炎等疾病,并在宿主体内长期存在造成持续性感染[2-4]。坏死杆菌感染对肉牛和奶牛养殖业造成巨大经济损失。
多种证据表明,持续的微生物感染多是以生物被膜(Biofilm)形式存在的细菌所引起的[5]。生物被膜是细菌的一种特殊存在形式,由细菌和自身产生的胞外多糖、胞外DNA 和胞外蛋白共同组成,常附着在生物或非生物载体表面[6]。生物被膜的存在为细菌生长提供稳定的环境,使细菌免受干燥、免疫系统攻击、原生动物摄取和抗菌剂等环境压力的影响[7]。生物被膜的形成主要包括细菌不可逆的表面黏附、细菌增殖与胞外基质的产生和细菌的分离三个连续阶段[8]。细菌的黏附因子在生物被膜形成过程中起着重要作用[9]。对具核梭杆菌使用黏附素RadD 血清孵育后,显著减弱了生物被膜的形成[10]。使用外膜蛋白FomA疫苗接种后,显著降低了口腔生物被膜的形成[11]。
43K OMP 是坏死杆菌的一个重要外膜蛋白,由Sun 等[12]首次在坏死杆菌中鉴定发现。随后的研究显示43K OMP 与坏死杆菌黏附宿主细胞的能力有关,是坏死杆菌重要的黏附因子之一[13-15]。43K OMP 在坏死杆菌生物被膜形成过程中是否发挥作用,尚未有人研究。因此,通过对坏死杆菌亲本株A25 和缺失株A25Δ43K OMP 生物被膜成熟时间、生物被膜不可逆附着阶段菌量、生物被膜形态和对临床常见药物耐药性进行研究,确定43K OMP 基因与生物被膜形成特性的关系。
1 材料和方法
1.1 菌株
坏死杆菌亲本株A25 株购自美国ATCC(Fusobacterium necrophorum,Fnn亚种,ATCC 25286),坏死杆菌43K OMP 基因缺失株(A25Δ43K OMP)由黑龙江八一农垦大学兽医分子病理学实验室构建并保存。
1.2 主要试剂仪器
主要试剂:苛养厌氧菌肉汤培养基(FAB)和脑心浸液肉汤培养基(BHI)购自山东托普生物工程有限公司;琼脂购自广州赛国生物科技有限公司;结晶紫、碘化丙啶(PI)和荧光素-伴刀豆凝集素标记物(ConA-FITC)购自上海Sigma-Aldrich 贸易有限公司;甲砜霉素、氨苄青霉素、红霉素、诺氟沙星、盐酸林可霉素、四环素、磺胺嘧啶、庆大霉素、卡那霉素、安普霉素和氯霉素购自上海阿拉丁生化科技股份有限公司。
主要仪器:厌氧培养箱(YQX-Ⅱ)购自上海龙跃仪器设备有限公司;分光光度计(T6 新悦)购自北京普析通用仪器有限公司;酶标仪(Infinite 200 PRO)购自瑞士TECAN 公司;荧光显微镜(INTENSILIGHT C-HGFI)购自株式会社尼康。
1.3 试验方法
1.3.1 细菌培养
取出存放于-80 ℃冰箱的坏死杆菌A25 与A25Δ43K OMP 菌液,用接菌环蘸取菌液于FAB 固体平板划线,在37 ℃厌氧环境下培养48 h,挑取单菌落接种于5 mL FAB 培养基试管中(缺失株培养基中加入甲砜霉素),37 ℃厌氧培养,连续传菌至3 代后用于后续试验。
1.3.2 生物被膜测定
取无菌12 孔板,每孔加入2 mL 制备好的菌液(OD600nm=0.01),阴性对照为BHI 培养基,每组重复4 孔。37 ℃厌氧培养后,移除孔内液体,用无菌PBS溶液洗3 次;每孔加入1 mL 甲醇固定15 min,无菌PBS 溶液洗3 次;待孔内干燥后,每孔加入1 mL 结晶紫溶液染色5 min,无菌PBS 溶液洗3 次;待自然干燥后,每孔加入1 mL 95%乙醇溶液,静置30 min后用酶标仪测OD570nm值。
1.3.3 生物被膜成熟时间测定
取无菌12 孔板,每孔加入2 mL 制备好的菌液(OD600nm=0.01),阴性对照为BHI 培养基,每组重复4 孔。37 ℃厌氧培养,每24 h 更换BHI 培养基。分别在接种0.5、1、2、3、4 和5 d 用无菌PBS 溶液洗去浮游细菌,根据1.3.2 节方法进行结晶紫染色并测量OD570nm值,根据OD570nm值绘制生物被膜生长曲线。
1.3.4 不可逆附着菌量计数
取无菌12 孔板,每孔加入2 mL 制备好的菌液(OD600nm=0.01),阴性对照为BHI 培养基,每组重复4 孔。37 ℃厌氧培养,每24 h 更换BHI 培养基。分别在接种6、12、18 和24 h 用无菌PBS 溶液洗去浮游细菌,每孔加入1 mL 2%戊二醛固定1.5 h,无菌PBS溶液洗3 次;每孔加入1 mL PI 避光染色15 min,无菌PBS 溶液冲洗3 次,加入1 mL 40%甘油封顶后,通过荧光显微镜观察并随机选取3 个视野进行拍照,对每个视野随机选取3 个200 μm2区域进行菌量计数。
1.3.5 生物被膜形态观察
取无菌12 孔板,每孔加入2 mL 制备好的菌液(OD600nm=0.01),阴性对照为BHI 培养基,每组重复4 孔。37 ℃厌氧培养,每24 h 更换BHI 培养基。分别在接种2、3 和4 d 用无菌PBS 溶液洗去浮游细菌,每孔加入1 mL 2%戊二醛固定1.5 h,无菌PBS 溶液洗3 次;每孔加入1 mL ConA-FITC 避光染色30 min,无菌PBS 溶液冲洗3 次;每孔加入1 mL PI 避光染色15 min,无菌PBS 溶液冲洗3 次,加入1 mL 40%甘油封顶后,通过荧光显微镜观察并拍照。
1.3.6 耐药性检测
根据CLSI 标准,通过肉汤微量稀释法检测坏死杆菌对10 种抗生素的最小抑菌浓度(MIC)。取无菌96 孔板,前10 列作为试验组,第11 列作为阳性对照,第12 列作为阴性对照。将待测药物配制为256 μg·mL-1,加入第一孔,用BHI 培养基进行连续倍比稀释。试验组及阳性对照组每孔加入100 μL 坏死杆菌菌液(OD600nm=0.01),阴性对照组加入等体积BHI 培养基,每组4 个重复。37 ℃厌氧培养24 h 后,观察细菌生长情况并记录结果。
1.4 数据分析
2 结果与分析
2.1 生物被膜成熟时间
为研究43K OMP 基因缺失对坏死杆菌生物被膜成熟时间是否产生影响,对接种亲本株A25 和缺失株A25Δ43K OMP 所产生的生物被膜进行结晶紫染色,测定OD570nm值。结果如图1 所示,亲本株A25与缺失株A25Δ43K OMP 生物被膜形成时间无显著差异,接种1 d 生物被膜无显著增长现象,接种2 d开始形成生物被膜,接种4 d 生物被膜成熟。坏死杆菌缺失43K OMP 基因后,坏死杆菌成熟生物被膜含量显著升高。由此可见,43K OMP 基因缺失不影响坏死杆菌生物被膜成熟时间,但对生物被膜含量造成影响。
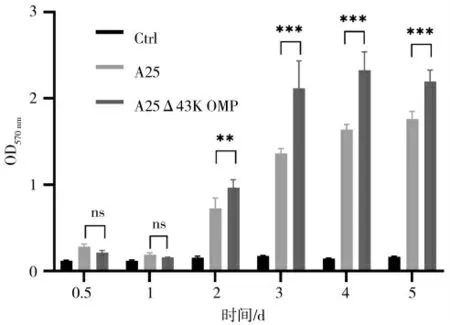
图1 生物被膜成熟时间测定Fig.1 Determination of maturation time of biofilm
2.2 生物被膜不可逆附着菌量
为研究缺失43K OMP 基因对生物被膜不可逆附着阶段细菌附着数量的影响,根据生物被膜成熟时间选定接种24 h 以内为不可逆附着阶段,对接种6、12、18 和24 h 生物被膜进行PI 染色,荧光染料PI特异性与细菌DNA 进行结合发出红色荧光,通过荧光显微镜对200 μm2内细菌进行计数,结果如表1和图2 所示。在接种6~18 h,亲本株A25 与缺失株A25Δ43K OMP 含量均无显著差异,接种24 h,缺失株A25Δ43K OMP 细菌含量显著下降。结果表明:缺失43K OMP 基因对坏死杆菌生物被膜形成早期的不可逆附着阶段有一定影响。
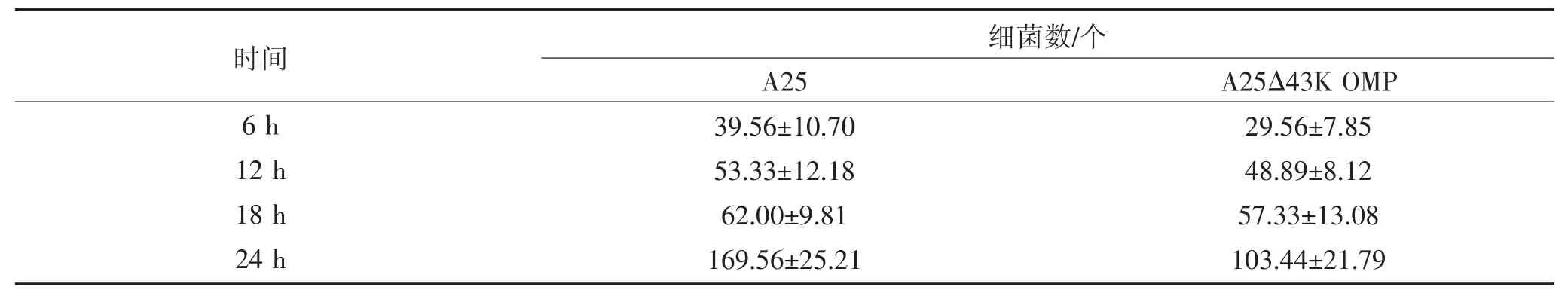
表1 生物被膜不可逆附着阶段细菌含量Table 1 Bacterial content in the irreversible attachment stage of biofilm

图2 生物被膜不可逆附着阶段细菌含量Fig.2 Bacterial content in the irreversible attachment stage of biofilm
2.3 生物被膜形态
为研究43K OMP 基因缺失对坏死杆菌生物被膜形态是否产生影响,用荧光染料ConA-FITC 特异性结合生物被膜内胞外多糖并发出绿色荧光,用荧光染料PI 复染特异性结合生物被膜内细菌DNA 分子并发出红色荧光,在荧光显微镜下观察坏死杆菌亲本株A25 和缺失株A25Δ43K OMP 的生物被膜形态。结果如图3 所示,坏死杆菌亲本株A25 和缺失株A25Δ43K OMP 均检测到生物被膜的形成。亲本株A25 接种3 d 出现聚集性小菌落;缺失株A25Δ43K OMP 接种2 d 出现聚集性菌落,接种4 d 出现沟壑状结构。43K OMP 基因的缺失对坏死杆菌生物被膜形态未产生影响,但对生物被膜菌落形成时间产生影响。

图3 生物被膜的荧光显微镜图像(200×)Fig.3 Fluorescence microscope image of biofilm(200×)
2.4 最小抑菌浓度(MIC)检测
为研究43K OMP 基因缺失对坏死杆菌耐药性的变化,检测亲本株A25 和缺失株A25Δ43K OMP对10 种抗菌药的MIC 值。结果如表2 所示,缺失43K OMP 基因后,坏死杆菌对磺胺嘧啶、庆大霉素、卡那霉素和安普霉素的耐药性减弱。结果表明,缺失43K OMP 基因对坏死杆菌耐药性产生影响。
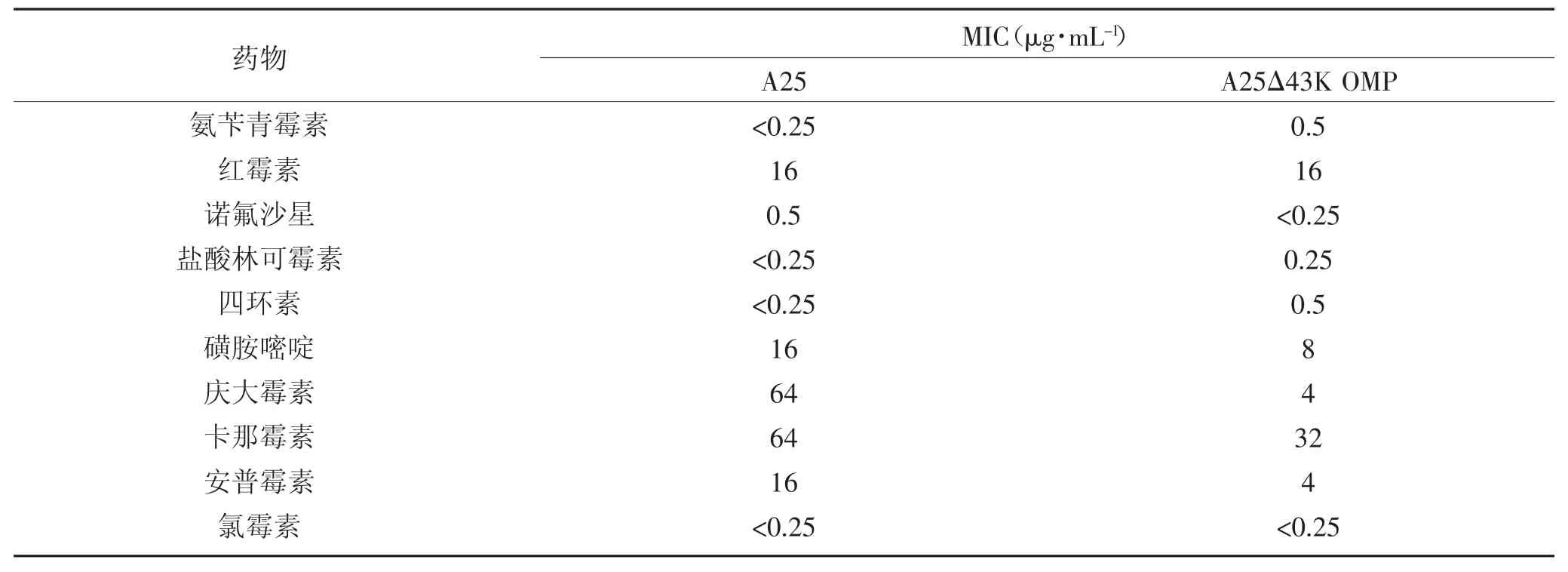
表2 亲本株A25 和缺失株A25Δ43K OMP 对10 种抗菌药的MICTable 2 MIC of A25 and A25Δ43K OMP against 10 antibiotics
3 讨论
检测生物被膜的方法有很多种,主要包括刚果红琼脂培养基法、结晶紫染色法、扫描电子显微镜法、激光共聚焦扫描显微镜法、质谱分析和PCR 检测法[16]。研究采用结晶紫染色法对坏死杆菌生物被膜进行定量研究。结果显示,坏死杆菌亲本株A25 和缺失株A25Δ43K OMP 接种2 d 开始形成生物被膜,接种4 d 生物被膜含量不再增加,生物被膜成熟。缺失株A25Δ43K OMP 所产生的生物被膜含量显著高于亲本株A25 所产生的生物被膜含量。由此可见,43K OMP 基因在坏死杆菌生物被膜形成过程中起到一定作用。在坂崎肠杆菌(Cronobacter sakazakii)的研究中,坂崎肠杆菌在NaCl 胁迫下缺失外膜蛋白OmpW的菌株形成的生物被膜含量显著高于亲本株,这可能是缺失突变株通过促进生物被膜的形成来适应NaCl 胁迫[17]。43K OMP 基因的缺失导致坏死杆菌对外界环境感知降低,从而增强生物被膜形成促进自身存活。
坏死杆菌43K OMP 由Sun 等[12-13,18]首次发现,在后续研究中发现其能够介导坏死杆菌黏附宿主细胞。利用重组43K OMP 制备的血清与坏死杆菌共孵育后可抑制坏死杆菌与仓鼠肾细胞(BHK)细胞的结合[14,19]。2022 年He 等[15]研究发现43K OMP 可与纤连蛋白结合介导坏死杆菌与BHK 细胞黏附。43K OMP是坏死杆菌重要的黏附因子之一。在生物被膜形成初期,细菌的黏附因子在不可逆附着阶段起重要作用。在艰难梭菌生物被膜研究中,其表面蛋白及大分子如鞭毛、Ⅳ型菌毛和S 层均参与生物被膜的形成[20]。在粪肠球菌黏附素ace 基因的研究中,存在ace基因的肠球菌生物被膜平均厚度、细菌密度及活菌比例均高于无ace 基因的肠球菌[21]。43K OMP 基因的缺失导致接种24 h 坏死杆菌生物被膜含菌量显著降低,这说明43K OMP 基因对生物被膜形成具有一定影响。
生物被膜的结构形态与细菌的菌种相关,小菌落是大多数生物被膜的基本单位,但是其结构因细菌种类而差异巨大。在流动培养室相同条件下培养,恶臭假单胞菌(Pseudomonas putida)形成松散突出的小菌落,而假单胞菌(Pseudomonas knackmussii)则形成球形小菌落[22]。此外,当两种假单胞菌在生物膜中一起生长时,其菌落特征互不影响[22]。生物被膜形态结构不仅与细菌种类有关,也与细菌所处的环境有关。Klausen 等[23]证明当铜绿假单胞菌用葡萄糖培养基培育时,所形成的生物被膜则为蘑菇状的小菌落,而在用柠檬酸盐培养基培育时,则形成平坦的生物被膜。在研究中,通过荧光显微镜观察坏死杆菌亲本株A25 和缺失株A25Δ43K OMP 的生物被膜形态。结果显示亲本株A25 和缺失株A25Δ43K OMP 均产生沟壑状生物被膜,缺失株A25Δ43K OMP 的沟壑结构出现的更早。生物被膜形成后期,生物被膜内形成部分通道,这些通道可输送营养物质和分布氧气并能去除废弃产物[24]。43K OMP 基因的缺失使得坏死杆菌更早的出现沟壑结构,43K OMP 基因可能介导坏死杆菌营养输送。
生物被膜的形成使得细菌的耐药性增加,其耐药性比游离细菌提高了甚至1 000 倍,给疾病治疗带来了严重的挑战[25]。研究中,缺失43K OMP 基因使得坏死杆菌对庆大霉素、卡那霉素和安普霉素的耐药性减弱。该三类药物均属于氨基糖苷类药物,主要用于治疗革兰阴性需氧菌、葡萄球菌和其他革兰阳性菌引起的感染,革兰阴性厌氧菌对氨基糖苷类药物具有一定耐药性[26]。氨基糖苷类抗生素耐药主要通过突变16S rRNA、甲基化16S rRNA、改变细胞膜通透性、外排泵泵出细胞内抗生素和低活性乙酰转移酶螯合抗生素[27]。有研究预测,坏死杆菌43K OMP 结构更倾向于孔蛋白[28]。那么43K OMP 在坏死杆菌外膜上是否调控细胞膜的通透性直接影响到坏死杆菌对营养摄取、胞外基质酶排出和药物排出等功能,43K OMP 是否作为外排泵使得坏死杆菌对氨基糖苷类药物产生耐药,还需进一步研究,对43K OMP 结构的揭示将有助于对43K OMP 功能的研究。因此,坏死杆菌43K OMP 基因缺失促进坏死杆菌生物被膜的形成,抑制坏死杆菌对氨基糖苷类药物的耐药。

