甘薯IbHQT1启动子的克隆及上游调控因子的鉴定
徐靖 朱红林 林延慧 唐力琼 唐清杰,2 王效宁,2
(1. 海南省农业科学院粮食作物研究所 海南省农作物遗传育种重点实验室,海口 571100;2. 海南省农业科学院三亚研究院,三亚 572000)
绿原酸是广泛存在于植物中的酚类化合物,具有抗菌、抗病毒、活血降压、抑制肿瘤和清除自由基等生物活性[1-3]。随着对天然抗氧化剂需求量的增加,从植物中提取的绿原酸供不应求。甘薯(Ipomoea batatas L.(Lam.))茎、叶和块根中均含有绿原酸类物质,能够成为提取绿原酸类物质的新资源[4-5]。甘薯中的绿原酸可以降低餐后血糖,同样也显示出较好的抗氧化能力,其含量已成为评价菜用甘薯品质的一个重要指标[6-9]。此外,绿原酸等酚类物质的存在能够提高甘薯的抗病和抗虫害能力[10-12]。目前,甘薯绿原酸的研究主要集中在生物活性方面,但其生物合成途径和分子调控机制还不清楚[13-14]。揭示甘薯绿原酸的生物合成和调控途径,挖掘绿原酸积累相关基因,对开展高绿原酸甘薯新品种的选育具有重要意义。
羟基桂皮酰辅酶A羟基桂皮酰转移酶(hydroxycinnamoyl CoA quinate hydrocycinnamoyl transferase,HQT)是植物绿原酸生物合成的关键酶。在蒲公英、马铃薯、金银花和烟草等植物中过表达或抑制HQT后绿原酸含量发生明显提高和降低[15-21]。转录因子可激活类黄酮、单宁和木质素等次生代谢物生物合成途径中多个酶基因协同表达,在苯丙素类物质生物合成中起着重要的调控作用[22-23]。目前,对类黄酮生物合成调控的研究比较深入,其合成途径中的PAL、C4H、CHS、CHI、F3H、DFR等关键酶基因的表达受到MYB、bHLH、WD40、WRKY、NAC和bZIP等转录因子的调节[24]。
前期研究表明,甘薯中存在2个HQT编码基因,其中,HbHQT1可能是甘薯绿原酸生物合成的关键基因[25],但对其表达调控仍不清楚。
本研究利用酵母单杂交技术在甘薯叶cDNA酵母文库中筛选与HbHQT1启动子结合的上游转录调控因子,为进一步揭示HbHQT1在甘薯绿原酸生物合成中的作用和转录调控机制奠定基础。
1 材料与方法
1.1 材料
甘薯(QS80-12-11)是海南本地种植的菜用甘薯品种,种植于海南省农业科学院永发实验基地海南省甘薯种质资源保存圃内,生长60 d后,取甘薯叶片洗净表面后用液氮速冻后,-80℃保存。
1.2 方法
1.2.1 总RNA的提取与cDNA文库构建 采用Trizol法提取甘薯叶RNA,通过核酸蛋白检测仪NanoDrop 2000C检测RNA纯度和完整性。按照DynabeadsTMmRNA纯化试剂盒说明书进行mRNA的分离纯化,用酵母单杂交文库构建试剂盒进行双链cDNA的合成和纯化,将双链cDNA与pGADT7-Rec线性质粒载体共转化酵母菌Y187中进行cDNA文库构建,并对文库质量进行鉴定。
1.2.2 IbHQT1启动子的克隆及诱饵载体的构建 根据甘薯基因组数据(https://sweetpotao.com/download_genome.html)中IbHQT1翻译起始密码子上游约1500 bp启动子序列设计特异引物P1(5'-CACACTGGTTTGAGAAGTG-3')和P2(5'-TTAAACTTCTCACTTGCCAT-3'),以甘薯(QS80-12-11)基因组DNA为模板进行PCR扩增,扩增产物经电泳检测后切胶回收,连接pMD19-T载体,转化大肠杆菌DH5α感受态细胞,挑取单克隆进行菌液PCR验证,阳性克隆送至中美泰和生物技术(北京)有限公司进行测序。利用在线软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/PLACE)对启动子区顺式作用元件进行预测。将IbHQT1启动子序列通过同源重组的方法连接到pHIS2载体中,获得pHIS2-IbHQT1pro诱饵载体。
1.2.3 酵母单杂交文库的筛选 将pHIS2-IbHQT1pro诱饵载体转入Y187菌株中制备诱饵菌株,阳性克隆稀释后涂板至添加不同浓度(0、50和75 mmol/L)3AT的SD/-Trp-His平板上,测定能够抑制HIS3表达的最低3-AT浓度。将文库质粒转入诱饵菌株,涂在含有合适3-AT的SD/-Leu-Trp-His平板上,30℃ 3-5 d后,挑取能够正常生长的单菌落进行复筛,仍能够继续正常生长的视为互作蛋白。最后,进行菌落PCR检测,将具有单一条带且大于1000 bp的PCR产物进行基因测序。测序结果通过NCBI Blast进行同源检索,筛选潜在的转录调控因子。
1.2.4 阳性克隆的酵母单杂交验证 将候选互作转录因子基因连接到pGADT7载体并转入pHIS2-IbHQT1pro诱饵菌株,在SD/-Trp-His平板上30℃倒置培养3-5 d,转移单菌落在含有3-AT的SD/-Leu-Trp-His平板上进行复筛,验证候选互作基因与IbHQT1启动子的结合的真实性。
1.2.5 基因表达及相关性分析 根据已发表的数据[25],提取基因表达和绿原酸含量数值,利用EXCEL软件中的CORREL函数来计算两者之间的相关性系数,利用在线软件Chiplot(https://www.chiplot.online/)绘制相关性热图。
2 结果
2.1 IbHQT1启动子的克隆与顺式作用元件分析
根据IbHQT1上游序列设计引物,通过PCR进行扩增获得目的片段,并连接pMD19-T载体进行测序,结果表明,IbHQT1起始密码子1500 bp启动子序列已成功克隆。序列分析显示,IbHQT1启动子中除了包含典型的真核生物启动子顺式元件CAATbox和TATA-box外,还存在水杨酸响应元件TCAelement、赤霉素响应元件TATC-box、乙烯响应元件ERE、茉莉酸响应元件CGTCA-motif、生长素反应元件AuxRR-core和脱落酸响应元件ABRE,胁迫响应元件STRE和TC-rich repeats及多个光响应元件如AE-box、Box 4、GATA-motif和G-box。此外,IbHQT1启动子还含有AAAG/CTTT、RAA、W-Box、MBS、MYC和TGACG元件(图1),这些元件可以被DOf、ERF、WRKY、MYB、MYC和TGA转录因子识别。结果表明,IbHQT1的表达可能受到上述激素和转录因子的调控。

图1 IbHQT1启动子序列及主要顺式元件Fig. 1 Promoter sequences of IbHQT1 and main cis-elements
2.2 pHIS2-IbHQT1pro诱饵质粒3AT浓度筛选
将1500 bp的IbHQT1启动子与酵母单杂交载体pHIS2连接,构建诱饵载体pHIS2-IbHQT1pro。将构建成功的pHIS2-IbHQT1pro质粒转化Y187酵母菌,并涂平板培养3 d后,随机挑取3个单菌落稀释后涂板至不同浓度(0、50和75 mmol/L)3AT的SD/-Trp-His平板上,30℃培养3 d。结果显示,随着3AT浓度增加,转化子数量明显减少(图2-A,B),而当3AT添加到75 mmol/L时转化子基本不生长(图2-C),表明75 mmol/L的3AT浓度可以有效抑制HIS3报告基因的表达,该浓度可用于后续文库筛选。

图2 pHIS2-IbHQT1pro诱饵载体自激活检测Fig. 2 Self-activation of pHIS2-IbHQT1pro bait vector
2.3 酵母单杂交文库构建和质量鉴定
核酸浓度检测显示OD260/280为1.94,OD260/230为2.27,28S/18S为2.27,说明总RNA质量和纯度较好,可用于构建酵母单杂交cDNA文库。将纯化后的双链cDNA与线性化的pGADT7-Rec2载体共转化酵母菌,经筛选后,获得230个单菌落,总库容量为1.15×107CFU,大于107。挑取平板上的单克隆进行PCR扩增和检测,结果表明,平均插入片段大于1200 bp,阳性率为100%(图3),说明酵母单杂交文库构建成功,可以用于下一步试验。

图3 文库插入片段长度的PCR 检测Fig. 3 Detection of inserted fragment lengths in the library by PCR
2.4 酵母单杂交文库互作蛋白的初步筛选
利用共转化方法将25 μg文库质粒和5μg pHIS2-IbHQT1pro诱饵质粒共转化Y187酵母感受态细胞。将转化产物在含75 mmol/L的3AT的SD/-Trp-Leu-His平板上培养3-5 d,初步筛选获得17个转化子,将这些阳性克隆转化子分别用无菌水稀释后进行点板复筛,发现17个转化子均能在添加3-AT的筛选平板上旺盛生长(图4-A)。对17个阳性克隆PCR产物测序并进行Blast比对分析,结果显示,有2个为推定的转录因子,分别与MYB转录因子MYB11-like(NCBI登录号:LOC125212678)和TGA转录因子TGA2.2-like(NCBI登录号:LOC116027932)同源,其余大多为功能未知的蛋白,这2个转录因子(IbMYB11和IbTGA2.2)可能与IbHQT1启动子存在潜在互作关系。

图4 IbHQT1启动子互作蛋白的筛选和鉴定Fig. 4 Screening and identification of IbHQT1 promoter interacting proteins
2.5 IbMYB11和IbTGA2.2与IbHQT1启动子互作的鉴定
分别将IbMYB11-AD和IbTGA2.2-AD与pHIS2-IbHQT1pro诱饵载体进行酵母单杂交互作验证,结果显示,所有共转诱饵质粒和AD载体的酵母菌株在SD/-Trp-Leu培养基上均能正常生长;挑取SD/-Trp/-Leu培养基上的菌落至含75 mmol/L 3AT的SD/-Trp-Leu-His平板上,IbMYB11-AD/pHIS2-IbHQT1pro、IbTGA2.2-AD/pHIS2-IbHQT1pro和阳性对照克隆均可正常生长,而阴性对照则不能生长(图4-B),表明IbMYB11和IbTGA2.2蛋白可以与IbHQT1启动子发生互作。
2.6 IbMYB11、IbTGA2.2和IbHQT1基因共表达分析
为了解IbMYB11和IbTGA2.2与IbHQT1之间调控关系,根据已发表的转录组数据[25],分析其共表达特征发现,它们在所检测的甘薯嫩叶和嫩茎中高表达,在块根中表达量相对较低(图5-A)。利用CORREL函数进行相关性分析发现IbMYB11和IbTGA2.2与IbHQT1表达之间存在正相关,相关系数分别达到0.79和0.98(图5-B)。进一步分析发现IbMYB11和IbTGA2.2的表达与甘薯中6种绿原酸及总绿原酸含量明显正相关,相关系数均在0.75以上(图5-B)。结果表明,IbMYB11和IbTGA2.2可能通过调控IbHQT1参与甘薯绿原酸的积累。
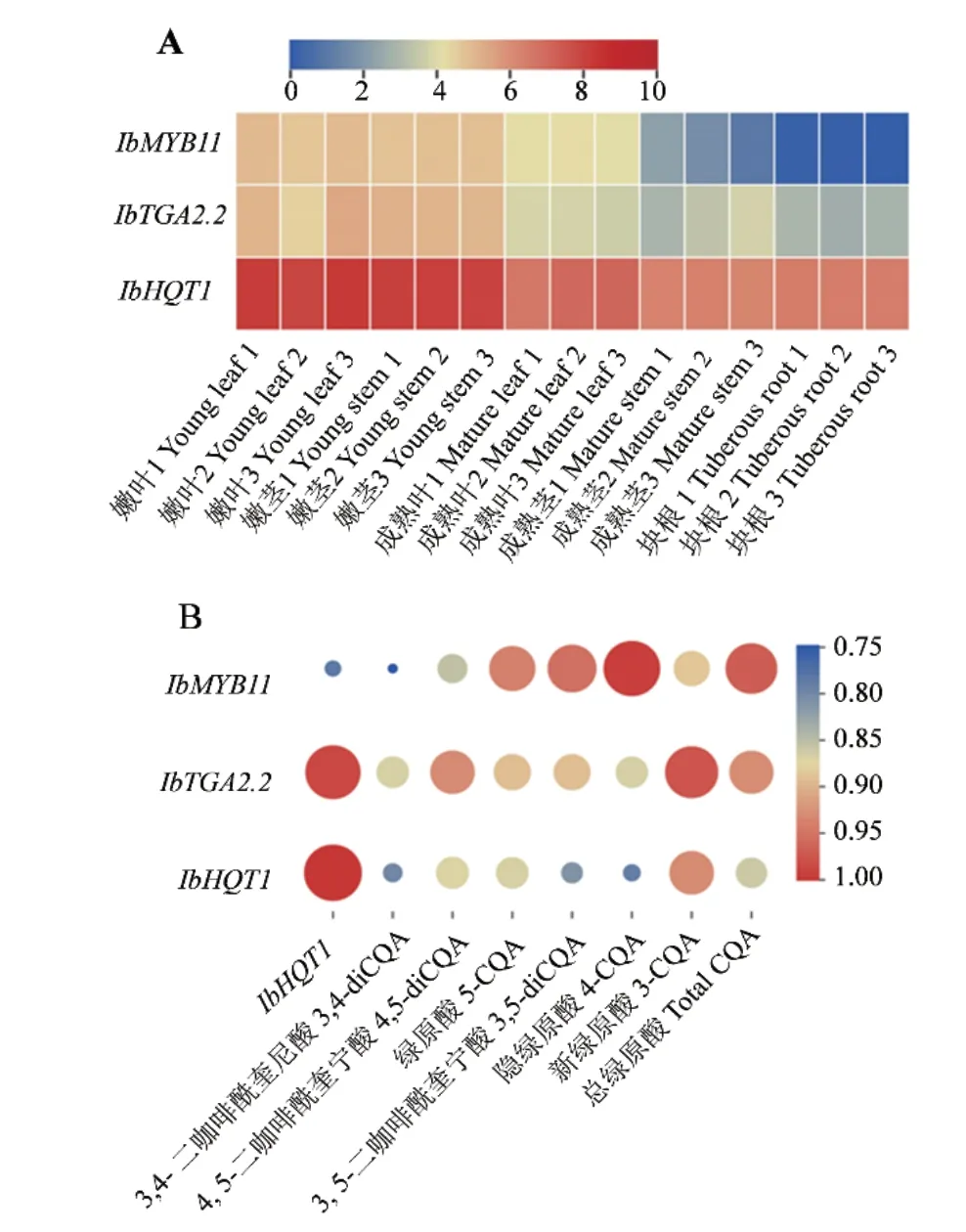
图5 IbMYB11、IbTGA2.2和IbHQT1共表达(A)及其与甘薯绿原酸积累相关性(B)Fig. 5 Co-expression of IbMYB11, IbTGA2.2 and IbHQT1(A)and their correlations with chlorogenic acid accumulation in sweet potato(B)
3 讨论
转录因子通过与下游靶基因启动子结合进而激活或抑制靶基因的表达,在植物次生代谢生物合成过程中具有重要的调控作用[26-27]。IbHQT1是甘薯绿原酸生物合成的关键酶基因,挖掘鉴定IbHQT1上游转录调控因子对揭示甘薯绿原酸生物合成调控机制具有重要的意义。本研究分离获得1500 bp的IbHQT1上游DNA序列,通过PlantCARE对IbHQT1启动子区进行顺式作用元件预测分析,结果显示,IbHQT1启动子区存在DOf、ERF、WRKY、MYB、MYC和TGA等多种转录因子结合位点,暗示IbHQT1的表达可能受到这些转录因子的调控;进一步利用酵母单杂交技术,以IbHQT1启动子序列为诱饵,筛选出2个与IbHQT1启动子区结合的转录因子IbMYB11和IbTGA2.2。
MYB转录因子在植物次生代谢物生物合成途径中具有重要的调控作用,尤其是对苯丙素类代谢物的调控研究比较深入[28-29]。MYB基因家族中第S4、S5、S6和S7亚家族成员广泛参与包括类黄酮、花青素和木质素在内的多种苯丙素类代谢物的生物合成[29-32]。本研究筛选到IbMYB11能够与IbHQT1启动子发生互作,IbMYB11属于S7亚家族成员,拟南芥中S7亚家族成员AtMYB11、AtMYB12和AtMYB111具有调控苯丙烷次生代谢产物黄酮醇生物合成的功能[33]。在番茄(Solanum lycopersicum)与烟草(Nicotiana tabacum)过表达拟南芥AtMYB11和AtMYB12均能促进绿原酸及黄酮醇的合成[34-35]。TGA转录因子是bZIP转录因子一个亚家族,能够特异结合靶基因启动子区的TGACG-motif,在植物生长发育、胁迫响应及次生代谢调控方面具有重要的功能[35]。目前,已证实TGA转录因子能够调控天然橡胶、青蒿素、雷公藤甲素和生物碱等次生代谢物生物合成[36-39],但其是否调控苯丙素类代谢物生物合成还未见报道。本研究发现IbTGA2.2能够与IbHQT1启动子发生互作,说明其可能参与甘薯绿原酸的生物合成调控。此外,IbMYB11、IbTGA2.2和IbHQT1在甘薯不同组织和发育阶段具有类似的表达特征,且与甘薯绿原酸含量存在明显的正相关。这些结果说明,IbMYB11和IbTGA2.2可能通过调控IbHQT1的表达参与甘薯绿原酸的生物合成的调控。转录因子在调控植物次生代谢时通常和其他转录共激活子或转录共抑制子形成复合体,例如,MYB通常与bHLH、WD40、ERF、NAC和WRKY等转录因子互作形成复合体协同调控代谢途径中的多个基因的表达,在植物苯丙烷类代谢物积累中发挥着重要的调控作用[40-43]。接下来将深入研究IbMYB11和IbTGA2.2转录因子对IbHQT1转录的调控效应,并鉴定还有哪些转录因子协同参与,为揭示甘薯绿原酸积累机制奠定基础。
4 结论
获得2个与IbHQT1启动子相结合的转录因子IbMYB11和IbTGA2.2,二者与IbHQT1具有类似的表达特征且与绿原酸积累正相关,可能通过调控IbHQT1的表达进而参与甘薯绿原酸的生物合成。

