2个芽变苹果品种枝条主要性状比较
李文芳,任振硕,李 龙,马宗桓,毛 娟,陈佰鸿
(甘肃农业大学 园艺学院,兰州 730070)
苹果短枝型品种是普通型苹果品种在内、外因素综合作用下自发突变形成的天然矮化种源。其树冠矮小,树姿直立,萌芽率高,成枝力弱,短枝比例高,成花容易,坐果率高[1-3],管理简便,具有较强的适应性、早果性、丰产性和稳定性的特点[4]。此外,短枝型品种枝条粗而短,枝上芽间距较窄,单位长度枝条上的叶片数量多,加之叶片大而厚,具有较高的光饱和点和较低的光补偿点,光能利用率高、呼吸消耗少,光合制造能力强,能够积累更多的光合产物,有利于提升苹果品质,同时充足的养分积累保证了树体的营养[5]。矮化密植是世界苹果栽培的发展方向,选用短枝型品种是苹果矮化密植的主要途径之一[6]。
研究表明,植物枝条节间变短现象与赤霉素(GA)密切相关。GA能够参与调控植物茎的伸长、种子萌发、叶片展开和果实发育等多个生长发育过程[7]。GA20-氧化酶(GA20ox)是植物GA合成途径中的关键酶,过量表达能导致赤霉素的过量合成和明显加快植株生长[8]。脱落酸(ABA)对植物的生长发育的调节作包括种子休眠、萌发、营养生长、环境胁迫反应等[9]。
ABA信号通路的关键参与者是ABA结合受体(RCAR/PYR1/PYL),能够与蛋白磷酸酶(PP2C)一起形成功能性全受体,与Snf1相关激酶SnRK2蛋白家族在ABA信号转录途径和抗渗透胁迫中扮演着重要的角色[10]。生长素IAA参与多种生理活动,包括细胞扩大、细胞周期调节和分化过程等[11]。生长素极性运输抑制剂响应蛋白(TIR1)是F-box蛋白家族的一员,为植物生长素受体,是植物生长素信号转导途径的关键因子。
在植物中,光合作用和源库组织中的碳代谢产生不同的糖信号,以调节生长、发育和应激反应。果树不同器官中碳水化合物的种类和含量在很大程度上影响并维持着果树的生长发育以及其他生理代谢过程[12],碳水化合物在果树体内主要以糖类物质及其代谢所产生的其他化合物的形式存在[13]。糖不仅为细胞碳和能量代谢提供燃料,而且作为信号分子发挥着关键作用。
可溶性糖如蔗糖、葡萄糖、果糖可以通过液泡膜上相应的转运蛋白运输到液泡中,液泡中糖浓度的增加会激活与糖代谢途径相关的酶和基因的表达,调节细胞不同腔室的渗透平衡[14]。蔗糖在转化酶的催化不可逆水解为葡萄糖和果糖,作为植物生长、产量形成和胁迫响应的营养物质、能量来源以及信号分子[15]。SnRKs蛋白激酶家族也在植物糖信号和碳代谢中起关键作用[16]。
本研究通过分析内源激素和可溶性糖含量在普通型和短枝型富士苹果品种之间的差异,结合PCR荧光定量分析相关基因的表达差异,分析判断不同种类、不同浓度激素和可溶性糖与短枝型芽变品种形成的关系,为探索苹果短枝芽变品种的形成机理提供理论基础,从而为苹果定向芽变育种提供科学依据。
1 材料和方法
1.1 材料与处理
供试材料选用普通型品种富士‘烟富8号’,短枝型品种‘惠民短枝’,砧木为山定子,树龄为10年,株行距为3 m×4 m,果园位于甘肃省天水市秦州区玉泉镇杨河村(34°34′N,105°50′E),常规管理。每个品种选取树势健壮、长势一致的苹果树9株,每3株为1个重复,在枝条快速生长期每株随机选取中上部外围1年生枝8~10个,同时随机采集一年生枝条中部的叶片、茎和茎尖,并将其速冻于液氮中2 h,-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1 枝条数据测定使用游标卡尺测量‘烟富8号’和‘惠民短枝’枝条中部的粗度;卷尺测定一年生枝条长度,统计一年生枝的节位数,根据节位数计算节间长度。
1.2.2 高效液相色谱(HPLC)法测定内源激素含量称取0.5 g冷冻样品用于测定IAA、ABA和GA3。每个样品与10 mL 80%色谱纯甲醇(用无DNase/RNase双蒸馏水制备)混合,洗涤3次,转移到试管中,在4 ℃的冰箱黑暗条件下保存10 h,然后,高速(13 000g)冷冻(4 ℃)离心20 min,将上清液转移到新的离心管中进行浓缩,在40 ℃下通过旋转蒸发使甲醇挥发,获得2 mL浓缩液。用50%色谱纯甲醇连续洗涤蒸发瓶壁,定容至10 mL,用0.22 μm有机相微孔滤膜过滤。用于HPLC的设备是LC-20AD系统(日本京都岛津),配备Zorbax Eclipse Plus C18柱(4.6 mm×250 mm×5.0 μm,Agilent,Palo Alto,CA,USA)和SPD-20A UV检测器。
配制不同浓度梯度的IAA、ABA和GA3的标样,绘制标准标曲。进样量为2 μL;流速为1 mL/min;柱温30 ℃;流动相为A∶B=(甲醇/0.1%甲酸)∶(水/0.1%甲酸)。
1.2.3 HPLC法测定可溶性糖含量冷冻样品加液氮快速研磨后,准确称取0.5 g至离心管中,加入5 mL 80%的乙醇,35 ℃超声提取20 min,4 ℃ 13 000g离心15 min,吸取上清液至新的10 mL离心管中。
用80%乙醇重复提取2次,每次加2 mL,最后定容至10 mL。用真空离心浓缩仪(60 ℃)旋转蒸发,除去多余的乙醇,旋转蒸发结束后,用1 mL超纯水1 mL乙腈复溶,然后过0.22 μm有机相微孔滤膜,至棕色进样品瓶中待测。配制不同浓度梯度的果糖、蔗糖、葡萄糖和山梨糖醇的标样,绘制标准标曲。进样量为10 μL,流速为0.8 mL/min,柱温40 ℃,流动相为乙腈(75%)+三乙胺(0.2%)+超纯水(24.8%)。
1.2.4 实时定量 qRT-PCR引物设计根据GenBank与苹果参考基因组上查询的苹果基因TIR1(MD11G1299000)、PYL(MD10G1257900)、SnRK2(NM_001301724.1)和GA20ox(XM_008378277.3)的CDS序列设计特异性引物(表1)。通过上海生工生物有限公司进行引物设计并合成。

表1 试验所用引物序列
1.2.5 RNA提取和cDNA合成使用RealPure普通植物RNA提取试剂盒[中科瑞泰(北京)生物科技有限公司]提取总RNA,RNase-free DNase I[宝日医生物技术(北京)有限公司]用于纯化RNA。使用琼脂糖凝胶(1%W/V)分析评估RNA质量,Pultton P200超微量分光光度计(Pultton Technology Limited)测量RNA纯度(D260/280),测定260 nm处的吸光值对RNA定量。之后,定量的RNA使用SuperScriptTMⅢ第一链合成 SuperMix InvitrogenTM[赛默飞世尔科技(中国)有限公司]逆转录成cDNA。
1.2.6 实时定量 qRT-PCR分析以苹果GADPH为内参基因,用LightCycler96实时荧光定量PCR仪进行荧光定量,对激素相关基因进行特异性表达分析。反应体系参照苏丽艳[17]的方法进行,具体为2 μL cDNA,上下引物各1 μL,SYBR Green Pro Taq HS 10 μL,6 μL ddH2O补足20 μL。反应程序为:95 ℃ 30 s,95 ℃ 10 s,58 ℃ 30 s,72 ℃ 20 s共40个循环,3次重复,采用2-ΔΔCT法对基因相对表达量进行计算[18]。
1.3 数据处理
使用Excel 2007进行数据统计分析,IBM SPSS statistics 22软件对均值之间的所有差异采用双向ANONA和Fisher’s least significant difference(LSD)进行显著性分析。
2 结果与分析
2.1 ‘烟富8号’与‘惠民短枝’枝条表型差异
从表型来看,‘烟富8号’的节间长度大于‘惠民短枝’突变体,而茎粗小于‘惠民短枝’(图1,A)。统计分析发现,‘烟富8号’的枝条粗度为5.10 mm,极显著低于‘惠民短枝’(5.51 mm)(图1,B),而节间长度为3.54 cm,极显著高于‘惠民短枝’1.2倍(图1,C)。
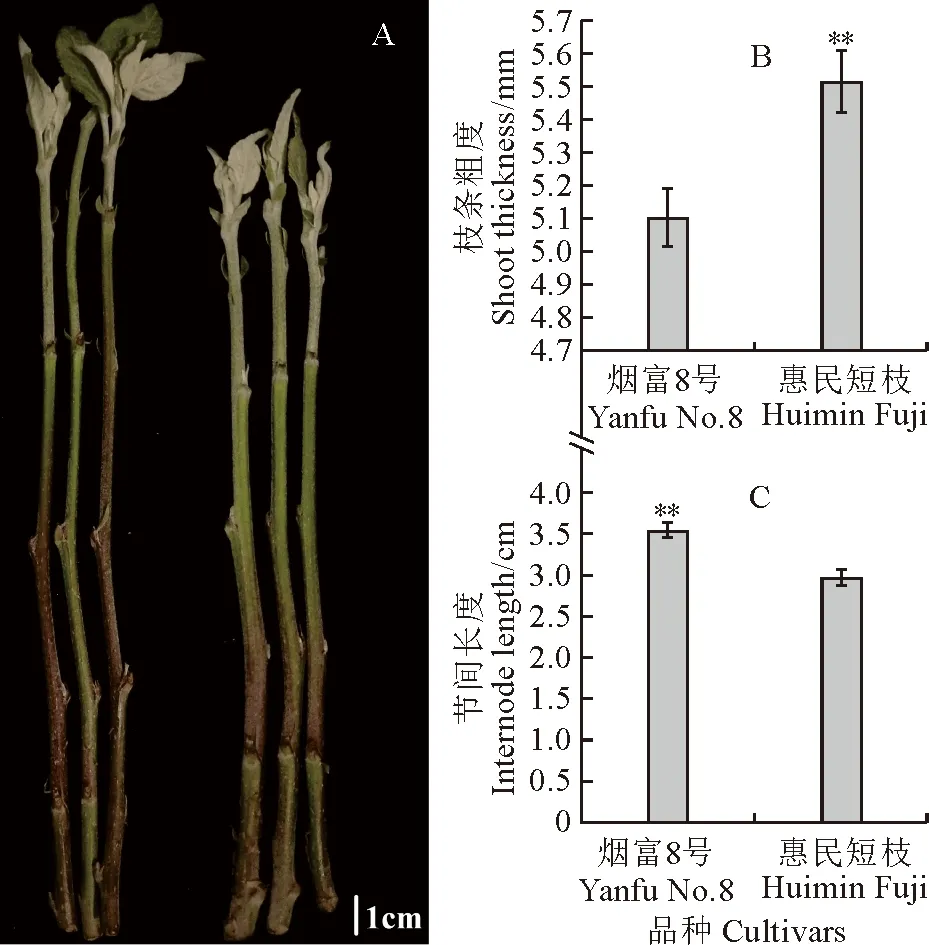
*和**分别表示2个品种间P< 0.05和P<0.01水平的差异。下同。图1 2个苹果品种枝条的表型性状* and ** indicate differences at 0.05 and 0.01 levels between two cultivars. The same as below.Fig.1 Phenotypic traits of branches from two cultivars
2.2 内源激素和可溶性糖含量分析
在茎中,GA3含量最高,ABA次之,IAA含量最低。其中,‘烟富8号’的GA3和IAA含量分别为54.72 μg/g和4.79 μg/g,是‘惠民短枝’的2.7倍和9.8倍,2个品种间达到极显著水平,而ABA含量仅为‘惠民短枝’的0.6倍(图2,A)。茎尖中,IAA含量最高,GA3次之,ABA含量最低。‘烟富8号’的GA3和IAA含量分别为30.52 μg/g和48.66 μg/g,为‘惠民短枝’的1.5倍和1.4倍,而ABA含量为‘惠民短枝’的0.7(图2,B)。
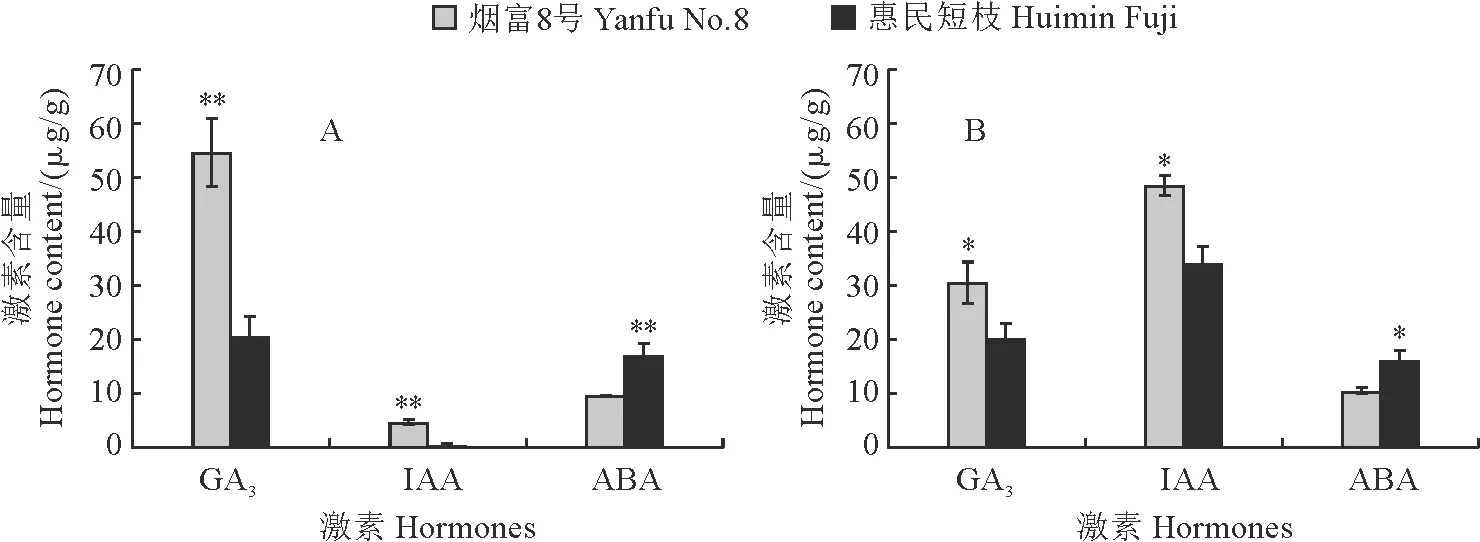
图2 2个品种茎(A)和茎尖(B)中不同激素含量比较Fig.2 Contents of GA3, IAA and ABA in stems (A) and stem tips (B) of two cultivars
在茎中,山梨糖醇含量最高,果糖次之,蔗糖和葡萄糖含量较低(图3,A)。其中,果糖和葡萄糖在‘烟富8号’和‘惠民短枝’之间无显著差异,而‘烟富8号’的蔗糖和山梨糖醇含量分别为‘惠民短枝’的2.5倍和1.3倍,在2个品种间达到极显著水平。茎尖中,山梨糖醇和果糖含量较高,蔗糖和葡萄糖含量较低(图3,B)。其中,果糖、蔗糖和山梨糖醇在‘烟富8号’和‘惠民短枝’之间无显著差异,而‘烟富8号’的葡萄糖含量仅为0.82 mg/g,是‘惠民短枝’的0.3倍。

图3 2个品种茎(A)和茎尖(B)中可溶性糖含量Fig.3 Sugar content in stems (A) and stem tips (B) of two cultivars
2.3 激素相关基因的表达分析GA3
图4显示:茎尖中,‘烟富8号’TIR1和GA20ox基因的表达水平均显著高于‘惠民短枝’,分别达54.5倍和1.2倍,而SnRK2和PYL分别为‘惠民短枝’的0.3倍和0.5倍。茎中,‘烟富8号’TIR1和GA20ox基因的表达水平分别为‘惠民短枝’的3.1倍和1.6倍,而SnRK2和PYL仅为‘惠民短枝’的0.1倍和0.2倍。叶片中,‘烟富8号’GA20ox基因的表达水平为‘惠民短枝’的7.0倍,达显著水平,而TIR1、SnRK2和PYL在2个品种间无显著差异。
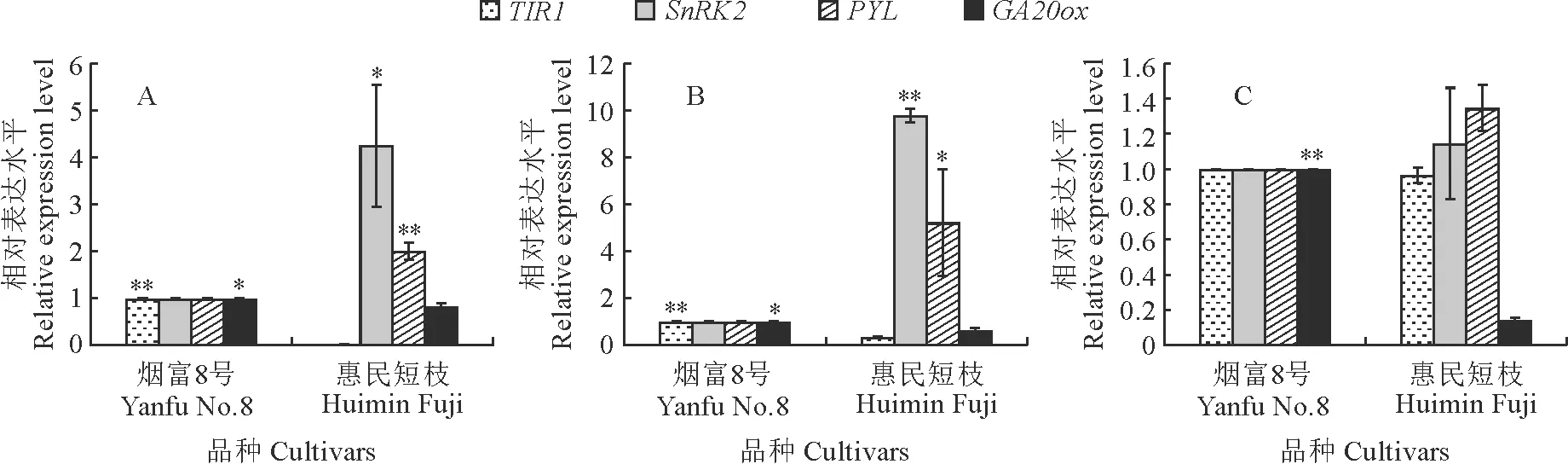
图4 2个品种茎尖(A)、茎(B)和叶片(C)中相关基因的表达Fig.4 Expression of related genes in stem tips (A), stems (B) and leaves (C) of two cultivars
3 讨 论
‘惠民短枝’是一种短枝型自然芽变突变体,具有树势强,树冠小,萌芽率高,成枝力弱,以短果枝结果为主,结果早,易丰产,果实较大,色泽鲜艳,风味好等特点,通过缩短茎部营养生长的时间和缩短节间长度,使树体矮小、适应性强[2]。
GA作为植物六大激素之一,在植物的生长发育和环境适应等多个途径中起着重要作用[19]。GA3是植物的生长调节剂,可以加快茎与幼枝的生长,具有促进植株生长发育的作用。适当浓度GA能够促进植物的伸长生长,植物体内若缺乏GA,则导致植物矮化。GA含量差异和GA合成关键酶基因差异表达与短枝型苹果枝条节间长度相关联,低GA含量和GA合成关键酶基因的下调表达抑制了‘龙富短枝’苹果枝条的伸长[20]。IAA具有调节植物生长的作用,在适宜的浓度下可以促进植物生长,当浓度过高或过低时会抑制植物生长。脱落酸(ABA)能够促进种子发芽与幼苗生长,促进光合效率与幼胚发育, 短枝型苹果植株的ABA含量是普通型苹果的2.6倍以上[21]。同时GA3、IAA、ABA之间还具有协调作用,不同浓度的激素协同对植物的影响不同,具体的影响还需要进行数据分析才能证明。本研究中,茎和茎尖中的GA3、IAA含量显著高于‘惠民短枝’,而ABA含量显著低于‘惠民短枝’。这一结果与‘长富2号’嫩枝中的GA和ABA含量显著高于短枝型品种‘神富6号’,而IAA含量无明显差异[22]的研究结果有出入。说明这3种植物激素在短枝型性状的形成中均扮演着非常重要的角色,但是三者之间的协同机制还有待进一步研究。
拟南芥中GA20ox1、GA20ox2和GA20ox3的沉默会导致植株矮化,影响生长发育[23]。棉花GhGA20ox6基因过表达拟南芥能显著增加株高,且抽薹提前[24]。MdGA20ox1的表达量在半矮化类型砧木SH28嫁接‘嘎啦’的茎尖、幼叶、成熟叶和枝皮中均高于矮化类型SH40嫁接‘嘎啦’[25]。TIR1家族基因作为生长素受体,处于生长素信号通路中关键位置,参与调控植物生长与发育过程中生长素反应[26]。AtPYL4,AtPYL5,AtPYL8和AtPYL9转基因拟南芥对ABA的敏感性提高主要表现在种子萌发、幼苗的生长、气孔开闭及提高植物的抗旱能力等方面[27]。研究者还发现过表达OsPYL5的转基因水稻抗胁迫能力增强,但株高和总产量略有下降[28]。SnRK2是生长促进与胁迫应激信号通路交汇的关键调控因子。在拟南芥中,SnRK2蛋白激酶可以通过调节蔗糖6-磷酸合酶的活性来调节蔗糖代谢,以及植物生长和种子形成过程中的光合作用和碳固定[29]。同样,在本研究中,茎和茎尖中的TIR1和GA20ox基因的表达水平显著高于‘惠民短枝’,而SnRK2和PYL显著低于‘惠民短枝’,叶片中的GA20ox基因的表达水平显著高于‘惠民短枝’。说明较低表达水平的TIR1和GA20ox,以及较高表达水平的SnRK2和PYL是短枝性状形成的关键因子。
可溶性糖各个组分的含量对苹果短枝芽变都有重要作用。植物体内蔗糖转化酶可以吸收和利用蔗糖,且在高等植物蔗糖代谢中起着关键的作用[30]。研究表明,转化酶参与植物的生长、器官建成、糖分运输、韧皮部卸载及调节库组织糖分构成及水平,近年来关于该酶的生化特性、基因表达与调控以及结构与功能等的研究取得了重要进展[31]。因而蔗糖对于苹果枝条的发育和芽变具有重要作用。山梨糖醇在蔷薇科植物中,主要是作为光合产物,运输物质和储藏物质,在许多植物中作用与蔗糖相同,也经常被用于植物组培中来与蔗糖混用[32]。前人研究发现,山梨糖醇有利于芽的增值而不利于芽的生长,利于茎干物质的增加而不利于叶片的扩大[33]。研究发现,高氮条件下苹果茎尖积累的山梨醇和蔗糖为苹果茎尖的快速生长发育提供了充足的物质和能量[34]。葡萄糖则主要用于转变为纤维素,扩大树干和枝叶、根部的生长,会在花芽分化后期大量生成[35]。与本研究结果一致,茎中的蔗糖和山梨糖醇含量分别显著高于‘惠民短枝’,茎尖中的葡萄糖显著低于‘惠民短枝’。因此,可推断较高含量的蔗糖和山梨糖醇对于枝条快速生长期的伸长生长提供了能量。此外,研究发现,小麦TaSnRK2s参与了小麦的糖代谢和胁迫信号传递,过表达TaSnRK2s可以改善根的生长和发育[30]。本研究中,SnRK2在‘惠民短枝’茎和茎尖中的表达水平显著高于‘烟富8号’,与ABA、蔗糖和山梨糖醇的变化一致。综合以上结果推测,SnRK2在糖代谢和激素信号中可能具有关键的介导作用,但它们之间的联合参与调控机理目前还不清楚,有待进一步研究。
综上所述,蔗糖、山梨糖醇和葡萄糖对苹果短枝形成具有主要影响,果糖则影响较小或无影响。但内源激素之间的协同作用及其与可溶性糖之间的相互调控对短枝型芽变品种产生的作用机制还有待研究。

