接种促生菌对尾巨桉—降香黄檀混作幼苗光合生理特性和生长的影响
林铭业,廖良宁,姚贤宇,邓家珍,叶绍明
(广西大学 林学院,南宁 530004)
桉树 (EucalyptusrobustaSmith.) 因其速生丰产、抗逆性强、经济效益高等优点,已成为中国华南地区的主要商品林之一,为国家木材安全做出了突出贡献。但由于长期以来大面积桉树纯林多代连栽造成的土壤质量退化、生物多样性下降等生态环境问题,已成为了实现桉树可持续经营的最大障碍。利用豆科树种与桉树混交促进桉树吸收氮素和提高豆科树种生物固氮效率[1-2],维持土壤氮素水平和降低环境污染是解决上述生态问题的有效途径[3]。如降香黄檀 (Dalbergiaodorifera) 与桉树混交、马占相思 (Acaciamangium) 与桉树混交均可以提高混交系统氮素利用和豆科树种的生物固氮效率[2,4]。在该系统中,植株—微生物—土壤互作关系是影响地上植株生长的重要因素[5-6]。其中,根瘤菌在生长过程中发挥着更大的作用,将大气中N2转化为铵态氮可以供给植株吸收利用[7]。因此,改善土壤微生物环境可能是提高桉树与固氮树种混交系统营养利用效率的关键。
促生菌能维持土壤生态功能和促进植物养分循环[8],是影响植物生长的关键因素。如解磷菌类能提高植物可利用态磷含量,改善土壤磷利用率[9];固氮菌类可以提高豆科植物生物固氮效率,减少氮肥投入[10],为生物固氮体系做出了重要贡献[11-12]。在混交体系中接种根瘤菌等促生菌能更大化促进植物对养分的吸收,提高土壤养分的利用与循环[13]。此外,接种促生菌还能增强植物抗逆性[14],提高有机物的产量[15],改善植物的光合特性[16],有助于植物生长。如固氮菌通过调节钠排斥和钾吸收来改善盐胁迫条件下的玉米生长[17],共同接种的固氮菌与真菌通过增强合成生长素等激素使青蒿地上干重增长翻倍[18]。这些微生物被用作生物肥料,以补偿甚至增加化肥带来的生长效果。
植物接种促生菌还可能通过改变植株叶片叶绿素含量来影响其对光能的利用,增强植株光合作用,从而提高生产力[19]。虽然已证实根瘤菌等促生菌对单作豆科作物的生长具有优势[20],但对豆科—非豆科树种混交体系的影响却较少涉及。在混作体系中接种根瘤菌等促生菌类是否能通过改变光合作用,进而影响苗木生长也尚不明确。因此,本试验模拟桉树与豆科树种混交系统,以尾巨桉 (Eucalyptusurophylla×E.grandis) 与降香黄檀混作为对象,探究在非灭菌的自然生产状态下接种巨大芽孢杆菌与大豆根瘤菌如何影响混作系统植株生理代谢,分析接种不同细菌后植株适应性和生长指标差异,为实现桉树人工林的可持续经营提供科学依据。
1 材料和方法
1.1 试验地概况
试验地位于广西南宁市广西大学林学院试验基地大棚(108°17′30.3″E, 22°51′4.79″N),属亚热带季风气候,年均气温21.6 ℃,极端最低气温-2.4 ℃,极端最高气温40.4 ℃。年均降雨量1 304 mm,干湿季分明,降雨集中在4-9月,平均相对湿度为79%。
1.2 试验材料
供试苗木为长势均匀的3个月生尾巨桉 (平均苗高为39.50 cm,地径5.08 mm) 和一年生降香黄檀 (平均苗高为66.33 cm,地径7.08 mm)。一种供试菌为巨大芽孢杆菌 (Bacillusmegatherium,BM),菌株编号DU07,该菌株由广西大学林学院黄宝灵研究员提供,具有解磷、固氮的能力[21]。另一种供试菌为大豆根瘤菌 (RhizobiumjaponicumIOC 113-2,RJ),菌种编号DSM1203,由上海保藏生物技术中心 (SHBCC) 提供,大豆根瘤菌与黄檀属植物具有较好的共生关系[22]。试验土壤为偏酸性赤红黏土,土壤全氮含量为0.96 mg/g,全磷含量为0.64 mg/g,全钾含量为11.85 mg/g,pH为4.65。
1.3 试验设计
试验采用尾巨桉—降香黄檀幼苗混交盆栽方式,设置2个接种处理和1个不接种对照,即对尾巨桉接种巨大芽孢杆菌,降香黄檀不接种 (BM);对降香黄檀接种大豆根瘤菌,尾巨桉不接种 (RJ);对照组不做接种处理 (CK)。采用浆根法接种菌液,然后取尾巨桉和降香黄檀苗各1株,共同栽植于1个盆钵 (直径40 cm,高45 cm) 中,种植株间距15 cm。试验采用完全随机区组设计,每个处理设置3个重复,每个重复栽植15盆。根据天气状况每日浇水以保持土壤湿润,每月进行松土和除草。
1.4 测定指标及方法
1.4.1 生长指标分别采用钢卷尺与电子数显游标卡尺测量尾巨桉和降香黄檀幼苗的苗高和地径,种植后每30 d测定1次,共测量6次。
1.4.2 光合生理指标植株根系接菌处理定殖6个月后测定尾巨桉和降香黄檀幼苗叶片光合气体交换参数及叶绿素含量。于晴天上午 (9:00-11:30),使用Li-6400便携式光合测定系统分析仪 (美国Li-Cor公司,人工光源,环境CO2浓度为400 μmol/mol) 测定尾巨桉和降香黄檀叶片的净光合速率 (Pn)、气孔导度 (Gs)、胞间CO2浓度 (Ci) 和蒸腾速率 (Tr),指标测定时分别选取植株中部具有完好功能的叶片,每个重复随机选取8枚叶片并取平均值,重复3次。叶绿素含量 (Chl) 采用乙醇丙酮混合提取法测定[23]。
1.4.3 生物量幼苗盆栽后180 d采用全株收获法将尾巨桉和降香黄檀收集带回实验室,将根、茎、叶分装,先置于105 ℃烘箱杀青2 h,后于70 ℃条件下烘干至恒重,用高精度分析天平 (±0.01 g)称重,分别记录植株各器官的生物量(干重)。
1.4.4 植株氮含量将烘干的尾巨桉和降香黄檀植株的根、茎、叶分别放入粉碎机进行粉碎并过0.2 mm筛,每份样品称取0.250 0 g加入5 mL浓硫酸消煮制备待测液,用连续流动分析仪 (AA3) 测定植株各器官全氮含量。
1.5 数据分析
数据采用Microsoft Excel 2016进行计算,通过SPSS 23软件对不同菌种处理差异数据进行单因素方差 (one-way ANOVA) 分析及多重比较 (Duncan),并采用最小显著性差异法 (LSD) 进行差异显著性检验 (P<0.05)。采用Pearson相关性分析各指标间相关关系的显著性。使用Origin 2021作图。
2 结果与分析
2.1 接种促生菌对尾巨桉—降香黄檀混作幼苗氮素积累的影响
图1显示,接种巨大芽孢杆菌 (BM) 和大豆根瘤菌 (RJ) 后,尾巨桉、降香黄檀幼苗的全株氮素含量均显著高于不接菌对照 (CK),尾巨桉幼苗在BM、RJ处理下增幅分别为71.89%和69.81%,降香黄檀幼苗较CK分别增长55.37%和79.47% (P<0.05)。在不接菌处理下,尾巨桉各器官的氮素含量表现为叶>根>茎,而降香黄檀表现为叶>茎>根;在接菌BM、RJ处理下,尾巨桉和降香黄檀各器官的氮素含量均表现为叶>根>茎。其中,BM、RJ处理下尾巨桉幼苗叶片氮素含量分别为7.84,7.57 mg/g,较对照分别增加33.79%和29.18%,降香黄檀幼苗叶片氮素含量分别为15.46,16.86 mg/g,较对照分别增加43.95%和56.98%。可见,BM处理对尾巨桉整株和叶片含氮量的增效优于RJ处理,RJ处理对降香黄檀整株和叶片含氮量的增效优于BM处理。

CK表示2种幼苗均不接种处理,BM表示尾巨桉幼苗接种巨大芽孢杆菌、降香黄檀不接种处理,RJ表示降香黄檀接种大豆根瘤菌、尾巨桉不接种处理;不同的小写字母a、b、c表示不同处理间差异显著(P<0.05)。下同。图1 不同细菌接种处理下尾巨桉 (A) 与降香黄檀 (B) 植株各器官及全株氮素含量的变化CK indicates that neither seedling was inoculated, BM indicates that E. urophylla×E.grandis seedlings inoculated with Bacillus megatherium and D. odorifera were not inoculated, RJ indicates that D. odorifera seedlings inoculated with Rhizobium japonicum and E. urophylla×E.grandis were not inoculated. Different lowercase letters (a,b,c) indicate significant difference among different treatments at 0. 05 level. The same as following.Fig.1 The change of nitrogen content in organs and plants of E. urophylla × E. grandis (A) and D. odorifera (B) seedlings under different inoculation treatments
2.2 接种促生菌对尾巨桉—降香黄檀混作幼苗叶片光合生理特性的影响
2.2.1 叶绿素含量尾巨桉叶片叶绿素a含量表现为RJ>CK>BM,叶绿素b含量表现为CK>RJ>BM,且处理间均差异显著;叶绿素总量表现为RJ处理与CK无显著差异,而BM处理的叶绿素总量 (1.38 mg/g) 较CK显著下降25.41% (图2,A)。同时,降香黄檀叶绿素a含量和叶绿素总量均表现为RJ>BM>CK,且处理间均差异显著,而叶绿素b含量在处理间均无显著差异;降香黄檀BM和RJ处理叶片叶绿素总量比CK分别显著增长79.05%和94.76% (图2,B)。

图2 不同细菌接种处理下尾巨桉(EE)和降香黄檀(DO)植株叶绿素含量和光合生理特性的变化Fig.2 The change of chlorophyll content, photosynthetic physiological characteristics of E. urophylla×E.grandis (EE) and D. odorifera (DO) seedlings under different inoculation treatments
2.2.2 净光合速率(Pn) 接种2种促生菌对尾巨桉和降香黄檀幼苗的Pn均有显著促进作用,该促进作用在尾巨桉中以RJ处理最高,分别比BM和CK显著提高10.87%和232.75%,而在降香黄檀以BM处理最高,分别比RJ和CK显著提高18.30%和108.23% (图2,C)。
2.2.3 胞间CO2浓度(Ci) 尾巨桉和降香黄檀幼苗的Ci在BM和RJ处理下均显著低于CK;尾巨桉幼苗Ci在BM和RJ处理下分别比CK显著降低32.28%和28.96%,且BM和RJ处理间差异显著(P<0.05),而降香黄檀Ci在RJ和BM处理下分别较CK显著降低了24.84%和26.52%,但BM和RJ处理间差异不显著 (图2,D)。
2.2.4 气孔导度(Gs) 尾巨桉和降香黄檀幼苗叶片的Gs均表现为BM和RJ处理显著高于CK (P<0.05),但BM与RJ处理间均无显著差异 (图2,E)。其中,尾巨桉的Gs在BM和RJ处理下较CK处理分别显著增长23.48%和29.89%,降香黄檀的Gs则分别较CK处理显著增长38.89%和24.07%。
2.2.5 蒸腾速率(Tr) 尾巨桉和降香黄檀幼苗的Tr均表现为RJ和BM处理显著高于CK,尾巨桉幼苗的增幅分别为127.3%和95.74%,且RJ处理又显著高于BM处理 (P<0.05),而降香黄檀幼苗Tr的增幅分别为42.59%和41.71%,但BM和RJ处理之间无显著差异 (图2,F)。
综合以上结果可知,接种RJ对尾巨桉和降香黄檀幼苗叶片叶绿素含量的提升比接种BM更显著,且降香黄檀幼苗提升幅度更大;接种2种促生菌均能显著提高尾巨桉和降香黄檀幼苗叶片的净光合速率、气孔导度、蒸腾速率,却显著降低胞间二氧化碳浓度。
2.3 接种促生菌对尾巨桉—降香黄檀混作幼苗生长的影响
2.3.1 苗高和地径接菌均能促进尾巨桉和降香黄檀苗高和地径的生长,但BM处理与RJ处理对植株的生长促进效果不同 (图3)。其中,尾巨桉的苗高表现为RJ处理始终高于同期BM和CK处理,并在90~180 d达到显著水平;RJ处理使尾巨桉不同时期的苗高比相应CK增长14.3%~93.1%,并以第30天的促生效果最佳;试验结束时,RJ处理的苗高比同期BM处理显著提高36.61% (图3,A)。降香黄檀的苗高表现为BM处理始终高于同期RJ和CK处理,且除处理90 d外均达到显著水平,但RJ处理各时期对降香黄檀苗高的影响始终不显著;BM处理在前30 d时对苗高提升效果最明显,相比CK处理增长了53.7% (图3,B)。
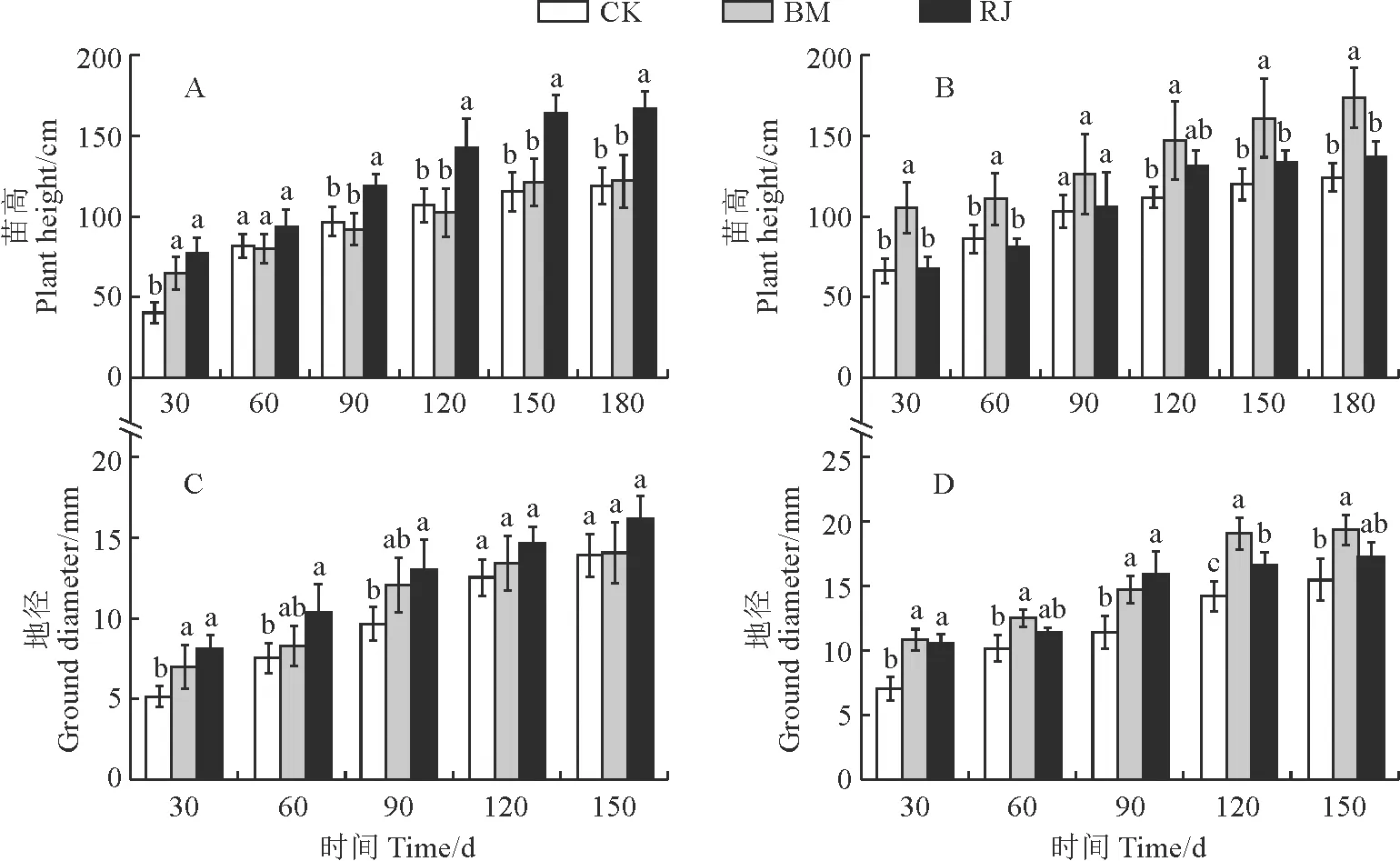
图3 不同细菌接种处理下尾巨桉(A、C)和降香黄檀(B、D)苗高和地径生长动态Fig.3 The height and ground diameter growth dynamics E. urophylla×E.grandis(A,C) and D. odorifera (B,D) seedlings under different inoculation treatments
同时,BM与RJ处理对各时期尾巨桉和降香黄檀的地径生长均有不同程度的促进效果,但两接菌处理间大多无显著差异。与CK相比,尾巨桉的地径在RJ处理30~90 d时显著提高,但仅在BM处理30 d时显著提高 (图3,C);降香黄檀的地径生长在BM处理下始终得到显著促进,而在RJ处理下除60,150 d外增幅也均达到显著水平 (图3,D)。在150 d时,BM和RJ处理尾巨桉地径分别比同期CK提高1.15%和16.27%, 此时BM处理的提升效果不显著;在30 d时,BM和RJ处理下降香黄檀的地径的增长率最高,分别达到53.74%和50.61%。可见,接种RJ对尾巨桉的苗高和地径生长的促进效果更明显,而接种BM则对降香黄檀的苗高和地径生长促进效果更佳、更持久。
2.3.2 生物量积累与分配BM处理尾巨桉的植株总生物量和根、茎、叶生物量均与CK无显著差异,而RJ处理尾巨桉各器官生物量均不同程度高于对照,但仅总生物量和叶生物量与CK差异显著,根、茎生物量无显著变化;RJ处理尾巨桉的各器官生物量均不同程度高于BM处理,且总生物量和茎生物量差异达到显著水平 (表1)。降香黄檀根、茎、叶和总生物量在BM和RJ处理下大多显著高于CK,而BM处理又均显著高于相应的RJ处理。可见,BM对降香黄檀的促生效果显著高于RJ处理,对尾巨桉的促生效果低于RJ处理。
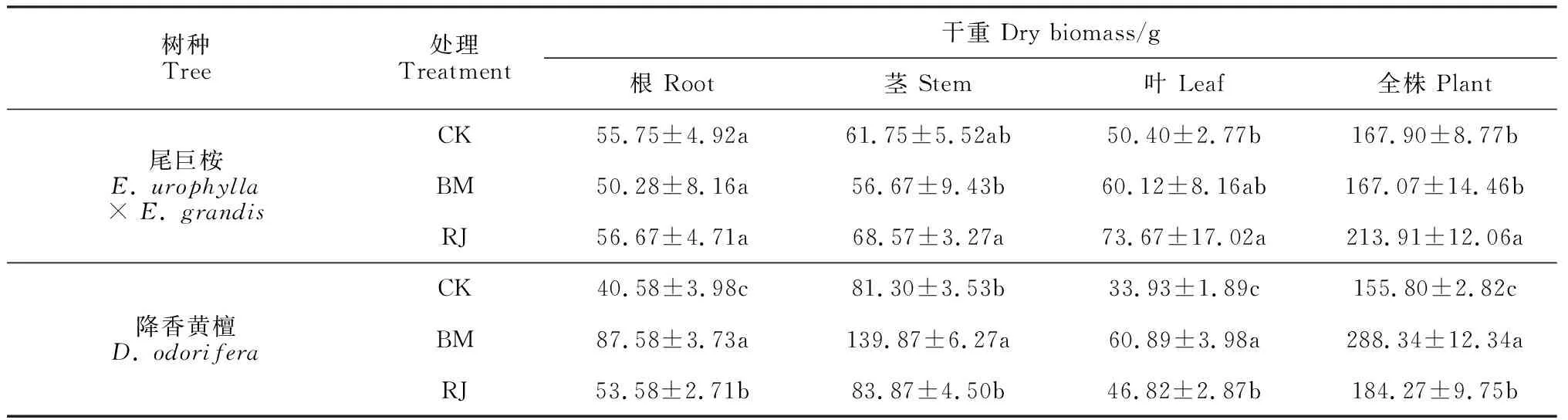
表1 不同细菌接种处理下尾巨桉与降香黄檀植株各器官生物量
同时,尾巨桉各器官的生物量分配比例在不接种对照为茎>根>叶,接种BM和RJ后转变为叶>茎>根 (图4,A);而降香黄檀各器官生物量的分配不同接种处理下均表现为茎>根>叶,但接菌提高了其根生物量占全株生物量的比例,促进了根系发育 (图4,B)。2种不同促生细菌对降香黄檀器官生物量分配的影响不同,RJ处理下的叶生物量占比提升较显著,BM处理下的根生物量占比提升更显著。总体而言,幼苗期尾巨桉根、茎、叶的生物量分配较均匀,而降香黄檀茎生物量的占比明显较大 (约达50%)。

图4 不同细菌接种处理下尾巨桉 (A) 和降香黄檀 (B) 植株器官的生物量分配比例Fig.4 The biomass allocation of E. urophylla × E. grandis (A) and D. odorifera (B) seedlings under different inoculation treatments
2.4 尾巨桉—降香黄檀混作幼苗叶氮含量、叶绿素含量、光合参数及生物量相关性分析
图5显示,尾巨桉叶氮含量、净光合速率均与叶绿素含量呈负相关,降香黄檀叶氮含量、净光合速率均与叶绿素含量呈极显著正相关 (P<0.001);尾巨桉和降香黄檀叶氮含量均与其净光合速率呈极显著正相关,但降香黄檀的相关系数小于尾巨桉。尾巨桉叶氮含量、叶绿素含量、净光合速率均与其生物量呈正相关关系,降香黄檀叶氮含量、叶绿素含量与生物量也呈正相关性,且降香黄檀的相关系数均大于尾巨桉,但均未达到显著水平;降香黄檀净光合速率与其生物量呈极显著正相关性 (P<0.001)。在光合指标中,净光合速率、蒸腾速率和气孔导度之间都存在极显著正相关关系,且它们都与胞间CO2浓度呈极显著负相关。

*、**和***分别表示在 0.05、0.01和0.001水平相关性显著;红色表示正相关,蓝色表示负相关。图5 尾巨桉 (A) 和降香黄檀 (B) 植株的叶绿素含量、光合指数、生物量间相关性分析*, ** and *** indicate significant correlation at 0.05, 0.01 and 0.001 levels, respectively. Red is a positive correlation, while blue is a negative correlation.Fig.5 The correlation between chlorophyll content, photosynthetic index, and biomass of E. urophylla × E. grandis (A) and D. odorifera (B) seedlings
3 讨 论
3.1 尾巨桉与降香黄檀混作系统植株叶片氮素含量及光合生理指标对接种促生菌的响应
叶片氮素含量、叶绿素含量、光合作用三者息息相关,叶绿素含量可以间接反映光合作用强度和植物氮素供给水平[24]。本试验中接种大豆根瘤菌 (RJ) 处理使尾巨桉、降香黄檀叶片氮素含量、叶绿素含量显著上升,与陈书琳等[25]在大豆上的相关研究结果相似,说明接种根瘤菌有利于提高2种混作植株氮素含量,促进它们叶绿素的合成;同时,接种巨大芽孢杆菌 (BM) 处理显著降低了尾巨桉的叶绿素含量,但显著提升了降香黄檀叶绿素的含量,这可能与芽孢杆菌属的作用会受植物种类以及菌种代谢产物浓度等因素的影响有关,从而影响叶绿素的合成[26]。此外,微生物菌剂的施用有助于增大植物净光合速率、蒸腾速率、气孔导度等[27],从而增强植物光合作用能力,本研究结果与其前人结果一致。气孔导度决定气孔的密度、大小和开放程度,气孔导度越大,表明光合作用和蒸腾速率越高[28]。本研究中气孔导度与净光合速率呈正相关也证实了这一结果。接种2种不同促生细菌均显著提高了尾巨桉和降香黄檀的净光合速率、气孔导度和蒸腾速率,而降低了胞间CO2浓度,这与接菌后叶片氮素含量升高,叶片气孔打开,胞间二氧化碳消耗增大有关,与前人研究[29]一致。此外,不同处理下降香黄檀的净光合速率、气孔导度、蒸腾速率均低于尾巨桉,但降香黄檀净光合速率与生物量的相关性却较尾巨桉更显著,这在一定程度上说明降香黄檀的光合利用效率更高。
本研究中,2种植物的叶片氮素含量在整株各器官中均最高,2种接种处理均使尾巨桉叶片氮素含量和净光合速率显著增长,且二者之间呈极显著正相关,但BM处理显著降低了尾巨桉的叶绿素含量,导致整体上尾巨桉的叶绿素含量与净光合速率呈负相关,这说明叶片氮素含量能够调控尾巨桉的光合能力,叶绿素含量不是反映光合作用的唯一指标,还可能与叶片光能的吸收、能量的转化以及电子传递活性的强弱有关[30]。降香黄檀的叶片氮素含量、叶绿素含量均与净光合速率呈极显著正相关关系,说明降香黄檀能够通过生物固氮作用吸收氮素,促进叶片叶绿素合成,进而提高其光合作用效率。
3.2 尾巨桉与降香黄檀混作系统植株生长指标对接种促生菌的响应
苗高和茎粗是植株生长差异的直观反映[31]。本研究中,接种两种促生细菌均能够明显促进尾巨桉和降香黄檀苗高、地径的生长,与前人的研究结果[32]一致,说明接种促生菌能促进单作植株和混作体系中另一植株的生长发育,但在未灭菌的条件下接种菌剂对植物生长的促进效果并不一致,这在一些研究中也得到证实[33-34]。供试菌株巨大芽孢杆菌是具有固氮能力的溶磷菌[21],而在本研究中接种固氮芽孢杆菌前期对尾巨桉苗高、地径的促进效果不明显,甚至低于CK,这可能与菌株对植物叶绿素等物质合成的抑制或接种菌与土壤原有菌株之间的竞争有关[6],也可能表现为菌株促生功能的长效缓释[21]。大豆根瘤菌的接种能促进混作体系中非豆科树种树高和胸径的生长,这一点在赤桉—紫云英混交林中也得到了验证[13]。当本土根瘤菌存在时,根瘤菌的引进或增施有助于菌株间产生协同效应,促进植物地上部生物量和氮素的积累[35],而本研究在非灭菌条件下接种大豆根瘤菌使植物全株氮素含量升高、增产的结果与前人研究结果一致,这对实际生产中菌肥的应用具有指导意义。
3.3 尾巨桉与降香黄檀混作系统生物量积累与分配对接种促生菌的响应
绝大部分作物生物量被认为是光合作用的产物[36]。相关性分析表明,尾巨桉、降香黄檀的生物量均与植株氮含量、净光合速率呈正相关,说明根瘤菌等固氮菌的接种优势可能不仅局限于根际固氮效应,还归因于地上部分光合作用的提高[37],这与施加氮肥提高生物产量的结果[38]类似。相较CK而言,本研究中尾巨桉接种巨大芽孢杆菌显著增加了降香黄檀生物量,而降香黄檀接种大豆根瘤菌则更显著增加了尾巨桉生物量。也有研究表明桉树幼苗接种巨大芽孢杆菌会降低桉树生物量[39],与本研的结果相似,这可能也与上述芽孢杆菌属细菌的特性有关。而降香黄檀接种根瘤菌后混作的尾巨桉生物量的累积比尾巨桉直接接种固氮芽孢杆菌的效果更好,可能是接种根瘤菌使得降香黄檀的共生固氮效应加强,可通过根系等途径供给、转移给尾巨桉的氮素量也随之增加,进而提高了尾巨桉的生物量[2,40]。此外,在豆科树种中,蝶形花亚科的平均结瘤率为94%,自然状态下的降香黄檀通常已经结瘤[41],因此本土根瘤菌已在降香黄檀上定殖可能是导致在降香黄檀上接种大豆根瘤菌的促生效益不如巨大芽孢杆菌的原因。总而言之,不同固氮菌的施用效果不一,暗示了不同条件下固氮微生物对植物的适配性不同,在植物混作体系中施用不同菌株能否再取得更好的生长效果,仍需进一步研究。
另外,器官的生物量分配可以体现植物获取养分的策略[42]。本研究发现接种2种促生细菌均增加了尾巨桉、降香黄檀的叶生物量,且接菌增加了尾巨桉叶生物量的比例和降香黄檀根生物量的比例。接种固氮菌后,氮素吸收量的增加有助于尾巨桉向地上部分分配碳水化合物[43],符合植物的生物量最优分配理论[44],即尾巨桉优先将生物量和氮素分配给叶片,以充分利用光合作用促进植物生长。而接种根瘤菌会显著促进降香黄檀根系固氮结瘤的能力,影响了根生物量的比重。此外,在生长过程中,尾巨桉的生长速度显著快于降香黄檀,遮挡了部分阳光,因此降香黄檀在与尾巨桉竞争的过程中要维持水分和养分供应,降香黄檀根系生长优先于地上器官,以加强对土壤限制性资源的吸收[45]。
4 结 论
在尾巨桉—降香黄檀混作体系中接种大豆根瘤菌和巨大芽孢杆菌2种促生菌能改善幼苗的光合生理代谢,从而提高植株生物量。在混作体系中降香黄檀接种根瘤菌对尾巨桉的促进效果更明显,尾巨桉接种巨大芽孢杆菌对降香黄檀的促进效果明显。降香黄檀接种根瘤菌能增强其生物固氮能力,并间接促进了尾巨桉氮素和生物量的累积。降香黄檀光合作用参数与生物量之间存在正相关关系,体现了光合作用在幼苗生长中的重要地位,在混作体系中接种促生菌能同时促进根际固氮和叶片的光合作用。

