海鲈鱼酸性磷酸酶分离纯化及其抑制剂虚拟筛选
李园园, 魏天雨, 丁悦艳, 李红燃, 师丹华, 李颖畅, 李学鹏
(渤海大学 食品科学与工程学院/生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
海鲈鱼 (Lateolabraxmaculatus)是常见的海洋经济鱼类之一,因味道鲜美、营养价值高而深受国内消费者喜爱[1]。由于海鲈鱼富含多不饱和脂肪酸和各种氨基酸,在贮藏期间极易腐烂变质,严重影响其风味。酸性磷酸酶(acid phosphatase,ACP,E.C.3.1.3.2)存在于细胞溶酶体中,是参与风味物质肌苷酸(inosine 5′-monophosphate,IMP)降解的关键酶[2]。它催化IMP降解,产生次黄嘌呤核苷(hypoxanthine riboside,HxR)和次黄嘌呤(hypoxanthine,Hx)[3],使鱼类产生不愉快的气味和味道,降低鱼肉食用价值[4]。已有学者从麦瑞加拉鲮鱼[5]、鲫鱼[6]、珠贝母[7]、海参[8]中分离纯化出了不同分子质量(几十至几百kDa)的ACP,其米氏常数(Km)、酶最适反应条件各不相同。研究表明,不同水产品中分离得到的ACP结构和特性存在差异。因此,本研究以海鲈鱼为原料分离纯化ACP并对其酶学性质进行研究。
虚拟筛选技术是在生物原有结构的基础上发现新配体的过程,也是从大量的化合物中筛选潜在活性化合物的过程[9]。尚随锦等[10]基于药效团虚拟筛选和数据挖掘技术,筛选天然黄嘌呤氧化酶抑制剂,共得到102个天然化合物。马青云等[11]运用计算机虚拟筛选技术寻找新型冠状病毒水解酶的中药小分子抑制剂,共获得66个化合物。唐彪等[12]基于Discovery Studio 2.5平台筛选出转化生长因子-β1蛋白抑制剂,成功从黄芪、丹参、三七中筛选出4种与TGF-β1结合良好的天然化合物。然而,虚拟筛选技术用于寻找ACP抑制剂的研究鲜有报道。
本研究以海鲈鱼肝为对象,通过饱和硫酸铵分级沉淀、阴离子交换柱和葡聚糖凝胶柱层析分离纯化ACP,并探究纯化后ACP酶学特性,最后利用Discovery Studio 4.5平台分子对接技术筛选出潜在抑制剂并探究其对酶活性的影响,旨在为进一步研究酶结构与功能,探究抑制剂对ACP的抑制机理提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜海鲈鱼,辽宁省锦州市林西水产市场;聚乙二醇(聚合度20000)、儿茶素(纯度≥97%)、表没食子儿茶素(EGC,纯度≥97%)、没食子酸(GA,纯度≥97%)、表儿茶素没食子酸酯(ECG,纯度≥97%)、表没食子儿茶素没食子酸酯(EGCG,纯度≥97%),上海源叶生物科技有限公司;Tris-HCl、NaAc-HAc(纯度≥99%)、对硝基苯磷酸钠(p-NPP,纯度≥97%)、对硝基苯酚(p-NP,纯度≥97%),上海麦克林生化科技有限公司;总蛋白浓度考马斯亮蓝试剂盒,南京建成有限公司。其他试剂均为分析纯。
1.2 仪器与设备
S18-A928型绞肉机,山东九阳股份有限公司;SORVALL Stratos型冷冻高速离心机,美国Thermo公司;UV-2550型紫外-可见分光光度仪,苏州岛津仪器有限公司;YC-2型层析柜,上海嘉鹏科技有限公司;HL-2S型数显恒流泵、BS-160型自动部分收集器,上海沪西分析仪器厂;DEAE-Sepharose 型阴离子交换柱,美国Sigma公司;Sephadex G-200型葡聚糖凝胶柱,美国Bioruler公司。
1.3 实验方法
1.3.1ACP粗酶提取和酶活力测定
新鲜海鲈鱼,体质量(1.84±0.26) kg,体长(39.78±4.67) cm。将鱼敲头致死,取肝脏(35±0.3)g,-80 ℃保存,4 ℃解冻30 min放入预冷的绞肉机中,绞碎30 s,加入20 mmol/L NaAc-HAc缓冲液(5 mmol/L β-巯基乙醇和20 g/L甘油,pH值 5.0),料液比(g/L)1∶3,在4 ℃层析柜中磁力搅拌1 h,5 000 r/min离心30 min,提取的上清液即为粗酶液[6]。ACP酶活力测定参考Zhu等[8]的方法,将0.5 mL粗酶液与3 mL 20 mmol/L的NaAc-HAc缓冲液(5 mmol/L β-巯基乙醇,pH值 5.0)混合,再加入0.5 mL 12 mmol/Lp-NPP。将混合物在37 ℃预热15 min,并通过添加0.5 mL 0.1 mol/L NaOH终止反应。405 nm处测量吸光度,计算释放p-NP的量。酶活力定义为在该分析条件下1 min产生1 nmol/L P-NP所需的酶量。总蛋白质含量采用考马斯亮蓝试剂盒测定。
1.3.2ACP的分离纯化
1.3.2.1 硫酸铵分级沉淀
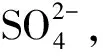
纯化倍数和回收率计算见式(1)、式(2)。

(1)

(2)
1.3.2.2 阴离子柱纯化
阴离子层析柱(1.6 cm×20 cm)用20 mmol/L NaAc-HAc缓冲液(5 mmol/L β-巯基乙醇,pH值 5.0)平衡后,取10 mL酶液上样,用不同浓度的NaCl(0、0.1、0.2、0.3、0.4、0.5 mol/L)进行线性梯度洗脱,流速为0.5 mL/min,每管收集5 mL。收集蛋白质含量和酶活力均较高的酶液,透析浓缩,-80 ℃保存,用于后续进一步纯化。酶活力和总蛋白质含量测定方法同1.3.1节。
1.3.2.3 葡聚糖凝胶柱纯化
葡聚糖凝胶层析柱(1.6 cm×80 cm)用20 mmol/L NaAc-HAc缓冲液(5 mmol/L β-巯基乙醇,pH 值5.0)进行平衡和洗脱,流速为0.3 mL/min,每管收集5 mL酶液,收集蛋白质含量和酶活力均高的酶液,将酶液浓缩后置于-80 ℃保存备用。酶活力和总蛋白质含量测定方法同1.3.1节。
1.3.2.4 ACP分子质量测定
参考Siddiqua等[5]方法并略做修改,分离胶的质量分数为12%,浓缩胶的质量分数为5%,纯化后的ACP蛋白质量浓度为1 mg/mL,按照体积比1∶4加入5×上样缓冲液,混匀后煮沸5 min,上样量为10 μL。电泳仪初始电压为80 V,40 min后调为120 V,保持40 min后关闭电源。考马斯亮蓝染色液对凝胶染色30 min,脱色12 h,观察结果。
1.3.3ACP最适温度和pH值测定
在20~90 ℃以10 ℃的间隔测定酶活力,确定了ACP的最适温度和热稳定性。在pH 值3.0~8.0的反应液中测定酶活力,酶活力测定方法同1.3.1节。
1.3.4酶解动力学参数分析
动力学参数参考Siddiqua等[5]的方法,略作修改。将纯化后的ACP与不同浓度的底物P-NPP(0.1~0.5 mmol/L)等体积混合,黑暗条件下30 ℃反应15 min,加入1 mL 0.1 mol/L NaOH终止反应,室温静置10 min后测定405 nm处吸光度。采用Line-weaver-Burk双倒数绘图法计算Km和vmax,见式(3)、式(4)。
(3)
(4)
式(3)、式(4)中,v、vmax分别为反应速率和反应最大速率,μmol/(L·min),Km为米氏常数,mmol/L,[S]为p-NPP的浓度,mmol/L。
1.3.5ACP二级结构测定
圆二色谱测定参考Moradi等[13]方法,并略作修改。ACP的蛋白质质量浓度为0.3 mg/mL,在60 nm/min的扫描速度下,测定190~250 nm ACP的圆二色谱,以20 mmol/L NaAc-HAc缓冲液(5 mmol/L β-巯基乙醇,pH值5.0)为空白对照,并计算样品二级结构的含量。
1.3.6基于分子对接的抑制剂虚拟筛选
参考李颖畅等[14]方法。ACP的晶体结构从PDB数据库(http:∥www.rcsb.org/pdb)下载并保存为pdb格式,利用 PyMol 软件对ACP进行去水、加氢和能量最小化,从PubChem数据库(https:∥pubchem.ncbi.nlm.nih.gov/)获取小分子的2D结构,用CHem3D软件对小分子进行能量最小化,最后采用Discovery Studio 4.5的LibDock和CDOCKER程序对其进行筛选。筛选过程如下:首先采用LibDock筛选方法与ACP进行对接,然后选取对接得分大于100的小分子,最后使用CDOCKER程序将小分子与ACP进行分子对接并处理对接结果。对接参数:活性位点半径20 Å,活性位点XYZ位置(34.85,76.23,83.57),运行次数10次。
1.3.7抑制剂抑制效果分析
取一定量的筛选出的小分子物质溶液,加入ACP酶液1 mL(酶活力>600 U/mL,蛋白质质量浓度为1.4 mg/mL),用20 mmol/L NaAc-HAc缓冲液(5 mmol/L β-巯基乙醇,pH 值5.0)稀释。将小分子物质与ACP混合物混匀,4 ℃黑暗中反应15 min。酶活力和蛋白质含量测定方法同1.3.1节。
1.4 数据处理
采用SPSS 26进行统计学分析,Origin 2019软件绘图,所有实验平行重复3次,结果均以平均值±标准偏差表示,单因素方差分析差异显著性(P<0.05)。
2 结果与分析
2.1 海鲈鱼肝ACP分离纯化结果
分离纯化后海鲈鱼肝ACP酶活力和总蛋白质变化见表1。由表1可看出,粗酶的比活力为0.18 U/mg,经饱和硫酸铵溶液沉淀后该酶纯化了5.94倍,回收率为63.38%。ACP分离纯化过程见图1。将透析浓缩后的粗酶液上样置于阴离子交换柱,进行钠盐梯度洗脱后的结果见图1(a)。由图1(a)可知,该酶有2个不同的峰,故推测该酶可能存在同工酶,命名为ACP I和ACP Ⅱ,且ACP Ⅰ含量高。该研究结果与杨立红等[15]结果类似,其研究表明刺参内脏中ACP经过分离纯化后有3个不同的峰,即在刺参ACP中存在3个同工酶。经DEAE-Sepharose层析柱纯化后ACP I和ACP Ⅱ的比活力为3.02、4.86 U/mg,分别纯化了16.83、14.33倍,回收率分别为43.07%和50.24%。将浓缩后的2种酶液分别加到葡聚糖凝胶柱中,经20 mmol/L NaAc-HAc缓冲液洗脱,分别得到2个单一的峰[图1(b)、(c)]。酶液经Sephadex G-200凝胶柱过滤后,ACP I和ACP Ⅱ比活力分别增加至6.57、4.62 U/mg,分别纯化了36.50、25.67倍,回收率分别达到9.96%和6.07%。由于分离纯化的ACP I回收率和纯化倍数相对较高,后续研究均使用ACP I。
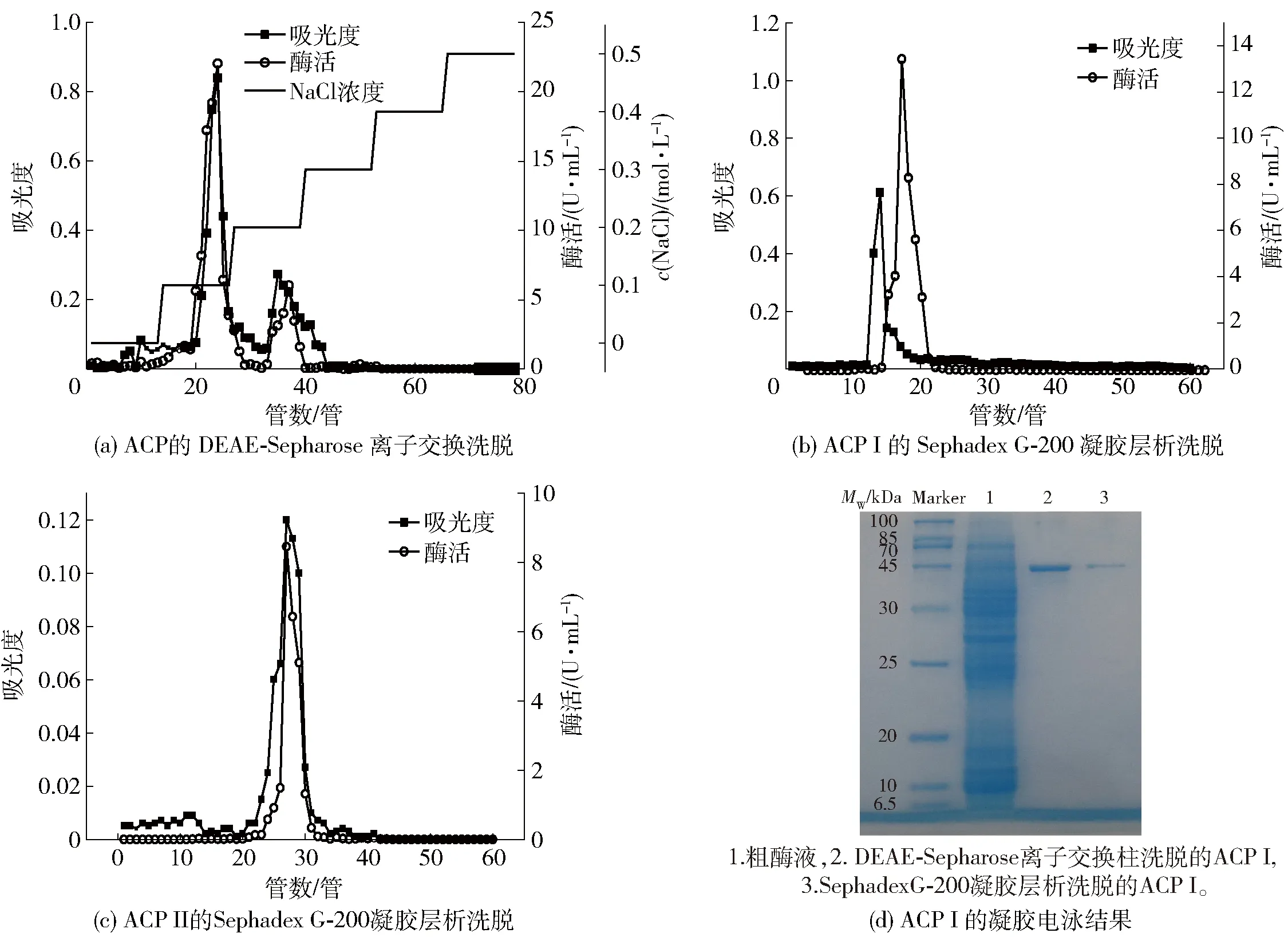
图1 海鲈鱼肝ACP的分离纯化过程
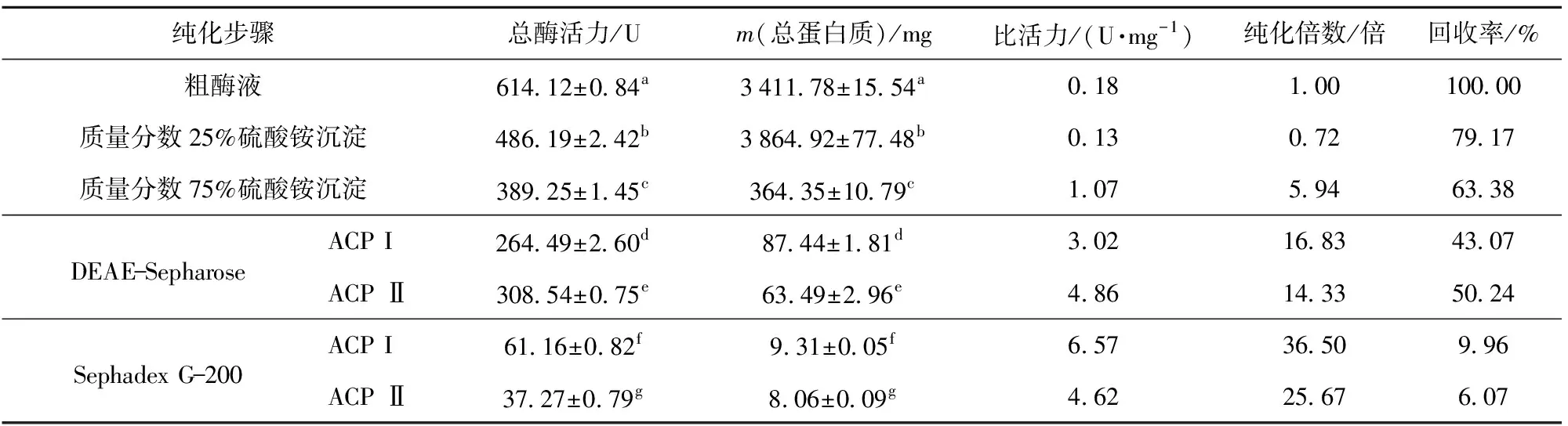
表1 海鲈鱼肝ACP纯化倍数及回收率
SDS-PAGE结果如图1(d)。条带1表示粗酶,经分离纯化后,条带2和3均呈单一条带,表明ACP I达到一定纯度,且分子质量约45 kDa。该研究结果与高举等[6]研究鲫鱼中ACP类似,鲫鱼ACP分子质量为33.3 kDa;Siddiqua等[5]研究麦瑞加拉鲮鱼(淡水鱼类)ACP,其分子质量分别为18、100、130 kDa。ACP不同的原因可能是鱼类种类不同,生活环境不同,与淡水鱼相比,海鲈鱼生活水温接近室温,盐度稍高。
2.2 海鲈鱼ACP I最适温度和pH值分析
纯化后ACP I 在不同温度和pH值时的活力变化见图2。由图2(a)可知,海鲈鱼肝ACP I在30 ℃时显示出最高的催化活性,20~40 ℃保持超过80%的活力,超过40 ℃后ACP I活力显著降低且酶的热稳定性也急剧下降(P<0.05),并在70 ℃时几乎完全失活。这一结果与刺参ACP活力的研究结果基本一致[15]。Kuda等[16]研究发现,鲭鱼ACP在55 ℃加热10 min后,其活力降低至10%。ACP I最适温度为30 ℃,这个结果低于麦瑞加拉鲮鱼肝中ACP的最适温度(40 ℃)[5]和草鱼肝脏中ACP的最适温度(45 ℃)[17]。由图2(b)可知,海鲈鱼肝ACP I最适pH值为5.0,随着pH值升高,酶活力显著降低(P<0.05)。王彩霞等[18]研究了草鱼、鱼、鳝鱼3种淡水鱼中ACP最适pH值分别为5.0、5.8和5.6,而陈素丽等[19]结果表明文昌鱼ACP的最适pH值为4.5。本研究中ACP I最适温度和最适pH值结果与文献结果存在一定差异,原因是鱼的种类不同或鱼的生活环境不同。

图2 温度和pH值对海鲈鱼肝ACP活力的影响
2.3 ACP I的动力学特性分析
ACP I的动力学参数如图3,底物为P-NPP 时,ACP的Km为0.098 mmol/L,vmax为1.07 μmol/(L·min)。Siddiqua等[5]研究表明,麦瑞加拉鲮鱼肝中ACP对底物P-NPP的Km为0.25 mmol/L,vmax为1.10 μmol/(L·min)。可能因为ACP来自不同类型鱼类的鱼肝,酶的动力学特性存在一定差异。
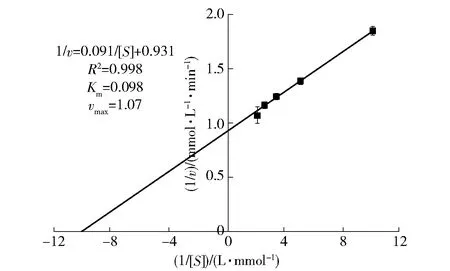
图3 海鲈鱼肝ACP I的酶动力学参数
2.4 海鲈鱼ACP I二级结构分析
圆二色谱可以反映蛋白质二级结构[20]。海鲈鱼肝ACP I二级结构中,α-螺旋的含量为14.10%,β-折叠的含量为35.90%,β-转角和无规则卷曲的含量分别为18.20%和32.60%。β-折叠的含量较高,说明ACP二级结构中肽链之间交替分布,形成稳定构象。Moradi等[21]研究表明:在ACP二级结构中,α-螺旋的含量10.8%,β-折叠的含量30.2%,β-转角和无规则卷曲的含量分别为17.6%和41.4%,与本研究结果基本一致。
2.5 海鲈鱼ACP抑制剂虚拟筛选结果
采用Discovery Studio 4.5的CDOCKER程序进行海鲈鱼ACP抑制剂的虚拟筛选,结果如表2。筛选出5个ACP抑制剂(儿茶素、表没食子儿茶素、没食子酸、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯),ACP与它们相互作用的能量分别是-171.473、-198.309、-140.189、-221.409、-256.647 kJ/mol。对虚拟筛选后的5个化合物进行ACP活性抑制实验验证。
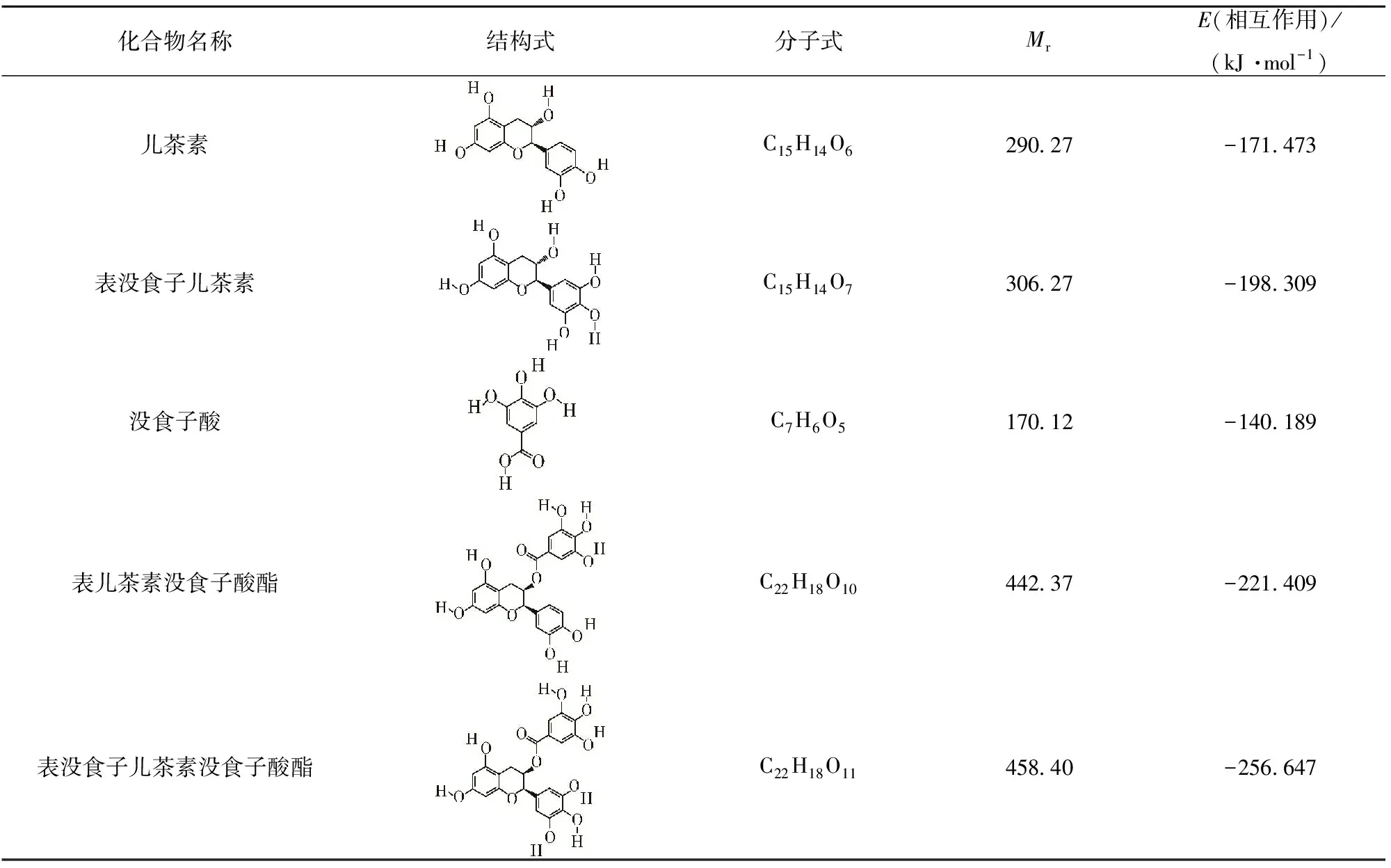
表2 ACP抑制剂虚拟筛选结果
2.6 抑制剂对ACP活性的影响
不同抑制剂对ACP活性的影响见图4。儿茶素浓度小于等于0.4 mmol/L时,ACP的相对酶活均为65%左右,无明显差异;当儿茶素浓度在0.6~1.0 mmol/L时,ACP的相对酶活显著性下降(P<0.05),说明儿茶素抑制ACP具有浓度依赖性,且儿茶素浓度为 1.0 mmol/L 时,ACP 的相对酶活是 39.74%,经线性拟合儿茶素抑制ACP的IC50为0.76 mmol/L。随着EGC、GA、ECG和EGCG浓度升高,ACP的相对酶活均显著下降(P<0.05),说明EGC、GA、ECG和EGCG抑制ACP活性具有浓度依赖性;当EGC、GA、ECG和EGCG浓度均为1.0 mmol/L时,ACP 的相对酶活分别是 31.49%、34.76%、29.76%、30.76%,EGC、GA、ECG和EGCG抑制ACP的IC50分别是0.47、0.80、0.44、0.45 mmol/L。Siddiqua等[5]选取金属化合物和有机物探究对麦瑞加拉鲮鱼肝ACP活性的抑制作用,结果表明Ca2+和Mn2+不会降低ACP活性,其相对酶活为97%、82%;ACP活性不受甲醇、乙醇和甘油的影响;而酒石酸盐可以降低ACP活性,相对酶活是6%;而氟化物使ACP相对酶活降低至40%。相比于化学类抑制剂,天然多酚类化合物具有为安全、低毒、高效等特点。多酚抑制ACP相对酶活在40%,抑制强度和氟化物类似。因此,可以推测筛选出的5个多酚抑制剂均能有效抑制ACP活性,且浓度越大,抑制效果越好。

不同字母表示同种抑制剂不同浓度时数据差异显著(P<0.05)。
2.7 抑制剂与ACP的分子对接分析
筛选的抑制剂与ACP的分子对接结果如图5。由图5(a)可知,儿茶素与ACP相互作用的主要氨基酸是天冬氨酸(Asp)和精氨酸(Arg)等,与这2种氨基酸形成2个氢键,键长分别是1.95、2.61 Å。EGC与ACP相互作用的主要氨基酸有甘氨酸(Gly)、Arg、蛋氨酸(Met)和谷氨酰胺(Gln)等,其中与Gly、Arg、Met和Gln共形成7个氢键,键长分别是2.02、2.03、1.89、3.01、2.95、2.01、2.72 Å[图5(b)]。由图5(c)可知,GA与ACP相互作用的主要氨基酸是Gly、Met和Arg等,其中与Gly、Met形成了2个氢键,键长分别是2.16、2.68 Å。由图5(d)可知,ECG与ACP相互作用的主要氨基酸有Arg、Met、Gln、苏氨酸(Thr)、缬氨酸(Val)和丙氨酸(Ala)等,其中与Arg、Met、Gln、Thr、Val和Ala形成了9个氢键,键长分别是2.41、2.01、2.29、2.47、2.63、2.42、2.06、2.03 Å。EGCG与ACP相互作用的主要氨基酸有Yhr、Arg、Gly和Met等,其中与Yhr、Arg、Gly和Met形成了8个氢键,键长分别是2.42、1.87、4.52、2.39、2.22、2.27、1.97、2.17 Å[图5(e)]。儿茶素、EGC、GA、ECG和EGCG与ACP相互作用除了氢键外,还有疏水相互作用。而已有研究表明大分子与小分子之间的相互作用方式是氢键和范德华力。Moradi等[21]研究发现腐胺与ACP相互作用是氢键和范德华力。原因是多酚类化合物和腐胺二者结构不同,导致与ACP相互作用力不同。步营等[22]采用分子对接技术从食品原料(虾夷扇贝)中筛选具有抗2019新型冠状病毒(SARS-CoV-2)能力的生物活性肽段,二者之间相互作用方式也是氢键和范德华力。
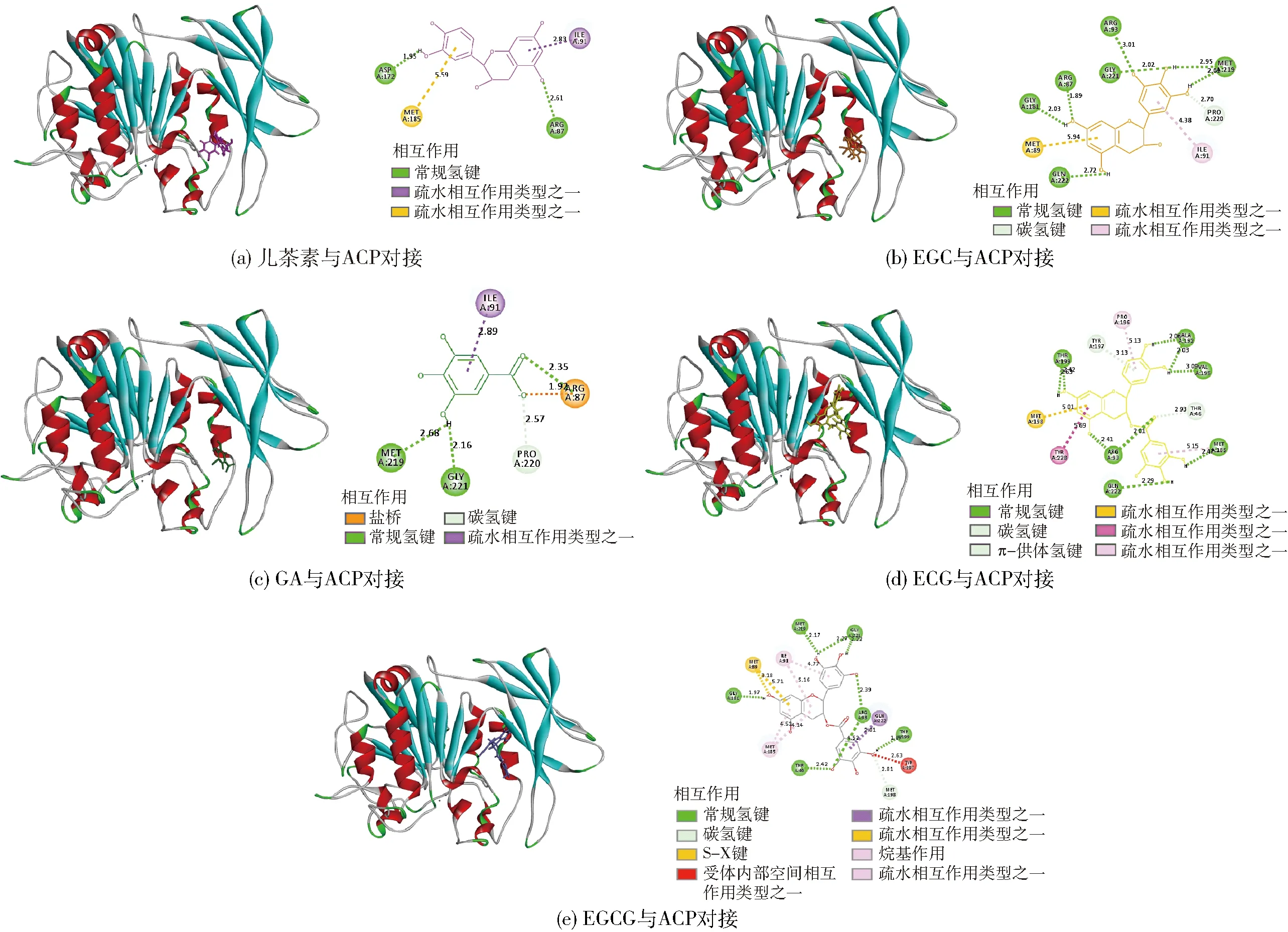
图5 抑制剂与ACP分子对接结果
3 结 论
粗酶液经过硫酸铵沉淀后,纯化了5.94倍,回收率为63.38%,经DEAE-Sepharose离子交换柱和Sephadex G-200凝胶层析后,得到2种ACP,即ACP I和ACP Ⅱ。ACP I经纯化后比活力6.57 U/mg,纯化了36.50倍,回收率为9.96%。ACP Ⅱ比活力为4.62 U/mg,纯化了25.67倍,回收率为6.07%。由于ACP I回收率和纯化倍数相对较高,对其进行了进一步的研究。ACP I最适温度为30 ℃,最适pH 值为5.0; ACP I的Km为0.098 mmol/L,vmax为1.07 μmol/(L·min)。ACP I的 α-螺旋含量14.10%,β-折叠含量35.90%,β-转角含量18.20%,无规则卷曲含量32.60%。通过虚拟筛选技术筛选出5个潜在多酚类化合物可作为ACP抑制剂;多酚类物质与ACP的主要作用力为氢键和疏水作用。在一定浓度范围内(0~1.0 mmol/L),5个多酚化合物均能有效降低ACP活性,且浓度越大抑制效果越好,儿茶素、表没食子儿茶素、没食子酸、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯抑制酶活性的IC50分别是0.76、0.47、0.80、0.44、0.45 mmol/L。

