3种黄酮类化合物对α-淀粉酶的抑制机制
覃亚娟, 王 萍, 陈小爱, 徐 飞, 朱科学,张彦军,*, 谭乐和
(1.东北林业大学 林学院,黑龙江 哈尔滨 150040; 2.黑龙江省森林食品资源利用重点实验室,黑龙江 哈尔滨 150040; 3.中国热带农业科学院 香料饮料研究所/国家重要热带作物工程技术研究中心/海南省特色热带作物适宜性加工与品质控制重点实验室/海南省热带香料饮料作物工程技术研究中心,海南 万宁 571533)
淀粉是人类膳食的主要成分和最主要的能源物质,然而,淀粉类似于隐藏的糖,其快速消化会导致餐后血糖水平升高[1]。长期持续的餐后高血糖水平会造成胰岛素分泌异常,进而诱发糖尿病和心血管疾病等慢性病[2]。目前,预防和治疗高血糖主要通过改变饮食习惯,如控制高升糖食物的摄入或者在消化过程中干预葡萄糖的吸收等。据报道,α-淀粉酶是将淀粉水解为麦芽糖、低聚糖和少量葡萄糖的关键消化酶[3]。通过抑制α-淀粉酶的活性,能够延迟淀粉消化,抑制肠道对葡萄糖的吸收,有效调节体内血糖水平[4]。目前,一些抑制α-淀粉酶的药物常在临床上被用于降糖,如阿卡波糖、二甲双胍和瑞格列奈,但这些药物易引发低血糖、胃肠功能紊乱和体重增加等副作用[4]。因此,研究天然有效且副作用少的α-淀粉酶抑制剂是十分必要的。

芦丁、槲皮素和山奈酚是3种典型的黄酮类化合物,广泛存在于多种热带植物中,如诺丽、番石榴和百香果等。此外,这3种黄酮类化合物的结构特征相似,区别在于其B环C3’和C环上C3的官能团有所不同。本研究拟选取这3种黄酮类化合物,通过考察它们对α-淀粉酶的抑制作用,建立其抑制α-淀粉酶的构效关系,确定黄酮类化合物发挥主要抑制作用的关键结构。采用抑制动力学、荧光光谱、圆二色谱探究这些关键结构对黄酮类化合物抑制α-淀粉酶的影响,从而更好地理解黄酮类化合物抑制α-淀粉酶的机制。此外,通过分子对接技术考察黄酮类化合物和α-淀粉酶之间潜在的分子相互作用,探究黄酮类化合物抑制α-淀粉酶的作用机制和构效关系,以期为具有更高降血糖活性的黄酮类化合物功能性食品的开发奠定理论基础。
1 材料与方法
1.1 材料与试剂
芦丁、槲皮素、山奈酚、阿卡波糖(质量分数均大于98%)、猪胰腺α-淀粉酶(14 U/mg),上海源叶生物科技有限公司;可溶性淀粉,阿拉丁化工公司(上海)。其他试剂均为分析纯。
1.2 仪器与设备
SPECORD 250PLUS型紫外可见分光光度计,德国耶拿公司;F-7000型荧光分光光度计,日立高新技术公司;MOS-500型圆二色谱仪,法国Bio-Logic公司;AL104型电子天平,梅特勒-托利多仪器(上海)有限公司;Cascada Ⅲ.Ⅰ10型超纯水系统,美国PALL公司;GT SONIC-T20型超声波清洗机,广东固特超声股份有限公司。
1.3 实验方法
1.3.1黄酮类化合物对α-淀粉酶抑制率的测定
根据Zhang等[11]的方法对α-淀粉酶活性进行测定,稍加修改。将500 μL不同浓度的芦丁、槲皮素、山奈酚和阿卡波糖样品溶液分别与250 μL的 α-淀粉酶(7 U/mL)溶液在37 ℃下孵育20 min。将500 μL糊化后的可溶性淀粉溶液(10 mg/mL)添加到反应混合物中,在37 ℃下孵育3 min。反应完毕后,迅速加入1 mL 3,5-二硝基水杨酸试剂终止反应,并将反应产物在沸水中加热8 min,冷却至室温后,用去离子水定容至25 mL,用分光光度计记录溶液在540 nm处的吸光值。以阿卡波糖作为阳性对照。将所得结果代入式(1)计算样品对α-淀粉酶的抑制率。用Graphpad prism 9计算IC50值。
(1)
式(1)中,A(样品)为样品溶液吸光值,A(样品空白)为样品空白溶液吸光值,A(对照)为对照溶液吸光值,A(对照空白)为对照空白溶液吸光值。
1.3.2α-淀粉酶抑制动力学参数的计算
3种黄酮类化合物对α-淀粉酶的抑制模式由1.3.1中的方法确定。可溶性淀粉溶液的质量浓度为5.0、7.5、10.0、12.5、15.0 mg/mL。米氏常数(Km)和最大反应速度(Vmax)由Lineweaver-Burk方程确定,见式(2)。竞争性抑制常数(Kic)和非竞争性抑制常数(Kiu)根据式(3)、式(4)通过二次线性拟合计算获得。
(2)
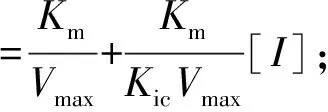
(3)
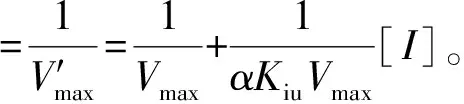
(4)
式(2)、(3)、(4)中,V表示初始反应速率,mg/(mL·min);Vmax表示最大反应速度,mg/(mL·min);Km表示米氏常数,mg/mL;Kic表示竞争性抑制常数,mg/mL;Kiu表示非竞争性抑制常数,mg/mL;[I]表示抑制剂质量浓度,mg/mL;α表示表观系数。
1.3.3荧光光谱分析
1.3.3.1 二维荧光光谱分析
采用荧光分光光度计测定3种黄酮类化合物与α-淀粉酶的荧光淬灭光谱。将0.2 mL不同浓度的样品溶液与3 mL α-淀粉酶溶液混合,分别在温度为298、304、310 K下反应20 min。用磷酸盐缓冲液(PBS)代替样品作为对照组,激发波长280 nm,发射波长290~500 nm,狭缝宽度5 nm。采用Stern-Volmer方程研究荧光淬灭类型,见式(5)。
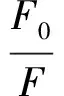
(5)
式(5)中,F0和F分别表示存在和不存在黄酮类化合物时的荧光强度;Kq表示荧光淬灭速率常数,L/(mol·s);τ0表示荧光团的寿命,2.97 ns;Ksv表示Stern-Volmer淬灭常数,L/mol;[Q]表示淬灭剂的浓度,mol/L。
1.3.3.2 结合常数和结合位点数的计算
为进一步确定黄酮类化合物对α-淀粉酶的抑制机制,参考Yang等[12]的方法,根据式(6)计算结合常数和结合位点数。
(6)
式(6)中,Ka表示样品与α-淀粉酶的结合常数,L/mol;n是结合位点数;[Q]表示淬灭剂的浓度,mol/L。
1.3.3.3 热力学参数的计算
通过van’t Hoff方程[式(7)和式(8)]计算与结合相互作用相关的热力学参数,以表征抑制剂与α-淀粉酶结合的主要相互作用力。
(7)
ΔG=ΔH-TΔS。
(8)
式(7)、(8)中,ΔH表示焓变,kJ/mol;ΔS表示熵变,kJ/(mol·K);ΔG表示自由能变化,kJ/mol;R表示气体常数,8.314 J/(mol·K);T表示测试温度,K。
1.3.3.4 α-淀粉酶构象分析
采用荧光分光光度计检测3种黄酮类化合物与α-淀粉酶三维荧光光谱。将3种黄酮类化合物和α-淀粉酶溶液分别混合并孵育20 min。激发波长(λex)为200~350 nm,发射波长(λem)为200~400 nm,激发和发射间隔为10 nm。
1.3.4α-淀粉酶二级结构分析
采用圆二色谱仪分析3种黄酮类化合物对α-淀粉酶二级结构的影响。将0.5 mL的样品溶液与0.5 mL α-淀粉酶溶液混合,在37 ℃下反应20 min。用PBS代替黄酮类化合物作为对照组。测定参数:路径长度为0.1 cm,步长为1 nm,波长为190~260 nm。在DichroWeb在线网站(http:∥dichroweb.cryst.bbk.ac.uk)上分析测试结果[12]。
1.3.5分子对接
采用AutoDock4.2软件对3种黄酮类化合物与α-淀粉酶进行分子对接,并得到结合能。α-淀粉酶(PDB ID:1OSE)的模型通过RCSB蛋白质数据库(http:∥www.rcsb.org/pdb)获得。芦丁、槲皮素和山奈酚的结构从ZINC数据库中下载。通过去除水分子、添加极性氢和Kollman联合原子电荷来处理黄酮类化合物和α-淀粉酶的结构以获得PDB文件。采用拉马克遗传算法进行计算,搜索次数为100次。最后通过PyMOL和Dicscover Studio软件进行可视化分析,根据对接结果得到对接参数。
1.4 数据处理
所有实验均重复3次,数据以平均值±标准差表示。采用SPSS 21.0.1软件对实验结果进行显著性分析(P< 0.05为差异显著)。采用Origin 2022软件绘图。
2 结果与分析
2.1 3种黄酮类化合物对α-淀粉酶的抑制效果
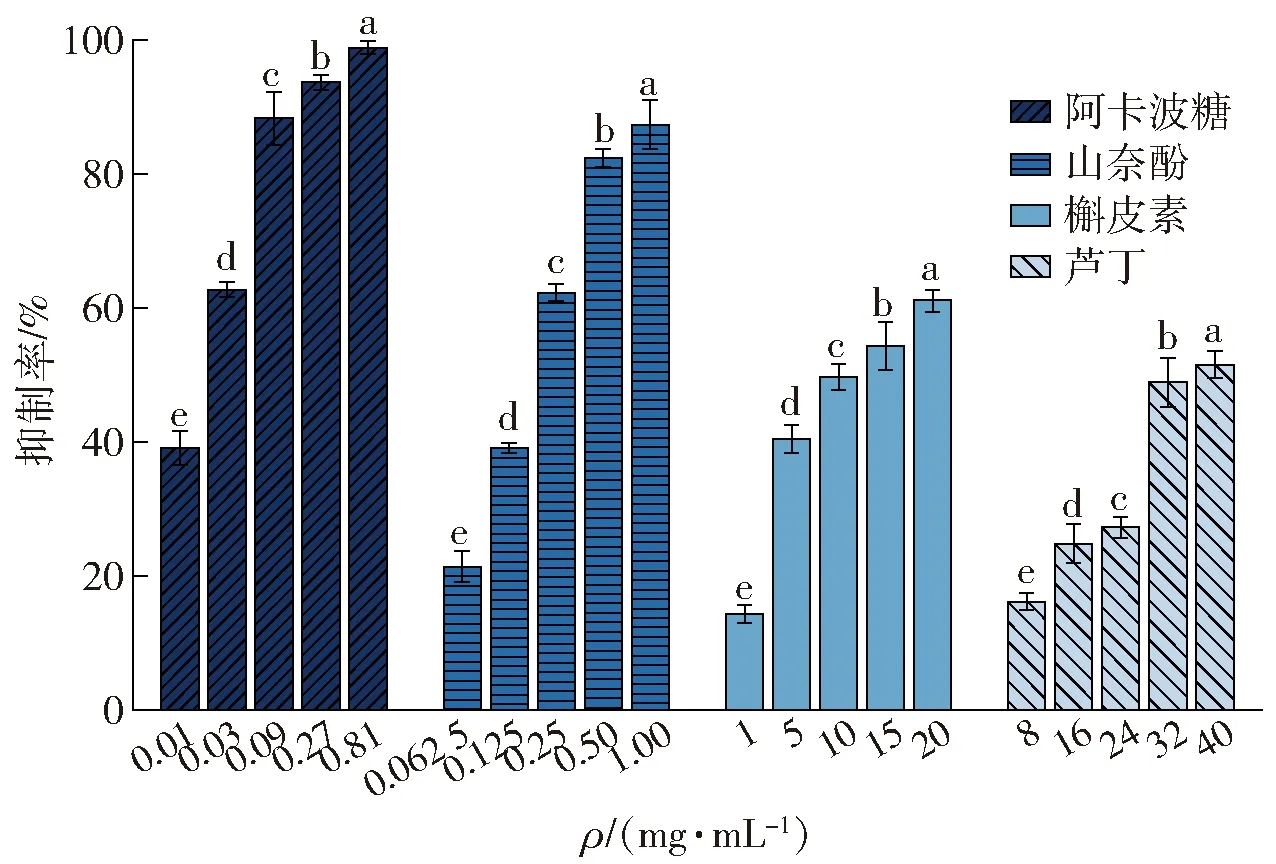
半数抑制浓度(IC50)通常被作为评价抑制剂对α-淀粉酶的抑制活性的指标。3种黄酮类化合物和阿卡波糖对α-淀粉酶抑制率测定结果见图1,3种黄酮类化合物的分子结构见图2,IC50值的计算结果见表1。

表1 3种黄酮类化合物和阿卡波糖抑制α-淀粉酶的IC50值
不同小写字母代表同一指标差异显著(P< 0.05)。
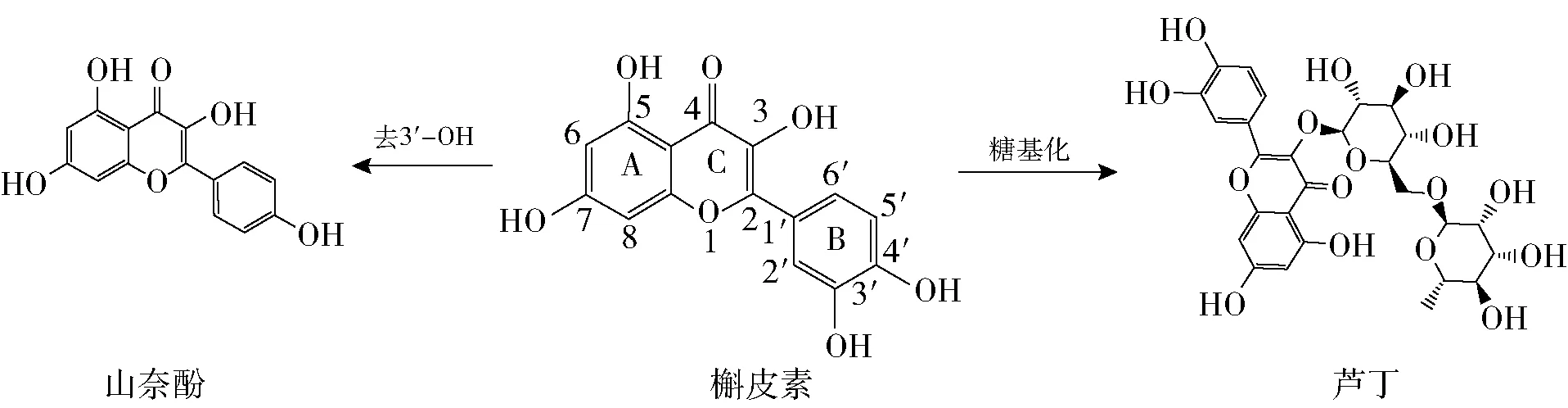
图2 3种黄酮类化合物的分子结构
由图1可知,随着黄酮类化合物质量浓度的增加,其对α-淀粉酶的抑制能力逐渐增强。由表1可知,3种黄酮类化合物抑制α-淀粉酶的IC50值的顺序由小到大依次为山奈酚、槲皮素、芦丁。由图2 可知,山奈酚对α-淀粉酶的抑制作用最强,这可能与其B环上C3’处的去羟基化有关。槲皮素C环上C3处的羟基糖基化后转变为芦丁,槲皮素抑制α-淀粉酶的能力强于芦丁,可能与二者在此位置的基团不同有关。Wang等[13]报道,从番石榴叶中分离出的槲皮素对α-淀粉酶的抑制能力优于其糖苷,与本实验结果一致。虽然3种黄酮类化合物对α-淀粉酶的抑制能力低于阿卡波糖,但其天然特性和酶抑制作用结果仍表明,黄酮类化合物可替代一部分阿卡波糖,进而减少降糖药物的用量。显然,黄酮类化合物对α-淀粉酶的抑制作用与其分子结构密切相关,其中B环C3’处的羟基和C环C3处的糖基的有无对α-淀粉酶的抑制作用十分重要。
2.2 3种黄酮类化合物对α-淀粉酶的抑制类型分析
酶抑制动力学的类型分为竞争型、非竞争型和混合型[14],通过Lineweaver-Burk图可以确定3种黄酮类化合物对α-淀粉酶的抑制类型和动力学参数,以更好地了解其抑制机制。3种黄酮类化合物抑制α-淀粉酶的Lineweaver-Burk图见图3,动力学参数的计算结果见表2。

表2 3种黄酮类化合物抑制α-淀粉酶的动力学参数

图3 3种黄酮类化合物抑制α-淀粉酶的Lineweaver-Burk双倒数曲线
由图3 (a)可见,不同浓度的芦丁对α-淀粉酶的抑制曲线都呈线性拟合并相交于第二象限。同时,由表2可知,随着芦丁浓度的增加,Vmax值降低(P<0.05),Km值增加(P< 0.05),表明芦丁诱导了混合型抑制的产生。槲皮素对α-淀粉酶抑制类型亦为混合型抑制[图3(b)],另一项研究报道,槲皮素是α-淀粉酶的竞争性抑制剂[8],这种相反的结论,可能源于实验条件,特别是抑制剂浓度和酶纯度的差异[15]。另外,由图3 (c)可知,随山奈酚浓度的增加,Vmax基本不变(P>0.05),但Km值随着山奈酚浓度的增加而增加(P<0.05),这表明山奈酚以竞争方式抑制α-淀粉酶,意味着其可以与α-淀粉酶的活性位点结合,与底物竞争。
抑制常数(Ki)是评估α-淀粉酶与抑制剂结合能力的重要参数[3],1/Ki值越高表明抑制剂与α-淀粉酶的结合亲和力越强。由表2可知,芦丁的Kic值和Kiu值分别为(9.31±1.01 )mg/mL和(15.90±0.88)mg/mL,Kic/Kiu的值低于1,且Kic值低于Kiu值,表明在混合型抑制中竞争型抑制占主导地位,意味着芦丁-α-淀粉酶复合物的结合能力高于芦丁-α-淀粉酶-底物。对于槲皮素而言,也可以得到相同的结论。由表2可知,芦丁的Kic值远高于槲皮素,可能是其C环C3处的糖基增加了芦丁进入α-淀粉酶活性腔时的空间位阻,阻碍了芦丁与α-淀粉酶关键活性残基的结合,显著降低了芦丁与α-淀粉酶的结合强度。山奈酚与α-淀粉酶的结合亲和力[Kic值为(0.63±0.08) mg/mL]高于槲皮素[Kic值为(5.42±0.97)mg/mL],这是由于其B环上C3’的去羟基化形成了竞争型抑制,导致山奈酚与α-淀粉酶的结合更紧密。Lim等[16]也报道了类似的结果,木樨草素(Kic值为29.49 μmol·L-1)对α-淀粉酶的结合亲和力高于3′,4′-二羟基黄酮醇(Kic值为399.92 μmol·L-1)。
2.3 3种黄酮类化合物对α-淀粉酶荧光淬灭光谱的影响
2.3.1淬灭类型分析
利用荧光淬灭光谱可以探究分子间的物理化学相互作用,例如碰撞淬灭、能量转移和基态复合物的形成等[17]。3种黄酮类化合物与α-淀粉酶相互作用的二维荧光光谱及Stern-Volmer图见图4,荧光淬灭参数的计算结果见表3。
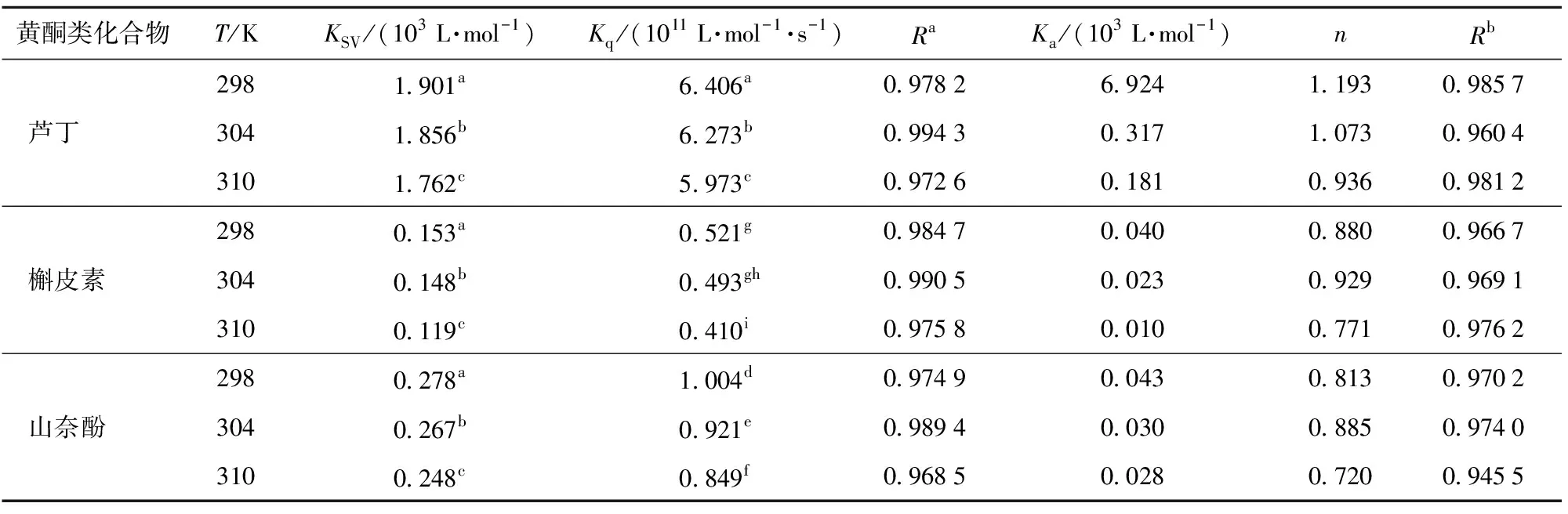
表3 不同温度下3种黄酮类化合物抑制α-淀粉酶的荧光淬灭参数和结合常数
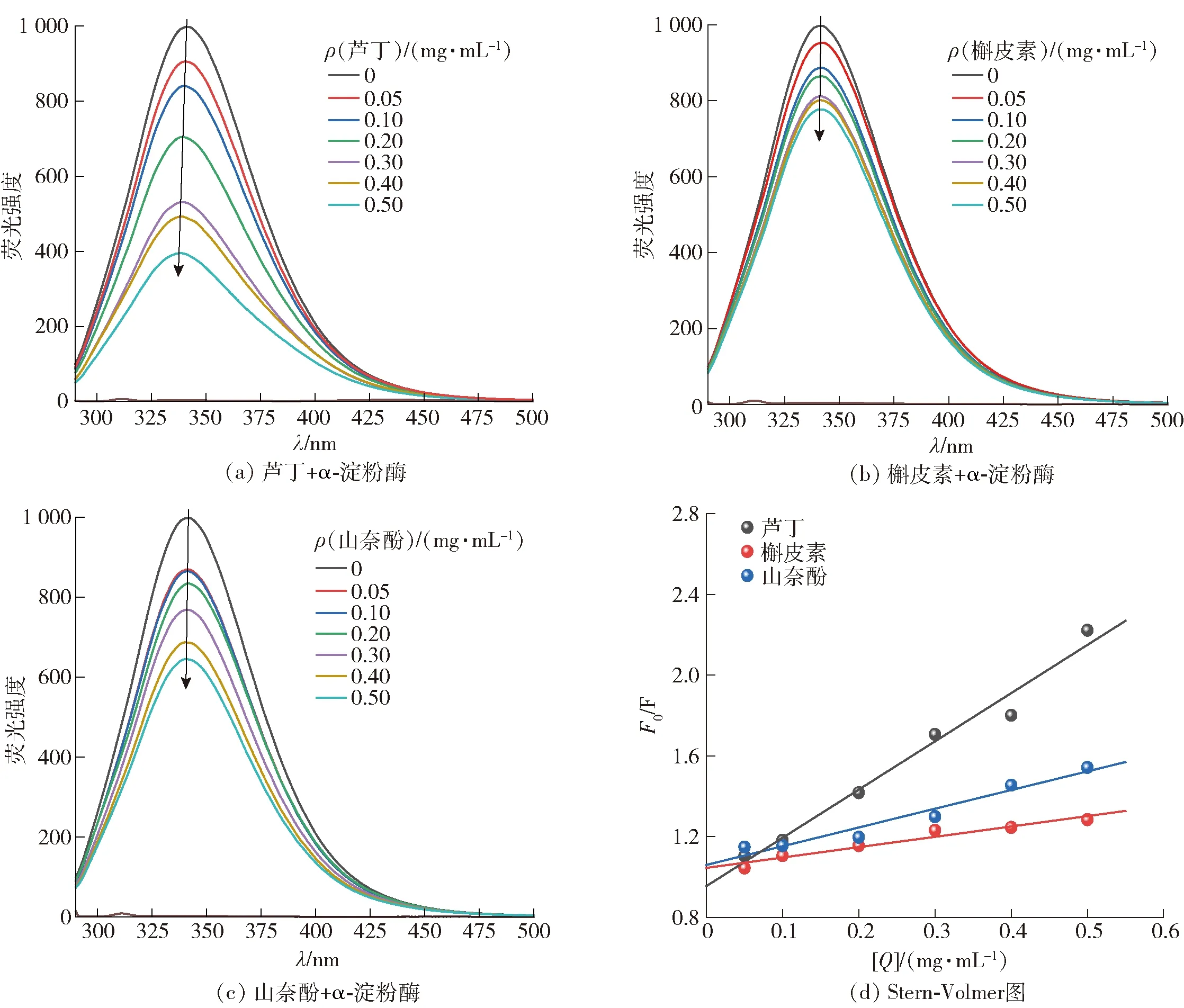
图4 3种黄酮类化合物与α-淀粉酶相互作用的荧光光谱及298 K下3种黄酮类化合物抑制α-淀粉酶的Stern-Volmer图
由图4 (a)、(b)和(c)可知,当激发波长位于280 nm时,在342 nm处出现α-淀粉酶的最大发射峰。同时,最大发射峰的强度随着黄酮类化合物浓度的增加而降低,且最大发射波长出现蓝移。这表明,3种黄酮类化合物可以通过与α-淀粉酶结合来淬灭酶的固有荧光,并改变酶的构象和疏水微环境。橡子仁多酚对α-葡萄糖苷酶的荧光发射光谱也显示了类似的影响,即微弱的蓝移表明α-葡萄糖苷酶荧光团周围微环境的极性降低[18]。
由图4 (d)可知,3种黄酮类化合物诱导的α-淀粉酶的Stern-Volmer曲线都随着其浓度的增加呈现线性拟合,且3种黄酮类化合物对α-淀粉酶的KSV值与温度之间呈显著负相关(P<0.05)(表3),这说明3种黄酮类化合物淬灭α-淀粉酶的荧光过程中存在单一的淬灭机制。由表3可知,3种黄酮类化合物的Kq值高于最大散射碰撞淬灭常数(2.0×1010L/mol·s)(P<0.05),这进一步表明淬灭机制是静态淬灭而不是动态淬灭。此外,随着温度的升高,KSV值降低,表明较高的温度不利于黄酮类化合物与α-淀粉酶结合,黄酮类化合物淬灭α-淀粉酶的过程为放热反应过程。
2.3.2结合常数和结合位点分析
为了进一步确定3种黄酮类化合物对α-淀粉酶的抑制机制,分别计算了3种温度下3种黄酮类化合物对α-淀粉酶荧光淬灭的结合常数Ka和结合位点数n(表3)。根据Zheng等[19]的研究,Ka值代表抑制剂与酶的淬灭亲和力,Ka值越大,抑制剂对酶的淬灭亲和力越强,抑制能力便越高。从表3可以看出,槲皮素的Ka值低于山奈酚,但其IC50值高于山奈酚(表1),该结果与Zheng等[19]的研究结论一致;相反,与槲皮素和山奈酚相比,芦丁的Ka值是最高的,但其对α-淀粉酶的抑制能力却是最弱的。据Soares等[20]的研究,可能是芦丁的C环上C3处的糖基可以与α-淀粉酶上更多的氨基酸残基结合,从而具有更高的Ka值,但芦丁与α-淀粉酶的活性位点上的关键氨基酸残基的结合少于槲皮素和山奈酚,导致芦丁对α-淀粉酶没有表现出强的抑制能力。此外,在3个温度下的n值都近似等于1,这表明3种黄酮类化合物和α-淀粉酶之间只有一个主要的结合位点[21]。
2.3.3热力学参数和结合力分析
不同温度下3种黄酮类化合物与α-淀粉酶相互作用的热力学参数计算结果见表4。
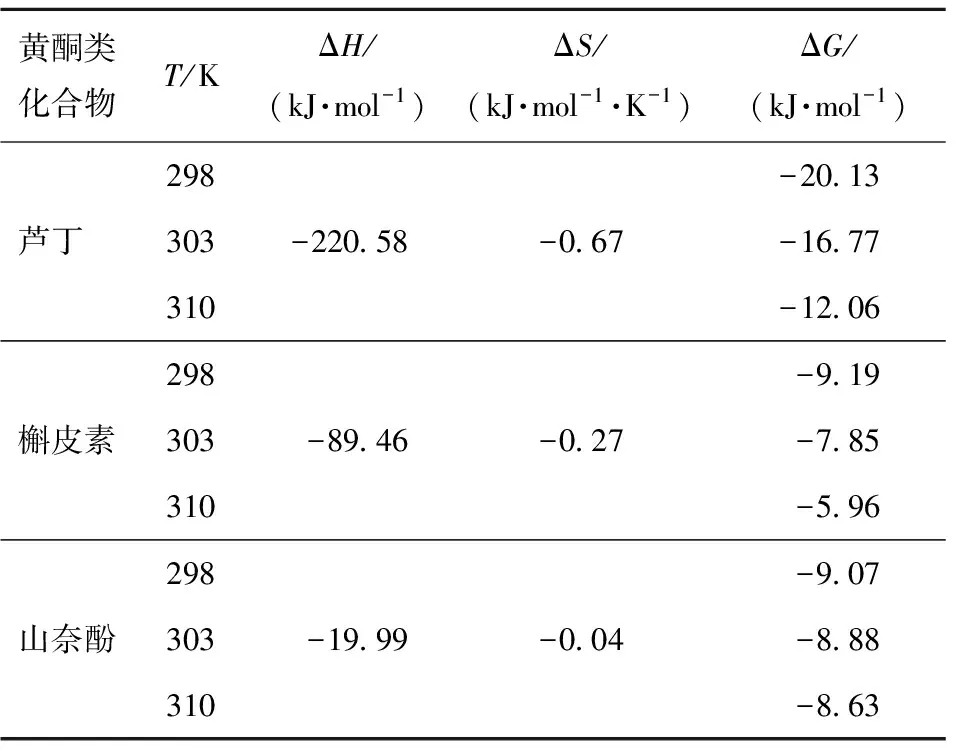
表4 不同温度下3种黄酮类化合物抑制α-淀粉酶的热力学参数
由表4可知,在不同温度下,芦丁、槲皮素和山奈酚的ΔG值均为负值,表明了3种黄酮类化合物与α-淀粉酶的相互作用是一个自发的过程。根据Ross等[22]的研究,ΔH<0和ΔS<0表明黄酮类化合物和α-淀粉酶的主要结合力为氢键。ΔG和ΔS皆为负值表明结合反应主要是由焓驱动的放热反应过程,这与KSV值随温度变化的结果一致。Yang等[12]也报道了类似的结果,即紫甘薯中的二酰化花青素和α-淀粉酶之间的结合反应是放热且由焓驱动的。
2.3.43种黄酮类化合物对α-淀粉酶构象的影响
三维荧光光谱可用于进一步了解抑制剂与α-淀粉酶结合所引起的酶构象的变化。3种黄酮类化合物对α-淀粉酶的三维荧光光谱和荧光特征参数分别见图5和表5。
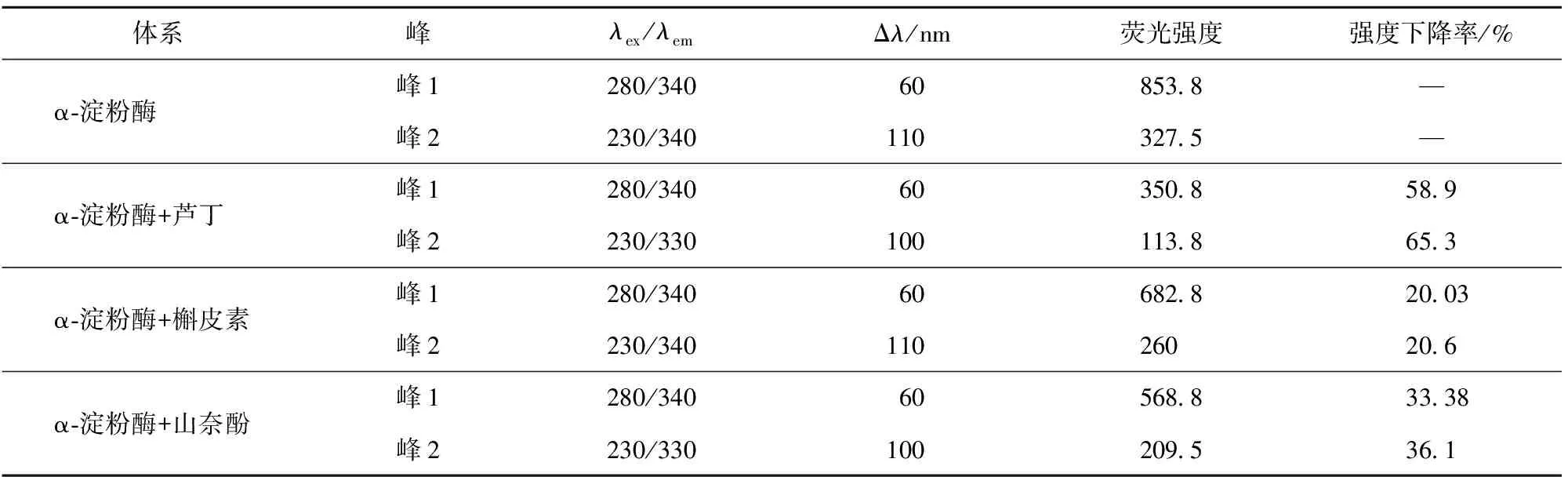
表5 3种黄酮类化合物与α-淀粉酶相互作用的三维荧光特征参数

峰a为瑞利散射峰,峰1、2为主要荧光特征峰。

2.4 3种黄酮类化合物对α-淀粉酶二级结构的影响
圆二色谱可用于探究蛋白质二级结构的变化。有无黄酮类化合物时,α-淀粉酶的圆二色谱见图6,二级结构的变化见表6。
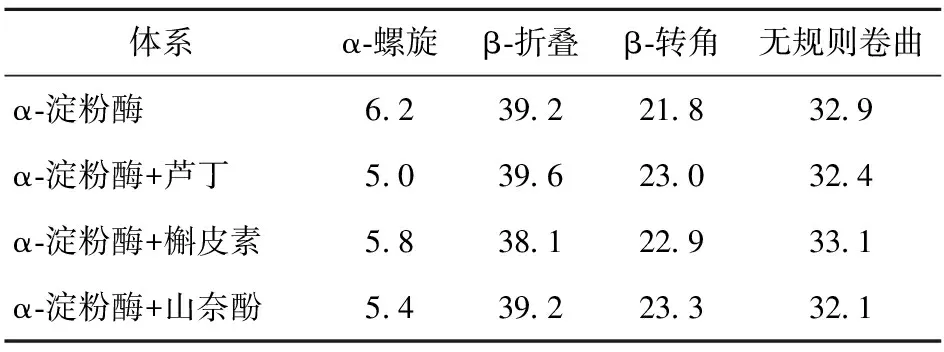
表6 3种黄酮类化合物对α-淀粉酶二级结构的影响
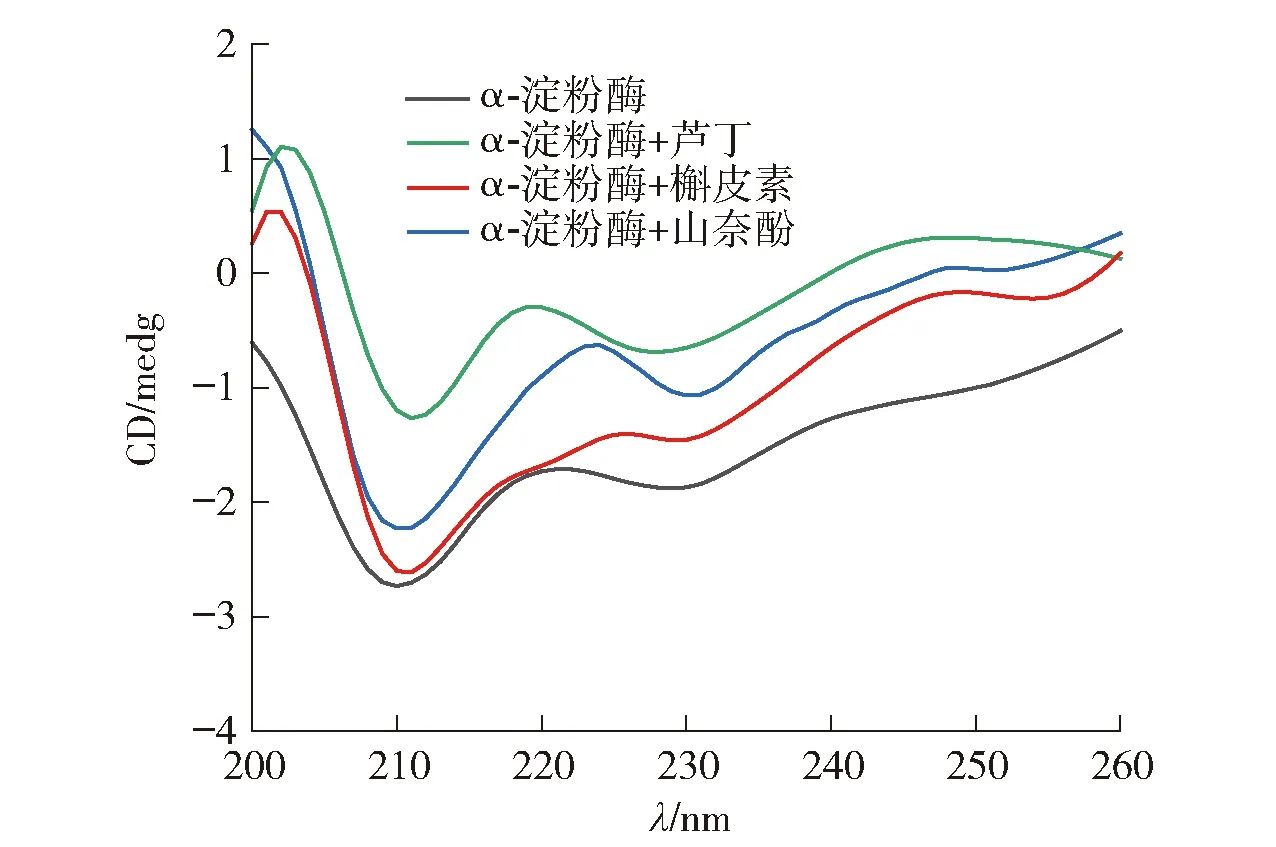
图6 黄酮类化合物与α-淀粉酶相互作用的圆二色谱
由图6可知,α-淀粉酶在210、229 nm波长处有两个负峰。随着黄酮类化合物的加入,两个负峰的强度显著降低,表明α-淀粉酶的二级结构发生了改变。由表6可知,芦丁和山奈酚的加入降低了α-螺旋和无规则卷曲的比例,增加了β-转角的比例。槲皮素的加入降低了α-螺旋和β-折叠的比例,增加了β-转角和无规则卷曲的比例。这表明3种黄酮类化合物诱导了α-淀粉酶的二级结构的变化,改变了酶的空间构象,从而影响了底物与酶活性位点的结合。Dai等[28]也报道了类似的结果,即表没食子儿茶素没食子酸酯改变了α-淀粉酶的二级结构。
2.5 3种黄酮类化合物与α-淀粉酶相互作用的可视化分析
分子对接是一种可视化小分子与蛋白质相互作用的结合力、结合位点和结合能的新型研究手段。图7是3种黄酮类化合物与α-淀粉酶的对接结果。

图7 3种黄酮类化合物与α-淀粉酶的分子对接结果
由图7可知,芦丁、槲皮素和山奈酚均能与α-淀粉酶的活性位点1结合,该位点由氨基酸残基Glu-233、Ile-235、Leu-162、Lys-200、Tyr-151、Lie-148、Val-163、Gly-306、His-201、Ala-198、His-305,Tyr-62、Asp-300、Leu-165、Asp-197、His-299、Arg-195和Trp-59构建。据报道,Asp-197、Glu-233和Asp-300是α-淀粉酶上的关键氨基酸残基,其在催化机制中起重要作用[29]。由此推断,3种黄酮类化合物通过占据α-淀粉酶上的主要活性位点,竞争性地阻碍底物进入主要活性位点,进而导致酶的催化活性降低。同时,芦丁、槲皮素和山奈酚的最低结合能分别为-5.37、-6.68、-7.06 kcal/mol,该顺序与IC50值和Kic值的顺序一致(表1和表2)。此外,由图7 (b)和(c)可知,芦丁和槲皮素也能插入到位点2和位点3中,最低结合能分别为-4.02、-4.28 kcal/mol,表明芦丁和槲皮素与α-淀粉酶结合也表现出非竞争性行为。根据Dai等[30]的报道,小分子与蛋白质的结合能越低,结合结构越稳定。芦丁和槲皮素在竞争性模式下的结合能低于非竞争模式,说明两者主要以竞争性的方式抑制α-淀粉酶,这与抑制动力学中抑制类型的结果一致。
图7 (b)可知,芦丁主要被10个氨基酸残基包围,结合力主要为氢键和疏水作用。芦丁C环上C3处的糖基与Tyr-151、Val-163和Gly-306形成了3个氢键;与Tyr-151产生了1个π-烷基;与Leu-162和Lie-148产生了2个烷基。与槲皮素和山奈酚相比,芦丁C环上C3处的糖基扩大了共轭体系,能够结合活性位点周围更多的氨基酸残基,进而产生最强的结合亲和力,即Ka值最高(表3)。
由图7 (c)可知,槲皮素主要被7个氨基酸残基包围,包括Val-163、Trp-59、Leu-165、Tyr-62、Asp-197、Asp-300和His-305。Asp-300和Asp-197分别与B环上C 3’和C 4’处的羟基形成氢键;与Tyr-62形成π-π堆积。Yang等[9]的报道表明,抑制剂的抑制能力随着分子骨架上氢原子的羟基化而增加,但在本研究中,B环上C3’处的羟基化削弱了槲皮素抑制α-淀粉酶的能力,可能是由于槲皮素只能与关键活性位点残基Asp-197和Asp-300相互作用,进而造成其抑制α-淀粉酶的能力强于芦丁(仅与Glu-233相互作用),弱于山奈酚(与Asp-197、Glu-233和Asp-300相互作用)。Liao等[31]也报道了相似的结果,他们发现芹菜素(无C3’羟基)对α-淀粉酶的抑制作用强于木樨草素(有C3’羟基)。
由图7(d)可知,山奈酚和氨基酸残基(Glu-233、Asp-300、His-299和Arg-195)之间形成4个氢键。此外,还可以观察到2种疏水作用,包括Leu-165和Ala-198通过2个π-烷基与山奈酚相互作用;Trp-59、Tyr-62通过4个π-π堆积与山奈酚相互作用。研究证实,氢键会影响抑制剂的构象,进而影响抑制剂与固有荧光残基(Trp、Tyr和Phe)的相互作用[32-33]。由图7 (c)和(d)可知,相对于槲皮素,山奈酚B环上C3’处的去羟基化阻碍了B环上氢键的形成(Asp-300和Asp-197),使得山奈酚B环的旋转度大于槲皮素,进而增强了山奈酚B环的空间自由度。这种空间构型更有利于山奈酚与荧光残基(Trp-59和Tyr-62)产生π-π堆积,表现出更强的荧光淬灭效果,即Ka值大于槲皮素(表3)。
3 结 论
研究了3种黄酮类化合物对α-淀粉酶的抑制机制和构效关系。结果表明,三者均以浓度依赖性方式抑制α-淀粉酶的活性,对α-淀粉酶的抑制能力顺序由大到小依次为山奈酚、槲皮素、芦丁,其中,山奈酚竞争性地抑制α-淀粉酶,芦丁和槲皮素则表现出混合抑制作用。3种黄酮类化合物对α-淀粉酶的抑制作用与其分子结构密切相关。C环上C3处的糖基化削弱了芦丁对α-淀粉酶的抑制能力,增强了淬灭亲和力;B环上C3’处的羟基化降低了槲皮素对α-淀粉酶的抑制能力和淬灭亲和力。荧光淬灭结果表明,黄酮类化合物通过单一的静态机制有效地淬灭α-淀粉酶的固有荧光。结合常数和热力学参数进一步揭示了α-淀粉酶上存在单个高亲和力结合位点,黄酮类化合物与α-淀粉酶的结合是自发的由焓驱动的放热反应。三维荧光光谱研究表明,3种黄酮类化合物诱导了α-淀粉酶构象的变化,部分氨基酸残基的疏水微环境受到二者结合的调控。圆二色谱分析结果表明,黄酮类化合物的加入改变了α-淀粉酶的二级结构。此外,通过分子对接观察了3种黄酮类化合物与α-淀粉酶结合的可能构象,表明黄酮类化合物B环上C3’的羟基和C环上C3处的糖基与结合稳定性密切相关。研究结果旨在为黄酮类物质的改性和预防高血糖功能食品的开发等提供一定的理论参考。

