基于美国FAERS 数据库的达比加群酯不良反应信号挖掘研究
曾露,王璐,魏安华
华中科技大学同济医学院附属同济医院,湖北 武汉 430030
达比加群酯(dabigatran etexilate)是一种新型的直接凝血酶抑制剂,口服后在体内转化为活性的达比加群而发挥抗凝作用。达比加群酯于2008 年4月欧盟委员会批准其在27 个成员国上市,2010 年10 月获美国食品药品监督管理局(FDA)批准用于预防非瓣膜性房颤患者卒中和全身性栓塞。2013 年在中国上市,目前已被临床广泛用于预防非瓣膜性房颤患者卒中[1]、深静脉血栓(DVT)和/或肺栓塞(PE)的治疗和复发的预防[2]。与传统抗凝药物华法林相比,达比加群酯同为口服用药且具起效快、无须频繁调整剂量、无须频繁检测凝血功能、依从性佳、药物相互作用较少等优点。
药物在上市前都要经过一系列疗效和安全的评估研究,但因用药疗程和观察时间较短,很难发现一些迟发的、罕见的药物不良反应(ADR)。达比加群酯上市的时间相对短,其ADR 数据参考来源较局限,随着达比加群酯的临床应用逐渐增加,其不良反应报道亦逐渐增多。然而,达比加群酯在国内安全性研究多为文献调查分析和回顾性分析[3-5],国际上对达比加群酯的ADR 信号挖掘多集中在与其他口服抗凝药物在脑出血、消化道出血方面横向对比[6-8],并未对其ADR 进行全面分析。为此,本研究通过提取和分析美国FDA 不良事件报告系统(FAERS)的相关数据,对达比加群酯的ADR 信号进行全面分析和深入挖掘,以期为临床安全用药提供有益借鉴。
1 资料与方法
1.1 数据来源
本研究数据来源于FDA 自2004 年开始对外公开的不良事件报告系统(FAERS)数据库。本研究提取数据库中达比加群酯在2010 年10 月至2022年12 月的ASCII 数据包全部数据,导入到SAS9.4软件中进行数据清理与分析。
1.2 数据清理和筛选
去除数据中的重复报告后,根据删除报告列表中的CASEID 进行报告剔除,得到报告份数14 357 515,不良反应例次为41 967 798。通过检索药物通用名称“dabigatran”“dabigatran etexilate”和商品名“pradaxa”“dabiclo”,筛选得出目标药物为首要怀疑药物的报告数65 379 份,ADR155 881 例次;同时在ADR 报告表中,以“bleed”“bleeding”“haemorrhagic”“haematoma”“hemorrhage”和“haemorrhage”为关键词筛选出血相关ADR,得到31 669 例次。按MedDRA 中的首选术语(PT)及系统器官分类(SOC)对筛选得到的达比加群酯ADR 进行分类汇总。
1.3 信号挖掘方法
目前常见的信号挖掘方法包括报告比值比法(ROR)[9]、比例报告比值法(PRR)[9]、综合标准法(MHRA)[10]和贝叶斯置信度递进神经网络法(BCPNN)[11]。各方法计算公式及阈值见表1。

表1 信号挖掘计算公式
2 结果
2.1 报告基本构成情况
共纳入达比加群酯ADR 报告65 379 份,男性30 605 份,占46.81 %,女性27 725 份,占42.41%,男女相差不大;年龄主要分布在≥75 岁(23 589 份,36.08 %)和65~75 岁(11 639 份,17.80%);报告者以医生(28 347 份,43.36%)和消费者(25 745 份,39.38%)为主;主要上报国家为美国(23 646 份,36.17%),其次为日本、德国等;报告年份主要集中在2011—2014 年;适应证主要为房颤(37 125 份,56.78%),详见表2。
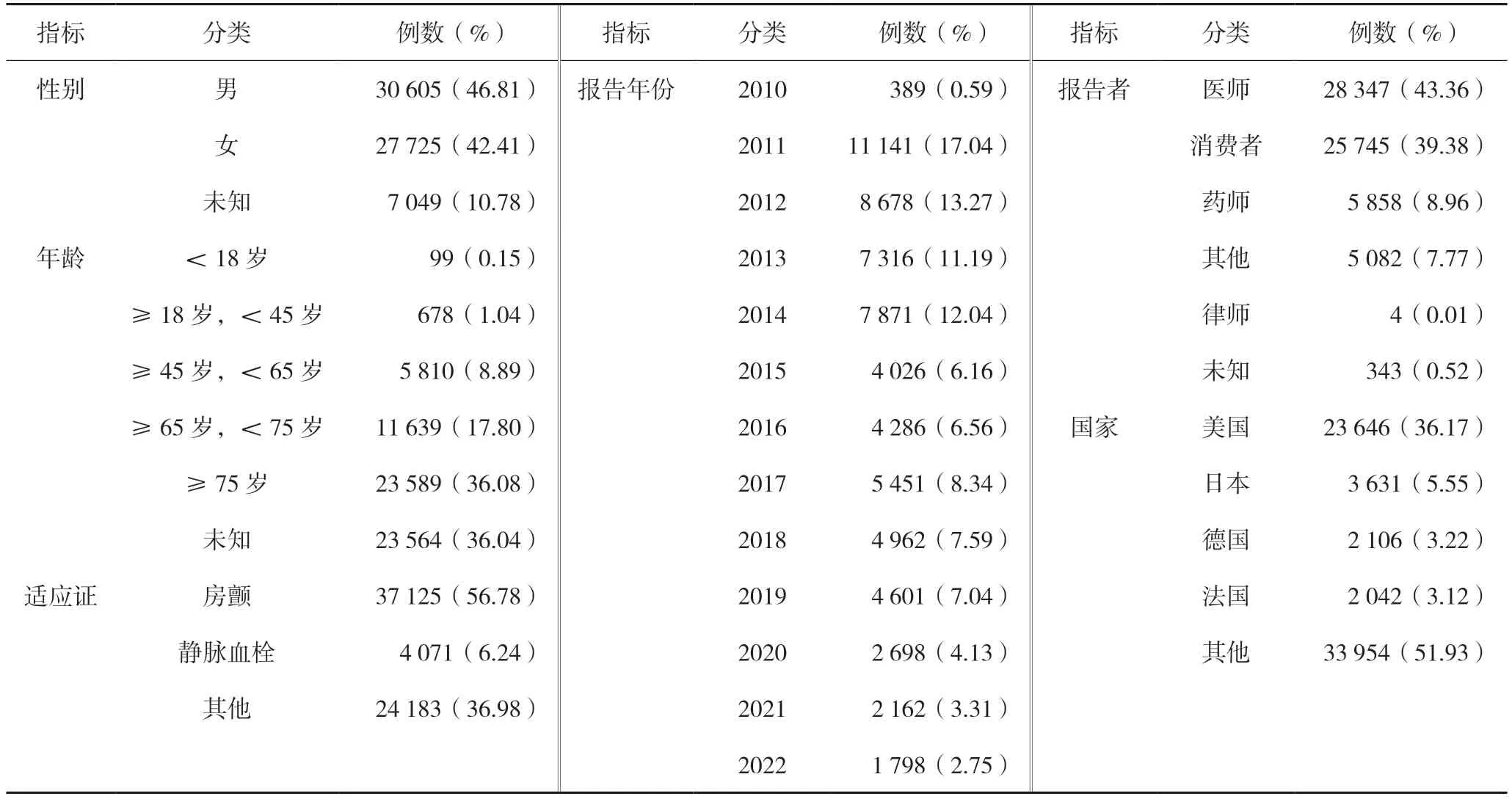
表2 达比加群酯ADR报告的基本情况(n=65 379)
2.2 纳入的ADR 报告信号分析
达比加群酯ADR 报告数排序前10 位的PT、SOC 分布及四种方法计算信号情况见表3。
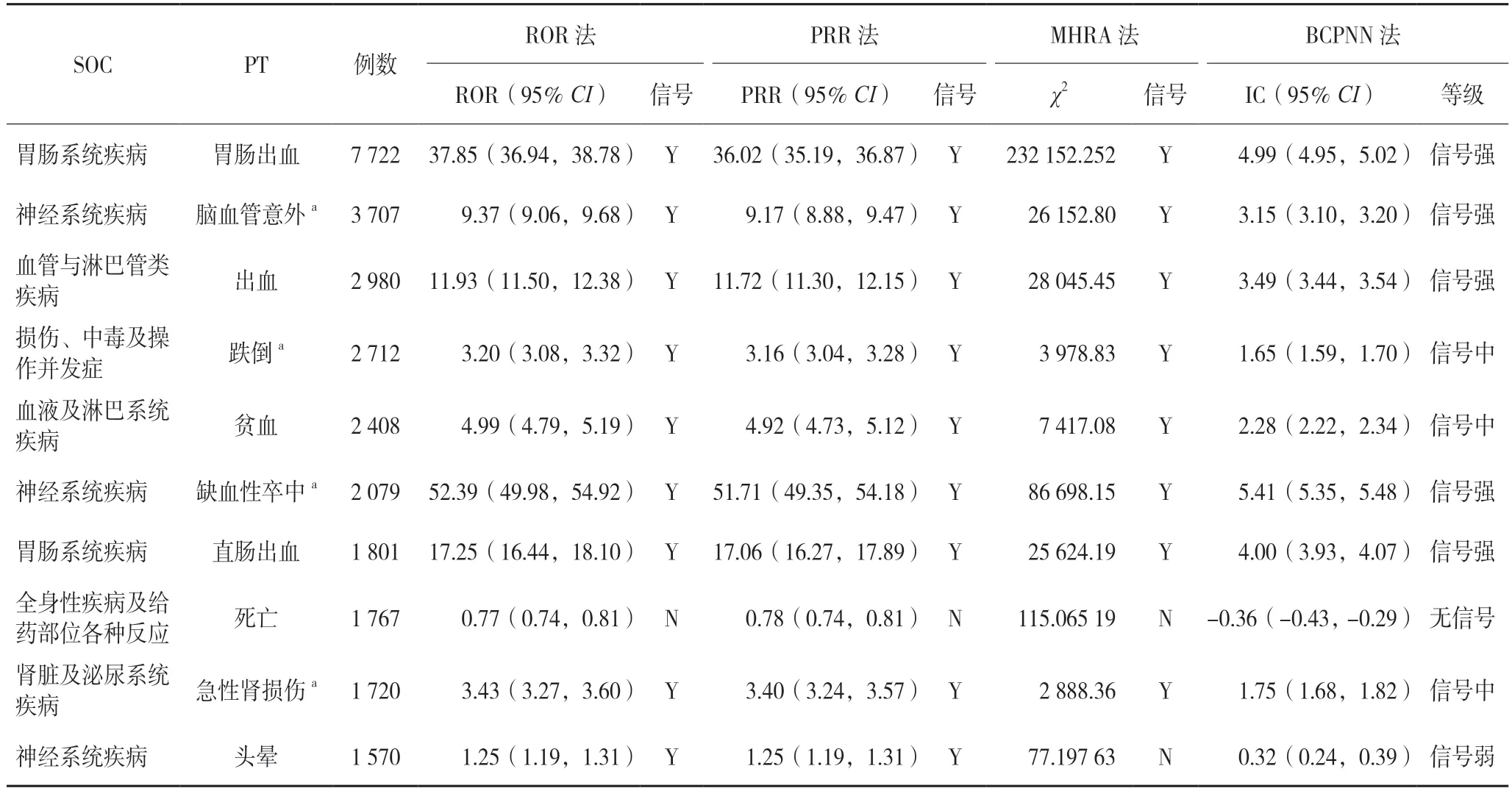
表3 达比加群酯ADR报告的重点信号分布情况(n=155 881)
2.2.1 SOC 从纳入155 881 例达比加群酯ADR 报告中挖掘到783 个信号,映射到27 个系统器官。报告数较高的SOC 分别为胃肠系统疾病(31 735 例),各类神经系统疾病(22 436 例),各类损伤、中毒及操作并发症(13 049 例),全身性疾病及给药部位各种反应(12 865 例),血管与淋巴管类疾病(10 025 例)等;信号数较高的SOC 主要包括胃肠系统疾病(148个信号),各类神经系统疾病(103 个信号),各类损伤、中毒及操作并发症(91 个信号),各类检查(78个信号),血管与淋巴管类疾病(60 个信号)等。
2.2.2 PT 胃肠系统疾病的胃肠出血、各类神经系统疾病的脑血管意外、血管与淋巴管类疾病的出血报告数量最多且均为强信号;报告数量次之的是各类损伤、中毒及操作并发症的跌倒、血液及淋巴系统疾病的贫血,信号强度为中等;而死亡等PT,四种检测方法均提示无信号。其中,脑血管意外、跌倒、缺血性脑卒中、急性肾损伤等均未在达比加群酯药品说明书中记载,尤其值得关注。
2.2.3 出血ADR 达比加群酯报告中出血相关ADR发生比例相对高,出血相关ADR 报道总例数31 669例,占比20.31%,出血相关PT 的总信号数为122,涉及20 个系统器官。出血相关PT 报告数前十位的信号等级均为强信号,主要分布在胃肠系统疾病、血管与淋巴管类疾病和神经系统。其中ADR 报告例数和出血事件中发生率最高的PT 均为胃肠出血,具体结果见表4。
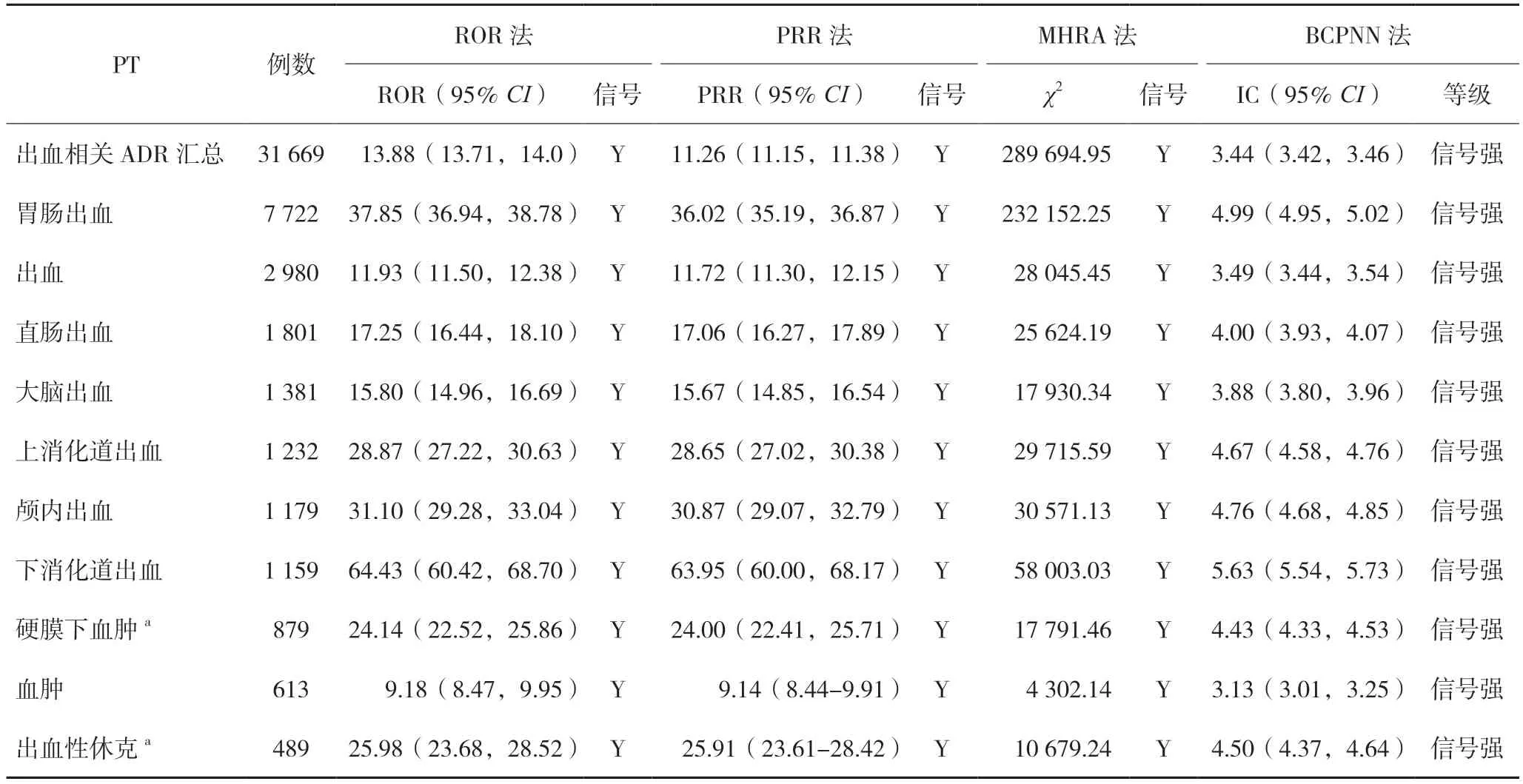
表4 达比加群酯出血相关的重点PT信号分布情况(n=31 669)
3 讨论
3.1 达比加群酯ADR 信号和重点PT 及SOC 结果分析
达比加群酯ADR 中报告数量和信号数量最多的SOC 均为胃肠系统,表明使用中需加强对胃肠系统的监护。在本研究挖掘出的前10 位的PT 中,除出血相关的ADR 外,还出现了脑血管意外、跌倒、急性肾损伤、缺血性卒中等说明书中未收载的ADR 阳性信号,查阅国内达比加群酯不良反应相关文献,未见脑血管意外、跌倒、缺血性卒中和房颤等报道,可能与国内不良反应上报数据较少有关[12-13],其中脑血管意外可能与药物已知不良反应脑出血等存在交叉。达比加群酯致肾功能异常国内有相关报道[12,14],同时有文献表明抗凝药相关性肾病(ARN)是近几年来发现的由过量使用华法林或其他抗凝药物所导致的急性肾损伤,是一种临床常见常被忽视的抗凝药物相关并发症[15],达比加群酯可能以类似华法林的方式诱发肾损伤,还有研究[16]显示,达比加群酯导致急性肾损伤的原因可能是由于其80%的给药剂量由肾脏排出。同时肾损伤对达比加群酯的药动学、药效学和安全性也有重要影响,达比加群酯可在肾功能受损的患者中诱导低血症性低醛固酮血症,从而导致高钾血症[17]。此外还需要注意的是,达比加群酯在临床上用于血栓性疾病的预防和治疗,然而本研究挖掘出脑血管意外、缺血性卒中等ADR,发生率较高且与治疗目的相悖,因此建议临床医生应考虑患者服用达比加群酯后出现这些严重、有害心脑血管事件的可能性。同时本研究结果提示说明书中已有的腹泻、恶心等不良反应与药物之间无强关联性。临床上仍有必要开展大样本、多中心、随机对照、平行、前瞻性试验来验证达比加群酯在实际应用中的安全性。
3.2 达比加群酯出血相关ADR 信号分析
根据药品说明书和相关文献,达比加群酯最常见ADR 为各类出血[3],尤其是胃肠道出血,与本研究结果一致。有研究[18]提示,达比加群酯相对于华法林而言,减少了危及生命的大出血发生率,但其胃肠道出血发生率显著增加。虽然证据显示胃肠道出血危及生命的风险相对较小,但急、慢性胃肠道出血对患者的生活质量有负面影响,应为临床关注的重点。通过深入挖掘,筛选出ADR 信号中所有出血相关的PT 及SOC,排在前三的SOC 分别为胃肠系统、神经系统和血液及淋巴系统。其中说明书中未记载的ADR 有硬膜下血肿和出血性休克,提示使用时不可忽视此类风险。在给予达比加群酯抗凝治疗过程中,血栓栓塞与出血是最大的矛盾,需要把握平衡,使患者获得最大收益。服用达比加群酯后如发生出血事件,应根据患者自身情况和严重程度采取停药、口服活性炭、压迫止血或外科止血、静注依达赛珠单抗(Idarucizumab)等措施[19]。
3.3 本研究的局限性
虽然本研究对达比加群酯的潜在ADR 信号及其强度进行了新的描述,但仍存在局限,包括FAERS 数据库中的ADR 报告数据质量不等,错报、漏报、患者自身因素影响、临床信息的缺失、数据偏倚等都会对结果造成影响,因此需要更多的时间和数据进行验证。同时,不良事件的发生在不同人群中可能存在一定偏差,本研究数据中包含亚洲国家,可为我国人群使用的安全性提供参考依据。
4 小结
目前关于患者使用达比加群酯后安全性研究较多,但大多数数据来自临床试验或案例报道,不能系统地了解相关 ADR 的风险或特征。本研究联合使用ROR、PRR、MHRA 和BCPNN 法挖掘FAERS数据库,利用大数据挖掘信息,更为全面地分析和评价了达比加群酯重要的ADR 信号及其强度。本研究挖掘到的数据提示了该药与胃肠系统、神经系统和血液及淋巴系统不良事件,特别是出血事件的关联性,临床在使用达比加群酯时应加强监测,并做好应对措施。同时本研究挖掘到说明书中未记载且报告例数多、信号较强的ADR,如脑血管意外、跌倒、缺血性卒中、急性肾损伤等;也发现一些说明书中记录但数据分析无信号的ADR,如腹泻、恶心等,为达比加群酯的临床用药安全性提供客观参考依据。

