口炎清颗粒中麦冬掺伪情况考察
占丽琴,胡亮,毕武,丁野,孙辉,李文莉
湖南省药品检验检测研究院,湖南省药品质量评价工程技术研究中心,湖南 长沙 410001
口炎清颗粒处方包括天冬、麦冬、玄参、山银花和甘草5 味药材,功效为滋阴清热、解毒消肿[1]。口炎清颗粒的处方之一为麦冬ophiopogon japonicus(L.f)Ker-Gawl.的干燥块根,主产于浙江省、四川省。山麦冬来源包括湖北麦冬liriope spicata(Thunb.)Lour.var.proliferaY.T.Ma 或短葶山麦冬liriopemuscari(Decne.)Baily 的干燥块根,为麦冬的常见混伪品,主产于湖北省、福建省,市场流通广泛。麦冬与山麦冬均为百合科植物块根,二者性状相近、功效类似[2-7]。另经市场调研,麦冬的生长周期普遍较山麦冬长,市场需求也较山麦冬大,造成麦冬价格高于山麦冬。基于多种因素,一些生产企业存在未严格按照《药品生产质量管理规范》要求进行生产的可能,故本研究对口炎清颗粒中麦冬掺伪情况进行考察。
相关文献[8-14]显示,山麦冬皂苷B 和短亭山麦冬皂苷C 分别为湖北麦冬和短亭山麦冬的专属性成分。本研究以山麦冬皂苷B 作为掺杂湖北麦冬投料的研究指标,短葶山麦冬皂苷C 作为掺杂短葶山麦冬投料的研究指标,建立口炎清颗粒中麦冬掺伪检查方法,结果本次国抽样品68 批均未检出短葶山麦冬皂苷C,59 批次样品检出山麦冬皂苷B 成分。初步研究结果显示口炎清颗粒中麦冬的主要掺伪品为湖北麦冬,故对检出山麦冬皂苷B 的样品展开系统的方法学考察,为该药品安全生产和科学监管提供可靠依据。
1 材料与仪器
仪器:超高效液相色谱仪串联三重四极杆质谱系统(赛默飞TSQ Endura-UltiMate3000);电子分析天平METTLER AE240,METTLER TOLEDO XSE205DU;超声波清洗仪KQ500DE。实验用有机试剂乙醇、甲酸、甲醇均为色谱级,水为怡宝水。对照物质均购自中国食品药品检定研究院,包括山麦冬皂苷B(批号:111907-201804)、短葶山麦冬皂苷C(批号:111908-201102)、麦冬对照药材(批号:121013-201711),山麦冬(湖北麦冬)(批号:121136-201803)。
口炎清颗粒所有样品均来自于2022 年国家药品抽检,总计68 批次。
2 方法与结果
2.1 色谱条件
色谱柱:Welch UHPLC Ultimate LP-C18 色谱柱(2.1 mm×100 mm,1.8 μm);流动相:乙腈(A)-0.1%甲酸(B),梯度洗脱(见表1);流速:0.2 mL/min;进样体积:3 μL;柱温:30 ℃。
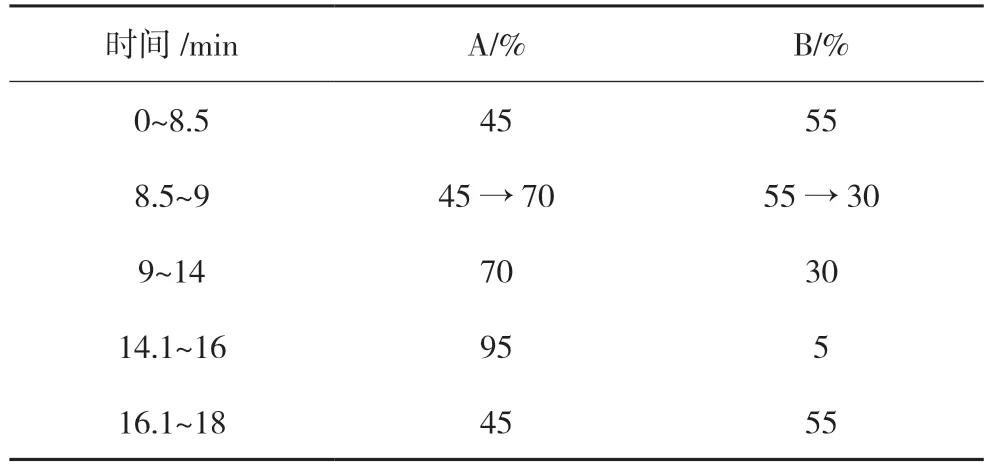
表1 洗脱梯度表
2.2 质谱条件
采用质谱检测仪,ESI+模式,喷雾电压:3 100 V,鞘气:20 ARb,辅助气:10 ARb,离子传输管温度:350 ℃,蒸发温度:300 ℃,扫描方式:MRM。选择质核比(m/z)723.3→269.1 和723.3→251.1 作为山麦冬皂苷B 检测离子对,碰撞能量分别为24 V、27 V。
2.3 溶液的制备
2.3.1 对照品贮备溶液制备 精密称取山麦冬皂苷B对照品12.37 mg 置100 mL 量瓶中,加甲醇溶解并定容至刻度,摇匀,即得(浓度为123.7 µg/mL)。
2.3.2 供试品溶液制备 取样品适量,混匀,研细,取约4.0 g 或1.0 g(无蔗糖),精密称定,置锥形瓶中,精密加入甲醇25 mL,密塞,称定重量,超声处理(功率500 W,频率40 kHz)30 min,取出,放冷,补足减失的重量,滤过,取续滤液,即得。
2.3.3 阴性制剂溶液、阳性制剂溶液及标准制剂溶液的制备 将缺麦冬阴性制剂、含湖北麦冬阳性制剂以及标准制剂,按“2.3.2”项下方法制备。
2.4 方法学考察
2.4.1 专属性试验 分别取缺麦冬阴性制剂溶液、含湖北麦冬阳性制剂溶液、标准制剂溶液及山麦冬皂苷B 对照品溶液按“2.1”和“2.2”项下条件测定。结果缺麦冬阴性制剂溶液、标准制剂溶液及麦冬药材在与山麦冬皂苷B 对照品相应的位置上均未出现色谱峰,湖北麦冬药材和阳性制剂在与山麦冬皂苷B 对照品相应的位置上均出现相应的谱峰。表明口炎清颗粒中的各药味对山麦冬皂苷B 的测定无干扰,专属性较好。结果见图1~6。
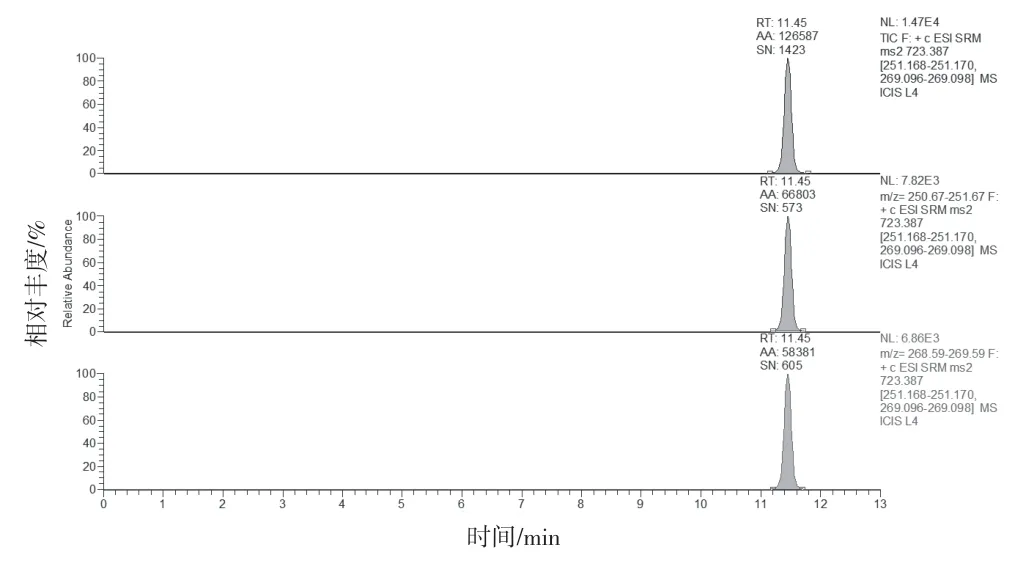
图1 山麦冬皂苷B对照品溶液MRM
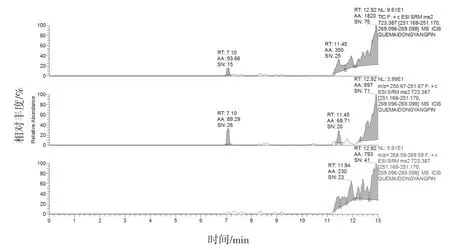
图2 缺麦冬阴性制剂溶液MRM(未检出山麦冬皂苷B)
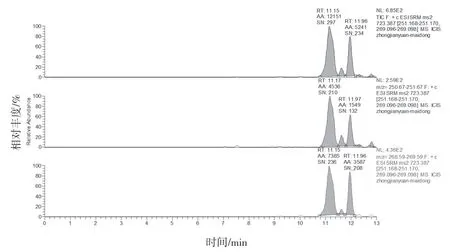
图3 麦冬对照药材溶液MRM(未检出山麦冬皂苷B)
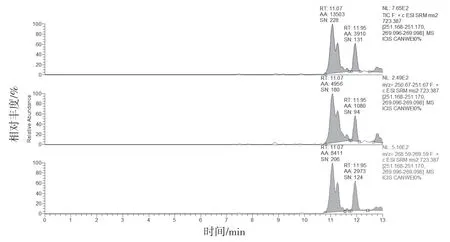
图4 标准制剂溶液MRM(未检出山麦冬皂苷B)
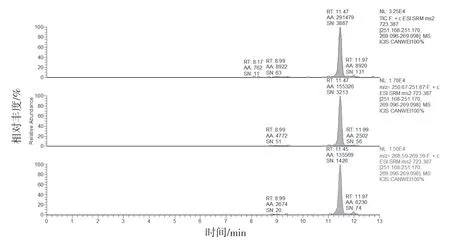
图5 含湖北麦冬阳性制剂溶液MRM(检出山麦冬皂苷B)
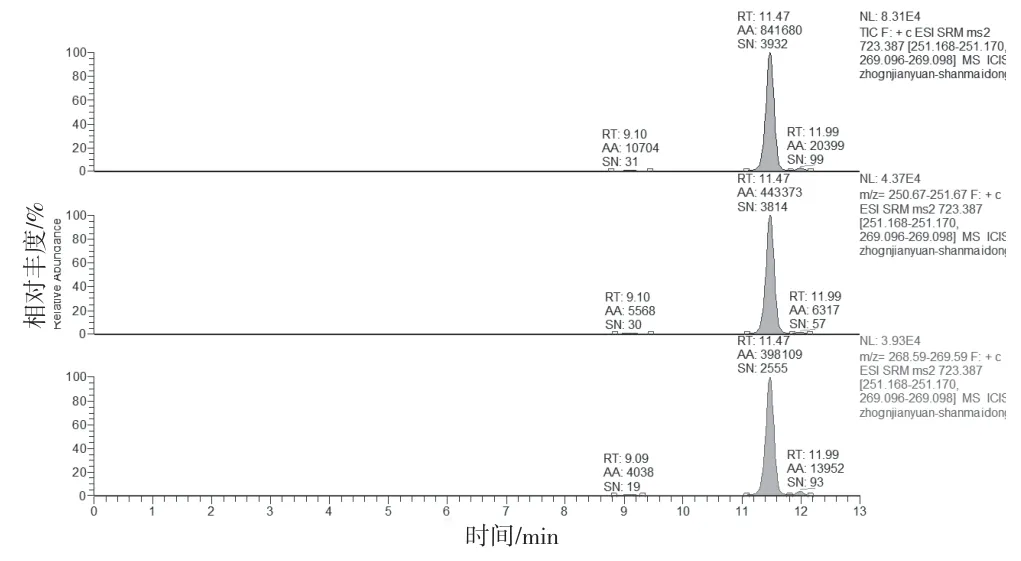
图6 湖北麦冬溶液MRM(检出山麦冬皂苷B)
2.4.2 线性关系 精密量取“2.3.1”项下山麦冬皂苷B 贮备溶液(浓度为123.7 μg/mL)适量,逐级稀释得线性关系对照品溶液①~⑥(浓度分别为7.422 0、1.484 4、0.593 7、0.296 8、0.148 4、0.059 3 μg/mL)。按照“2.1”和“2.2”项下的方法进样测定,分别以峰面积为纵坐标,浓度为横坐标,绘制标准曲线,计算山麦冬皂苷B 的回归方程为y=109 732x+12 299,r=0.999 0,表明浓度在0.059 3~7.422 0 μg/mL 范围内山麦冬皂苷B 具有较好的线性关系。结果见表2。
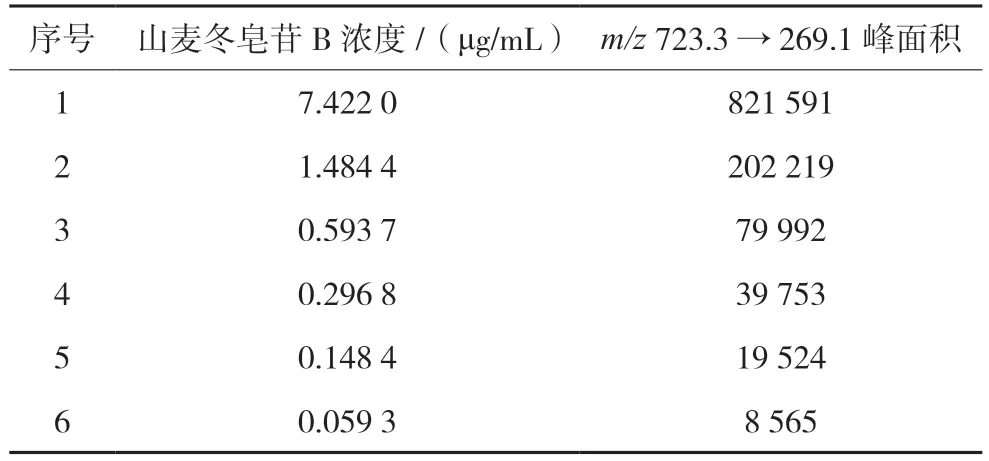
表2 山麦冬皂苷B对照品溶液线性关系考察
2.4.3 重复性试验 取适量口炎清颗粒内容物,研细,取约4.0 g,按“2.3.2”项下方法,制备六份平行样。按“2.1”和“2.2”项下方法进样,测定。结果山麦冬皂苷B 的平均值为11.26 μg/g,RSD 为4.82%,表明该方法具良好的重复性。
2.4.4 精密度试验 取已知山麦冬皂苷B 含量的供试品溶液,按“2.1”和“2.2”项下方法进样测定6 次,测定m/z723.3→269.1 离子流色谱的峰面积,离子色谱峰面积的RSD 为4.20%,说明该仪器具良好的精密度。
2.4.5 稳定性试验 取同一供试品溶液,于制备后0、2、4、8、12、24 h 按“2.1”和“2.2”项下方法进样,测定。结果m/z723.3→269.1 离子色谱峰峰面积RSD 为2.42%,说明供试品溶液24 h 内具较好稳定性。
2.4.6 回收率试验 称取已知山麦冬皂苷B 含量的样品适量,平行操作6 份,按100%加入山麦冬皂苷B 适量,按“2.3.2”项下方法制备回收率供试品溶液。再按“2.1”项下方法进样,测定。结果山麦冬皂苷B 的平均回收率为101.84%,RSD 为1.32%,表明该方法准确度良好。结果见表3。
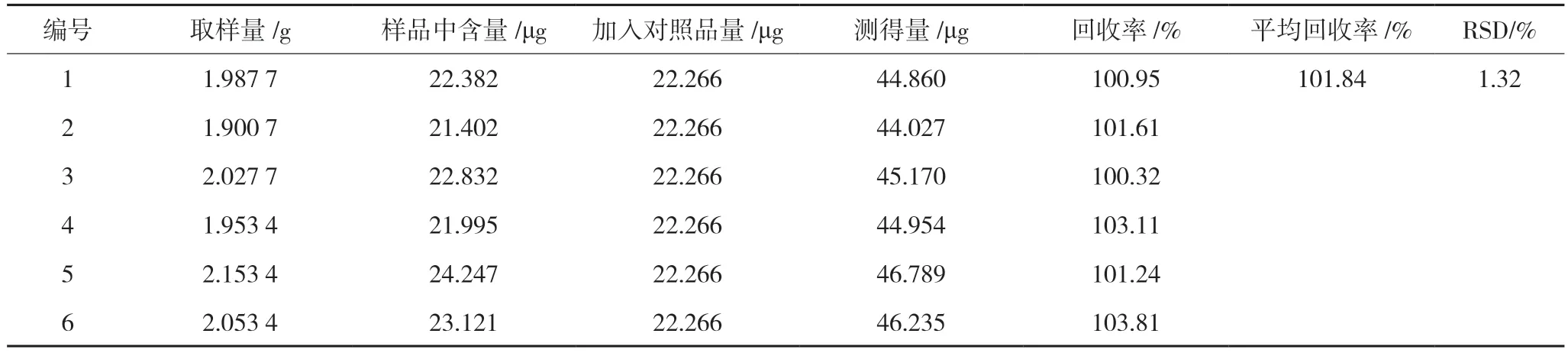
表3 回收率试验结果
2.4.7 检测限试验 以m/z723.3→269.1 作为检测离子进行检测,取线性最低点(浓度0.059 3 μg/mL)进行适量稀释,按信噪比(S/N 约为20)进行折算,山麦冬皂苷B 仪器检测限为0.064 pg,方法检出限为0.000 13 μg/g。
2.4.8 耐用性试验 按上述拟定方法,采用不同品牌的液质联用色谱仪(TSQ Endura、安捷伦1290INfinityⅡ-6470),不同品牌的色谱柱[Welch UHPLC Ultimate LP-C18(2.1 mm×100 mm,1.8 μm)、CAPCELL C18(2.1 mm×100 mm,2 µm)]对同一份口炎清颗粒样品溶液分别进行测定,结果均检出山麦冬皂苷B,表明方法耐用性较好。
2.5 限度拟定
一方面《中国药典》2020 年版规定:“药屑及杂质通常不得过3%”[1],山麦冬(湖北麦冬)与麦冬来源为同属植物,性状相近;另一方面考虑到中药制剂生产转移率及检验成本,本研究将考察山麦冬(湖北麦冬)掺入比例为10%时口炎清颗粒中湖北麦冬的检出情况。
首先,取收集的10 批次山麦冬(湖北麦冬)分别以10%的量掺入麦冬,制成掺伪湖北麦冬10%的麦冬药材。再按照规定的处方量分别取自制掺伪湖北麦冬10%的麦冬、天冬、玄参、山银花、甘草药材按工艺自制湖北麦冬掺伪10%的模拟样品共计10 份。最后,供试品溶液按“2.3.2”项下方法制备,按“2.1”和“2.2”项下方法测定,结果10 份模拟样品溶液中山麦冬皂苷B检出浓度范围为0.077~0.32 μg/mL。暂拟定山麦冬皂苷B 检出浓度≥0.32 μg/mL作为判定样品中检出湖北麦冬的限度。
2.6 样品测定
按拟定的方法对本次国家药品抽检的68 批次口炎清颗粒进样测定,结果59 批次样品检出山麦冬(湖北麦冬)专属性成分山麦冬皂苷B,问题批次占全部批次的86.76%。提示生产企业存在掺山麦冬(湖北麦冬)或使用山麦冬(湖北麦冬)替代麦冬投料的可能。
3 讨论
实验前期,分别对不同的提取溶剂包括80%乙醇、30%甲醇、50%甲醇、80%甲醇、100%甲醇进行考察,对加入溶剂甲醇的不同体积10、25、50 mL 进行考察,结果表明25 mL 甲醇的提取效果较好。对山麦冬皂苷B 进行了正、负离子扫描进行考察,结果显示山麦冬皂苷B 在正离子模式下响应较好。对麦冬掺伪10%湖北麦冬进行考察,结果山麦冬皂苷B 的检出浓度范围较大,分析原因可能与湖北麦冬质量有关,故最后拟定检出限度为浓度的最高值0.32 μg/mL。
本次实验用样品来源于两个不同厂家,结果显示两个厂家生产的口炎清颗粒中山麦冬皂苷B 的检出率分别为96.9%、77.8%,均较高,分析原因可能生产企业质量控制主体意识不强,未严格按照《药品生产质量管理规范》进行生产。
本研究建立口炎清颗粒的麦冬掺伪检查方法,快速、高效,可以作为现行质量标准的补充,为口炎清颗粒的质量控制提供参考。

