黄芩与不同药物配伍后成分含量的变化及其抗皮肤癣菌作用研究
章佩,罗忠,邓冯沂,胡建新,沈成英
1.江西省人民医院(南昌医学院第一附属医院),江西 南昌 330006;2.南昌大学,江西 南昌 330006
皮肤癣菌病是由皮肤癣菌引起的皮肤、毛发、甲板等的浅表真菌感染,其流行地域广,复发率较高,已经成为一个重要的健康问题。据报道[1-2],全球约有20%~25%的人患此病,皮肤癣菌病虽然不危及患者的生命,但是较难治愈而且容易复发和再感染,严重影响患者的生活质量。
中药多成分、多靶点、毒副作用小的优点使其在临床抗真菌治疗中具有独特优势[3-5]。课题组前期观察了黄芩汤对60 余种临床常见真菌的抑制作用,结果显示黄芩汤对红色毛癣菌、须癣毛癣菌等常见临床皮肤癣菌有良好的抑菌活性[6]。黄芩汤始载于汉代张仲景《伤寒论》,由君药黄芩、臣药芍药、佐药炙甘草和使药大枣组成。课题组同时进行了单味药和去该味药的阴性对照抗皮肤癣菌作用研究,结果显示在黄芩汤中,黄芩的抗菌作用最强,缺黄芩的阴性对照汤液抗菌作用很弱。通过研究黄芩汤中不同药物与黄芩配伍对君药黄芩有效成分溶出和抗皮肤癣菌活性的影响,以期为阐明黄芩汤配伍抗皮肤癣菌作用的科学内涵奠定基础。
本研究采用L8(27)正交设计法组方,以高效液相色谱法(HPLC)测定各配伍样品中黄芩苷、汉黄芩苷、黄芩素、汉黄芩素、千层纸素A、千层纸素A 苷6 种黄芩有效成分的含量;以临床常见皮肤癣菌——须癣毛癣菌为例,采用微量稀释法测定黄芩不同配伍组的最小抑菌浓度(MIC 值),比较配伍前后的抗真菌作用,并同时探讨抑菌强度与成分的相关性。
1 材料与仪器
1.1 主要仪器
LC-2010A 高效液相色谱仪(日本岛津公司),XS105DU 梅特勒天平(瑞士Mettler 公司),Multiskan FC 酶标仪(美国赛默飞世尔科技公司),LMQ.C 立式灭菌器(山东新华医疗器械股份有限公司),SPX-25085H-Ⅱ生化培养箱(上海新苗医疗器械制造有限公司),96 孔板(美国康宁公司),移液枪(德国eppendorf 公司),SCIENTZ-10N 冷冻干燥机(宁波新芝生物科技股份有限公司),KQ2200 型超声波清洗器(昆山市超声仪器有限公司)。
1.2 试剂与耗材
黄芩饮片(批号:21111105,产地:山西);白芍饮片(批号:21082604,产地:安徽);炙甘草饮片(批号:21090302,产地:内蒙古);大枣饮片(批号:21082405,产地:山东);以上饮片均购自江西彭氏国药堂饮片有限公司并经江西省人民医院药学部主任药师鉴定,分别为唇形科植物黄芩Scutellaria baicalensisGeorgi.的干燥根,毛茛科植物芍药Paeonia lactifloraPall.的干燥根,豆科植物甘草Glycyrrhiza uralensisFisch.的干燥根和根茎和鼠李科植物枣Ziziphus jujubaMill.的干燥成熟果实。黄芩苷对照品(批号HS81115B2,纯度≥98%),黄芩素对照品(批号HR5717S1,纯度≥98%),汉黄芩苷对照品(批号HR5125S1,纯度≥98%),汉黄芩素对照品(批号HR20925W3,纯度≥98%),千层纸素A(批号HS17116S1,纯度≥98%),千层纸素A 苷(批号HS14413B1,纯度≥98%)均购自宝鸡辰光生物科技有限公司。磷酸(批号20210701,分析纯)购自西陇科学股份有限公司。
2 方法与结果
2.1 黄芩主要成分HPLC 含量测定的方法学研究
2.1.1 色谱条件 以InertSustain C18(250 mm×4.6 mm,5 μm)为色谱柱,以乙腈为流动相A,以0.1%磷酸溶液为流动相B,梯度洗脱(见表1),检测波长为276 nm,流速为1.0 mL/min,柱温为30 ℃。
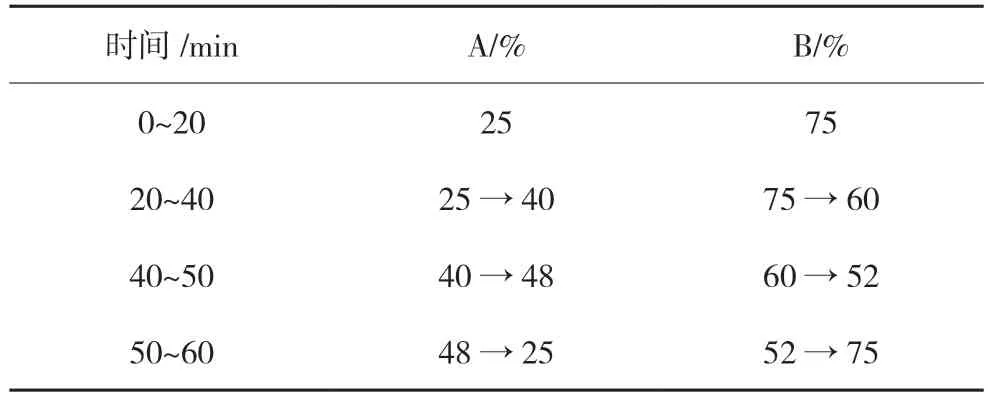
表1 流动相梯度条件
2.1.2 供试品溶液的配制 按照文献方法制备黄芩汤[7],取黄芩、白芍、炙甘草和大枣(去核)按照3∶2∶2∶2 的比例称取适量,加饮片总重量10 倍量水,煎煮1 h,趁热过滤;药渣加8 倍量水煎煮1 h,趁热过滤,合并两次药液,浓缩成每1 mL 含1 g 生药的药液,冷冻干燥后保存。称取黄芩汤冻干粉约10 mg 置10 mL 容量瓶中,加适量甲醇超声溶解后,定容,过0.45 μm 的滤膜,取续滤液,即得黄芩汤供试品溶液。
2.1.3 对照品溶液的配制 取黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、千层纸素A、千层纸素A 苷对照品适量,精密称定,加甲醇溶解并稀释成上述各成分质量浓度分别为226.2 μg/mL、15.0 μg/mL、34.6 μg/mL、3.4 μg/mL、6.9 μg/mL、42.8 μg/mL 的混合对照品母液。将混合对照品母液稀释一倍,作为对照品混合溶液。从混合对照品母液中精密吸取对照品溶液适量,配制一系列浓度梯度的线性关系考察用混合对照品溶液。
2.1.4 缺黄芩阴性样品溶液的配制 取缺黄芩的其余三味药材,按“2.1.2”项下方法制备缺黄芩阴性样品溶液。
2.1.5 专属性试验 精密吸取供试品溶液、对照品混合溶液、缺黄芩的阴性样品溶液各10 μL 进样分析,记录色谱图。结果表明样品中各成分的分离度均较好,对测定成分无干扰,结果见图1。
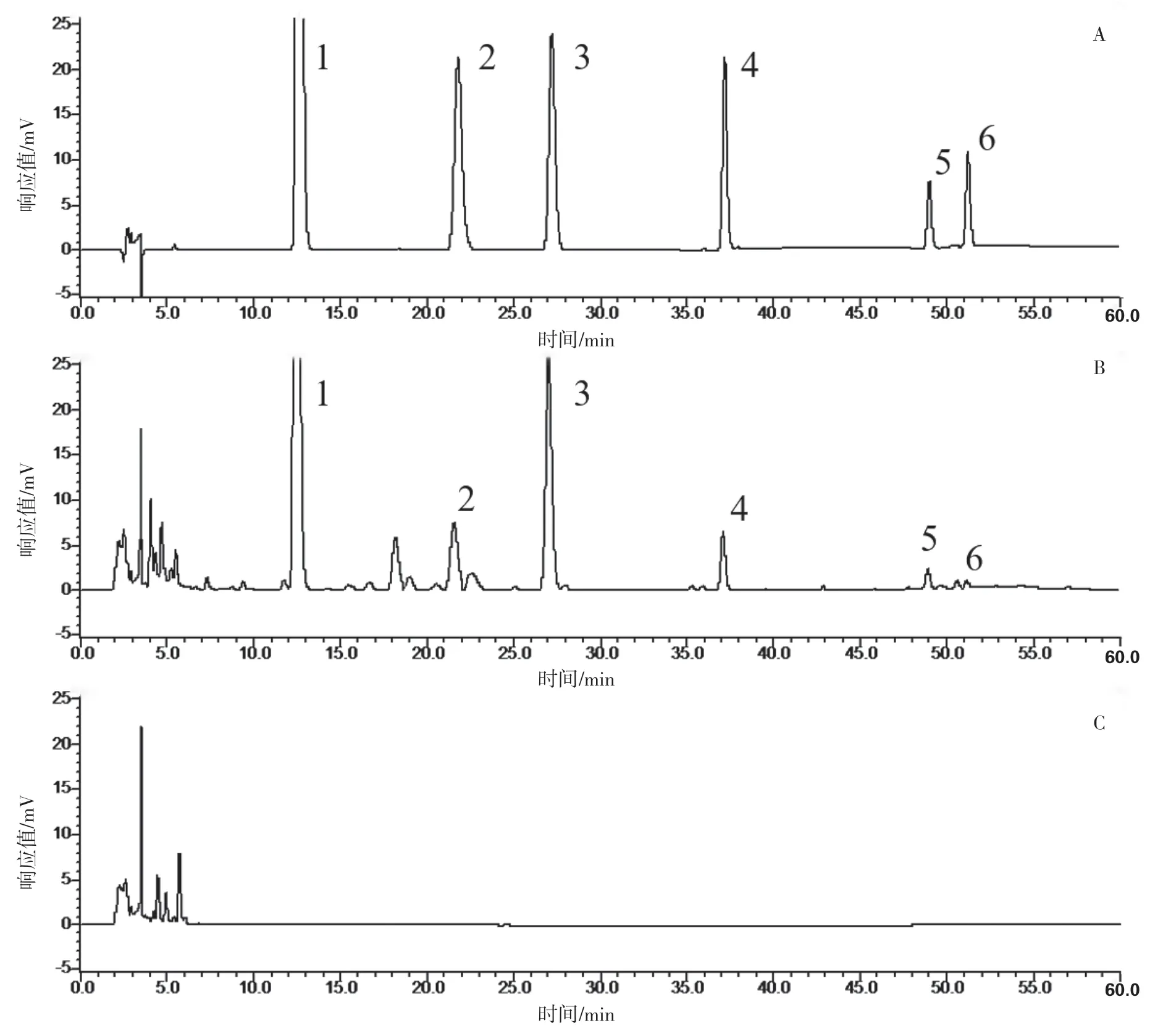
图1 专属性HPLC图:A.对照品溶液;B.供试品溶液;C.阴性溶液
2.1.6 检测限与定量限 取各成分的对照品溶液,依次稀释进样,记录信噪比,结果见表2。
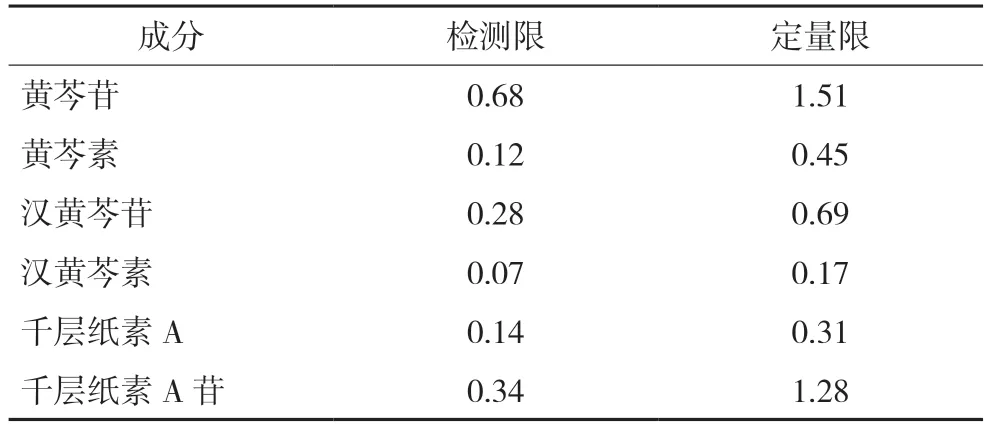
表2 各成分的检测限与定量限 μg/mL
2.1.7 线性关系考察 精密吸取一系列浓度梯度的混合对照品溶液,按照“2.1.1”项下色谱条件进行测定,记录色谱图。以各对照品质量浓度为横坐标(x)、相应色谱峰面积为纵坐标(y)进行回归分析,结果见表3,结果表明各成分在浓度范围内线性关系良好。
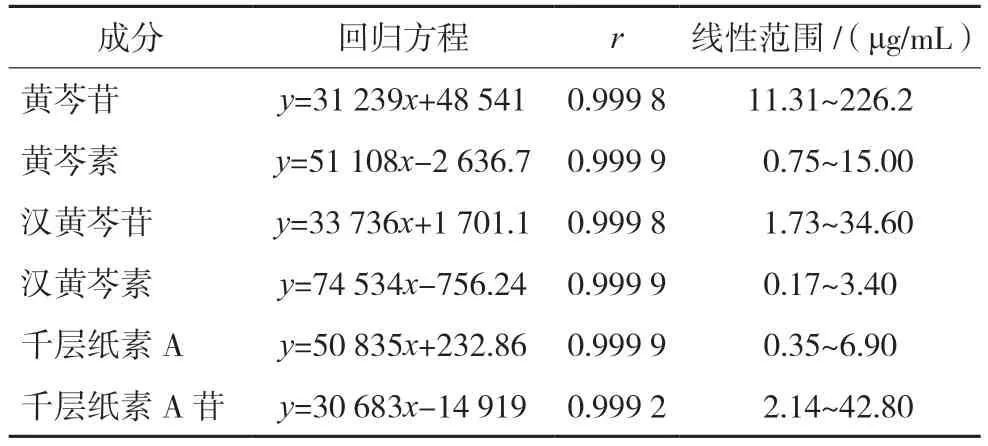
表3 黄芩6种成分回归方程、相关系数及线性范围
2.1.8 精密度试验 精密吸取含黄芩苷113.1 μg/mL、千层纸素A 苷21.4 μg/mL、汉黄芩苷17.3 μg/mL、黄芩素7.5 μg/mL、汉黄芩素 1.7 μg/mL、千层纸素A 3.45 μg/mL 的混合对照品溶液10 μL,连续进样6次,记录各色谱峰峰面积,计算RSD 值。结果显示各成分的RSD 分别为1.25%、1.07%、1.29%、1.16%、1.23%、1.33%,表明仪器精密度良好。
2.1.9 稳定性试验 取同一批黄芩汤按照“2.1.2”项下方法制备供试品溶液,分别于制备后0、4、8、12、24、48 h 精密吸取10 μL 进样测定,记录色谱峰峰面积,结果各成分峰面积RSD 分别为1.77%、1.48%、1.45%、1.30%、1.48%、1.17%,表明样品溶液在48 h 内稳定。
2.1.10 重复性试验 取同一批黄芩汤,按照“2.1.2”项下方法制备供试品溶液6 份,按照“2.1.1”项下色谱条件进行测定,以黄芩生药量计,测得黄芩苷、千层纸素A 苷、汉黄芩苷、黄芩素、汉黄芩素、千层纸素A 的平均含量为97.40 mg/g、8.30 mg/g、21.25 mg/g、2.72 mg/g、0.55 mg/g、0.36 mg/g;质量浓度的RSD 值分别为1.31%、1.60%、1.93%、1.70%、2.30%、2.99%,表明该方法的重复性良好。
2.1.11 加样回收率试验 精密吸取已知含量的黄芩汤6 份,分别加入适量的对照品,按照“2.1.2”项下方法制备6 份供试品溶液,按照“2.1.1”项下方法进样测定,计算6 个成分的平均加样回收率。结果显示黄芩苷、千层纸素A 苷、汉黄芩苷、黄芩素、汉黄芩素、千层纸素A 的平均加样回收率分别为100.02%、100.71%、100.66%、99.88%、99.03%、99.53%,RSD 值分别为0.96%、1.91%、2.38%、3.52%、3.54%、3.62%,表明该方法的准确度良好。
2.2 黄芩汤配伍前后提取物的制备
以白芍(A)、甘草(B)和大枣(C)为考察因素,以用药(1)和不用药(2)为考察水平,并考虑两两交互作用,以L8(27)正交设计组方,因素水平见表4,正交设计见表5。提取方法参照“2.1.2”项下黄芩汤的提取过程,各组样品均浓缩成每1 mL含1 g 生药的药液,冷冻干燥后保存。

表4 因素水平设计
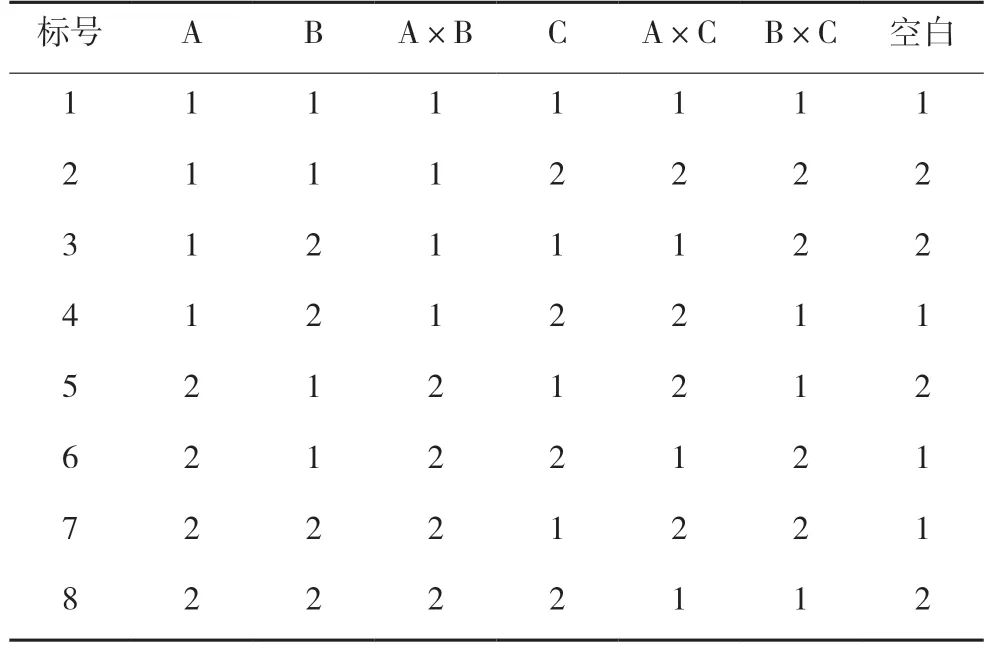
表5 L8(27)正交设计表
2.3 黄芩汤配伍前后黄芩有效成分的含量比较
精密称取“2.2”项下样品各10 mg,置10 mL容量瓶中,加适量甲醇超声溶解后,定容,过0.45 μm 的滤膜,取续滤液,按照“2.1.1”项下色谱条件进行测定,记录色谱峰面积,计算黄芩苷、千层纸素A 苷、汉黄芩苷、黄芩素、汉黄芩素、千层纸素A 的含量。结果见表6。
表6 正交设计结果()
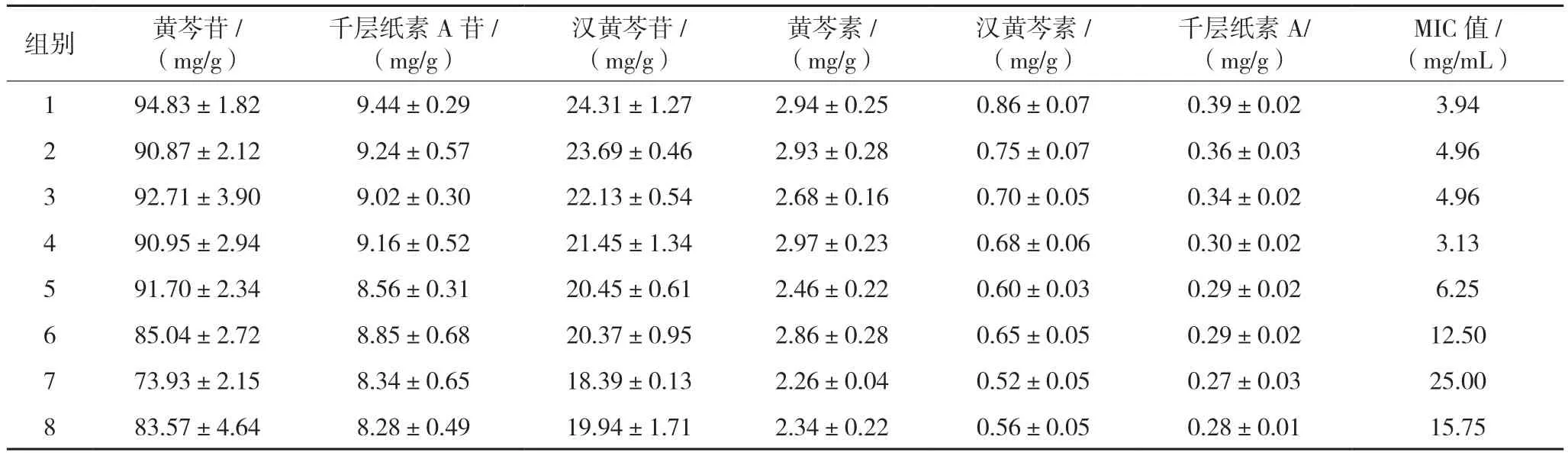
表6 正交设计结果()
注:MIC为最小抑菌浓度以生药量计,以生药量计。
以表6 测定结果进行直观分析,以空白列作为误差项进行方差分析,结果各因素的影响差异无统计学意义。对黄芩苷含量影响中,由于C 和A×C的偏差平方和较小,将这两列和空白列合并为一项做误差的估计值,再经方差分析,见表7。结果显示各组样品中以四味药合煎时黄芩苷含量最高,白芍、甘草和大枣在用药水平时,黄芩苷的含量均大于不用药水平,其对黄芩苷含量的影响程度为:白芍>甘草>大枣,但是只有白芍的作用对黄芩苷含量的影响差异有统计学意义(P<0.05),其余药材及相互作用对黄芩苷的影响均差异无统计学意义。
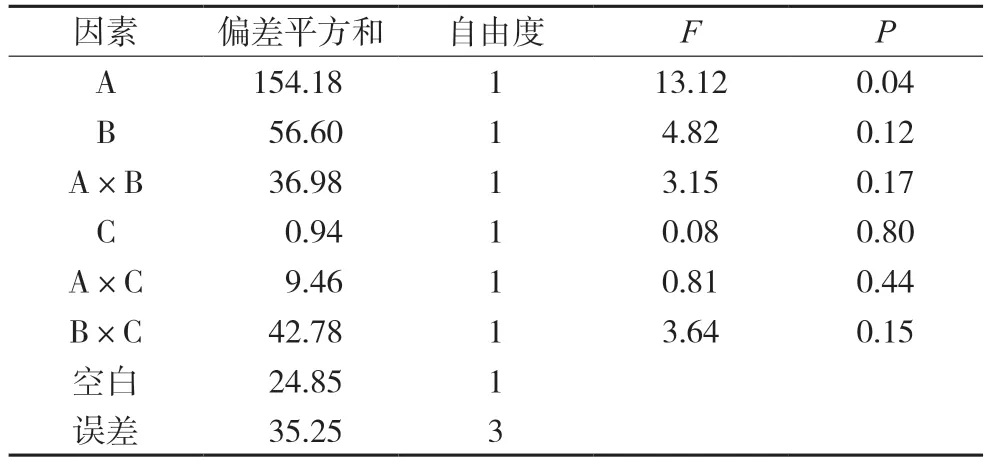
表7 黄芩苷的方差分析表
对其他成分含量的影响分析中,都将较小偏差平方和的两项因素和空白列合并为一项做误差的估计值,再经方差分析,结果分别见表8~12。结果均显示四味药合煎时各成分含量最高,各药味的影响程度为:白芍>甘草>大枣,对于千层纸素A苷、黄芩素而言,只有白芍的影响差异有统计学意义(P<0.05),其余药材及相互作用的影响均差异无统计学意义;对于汉黄芩苷、汉黄芩素、千层纸素A 而言,白芍和甘草的影响差异有统计学意义(P<0.05),其余药材及相互作用的影响均差异无统计学意义。
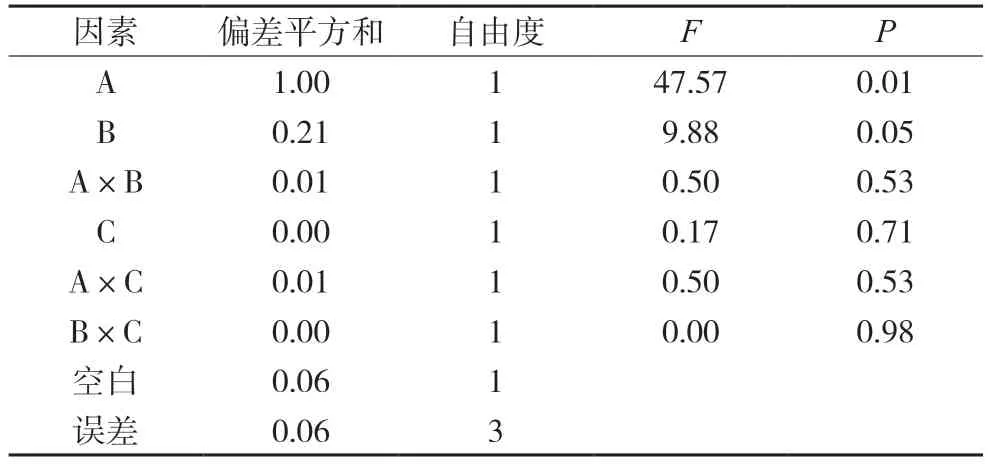
表8 千层纸素A苷的方差分析表
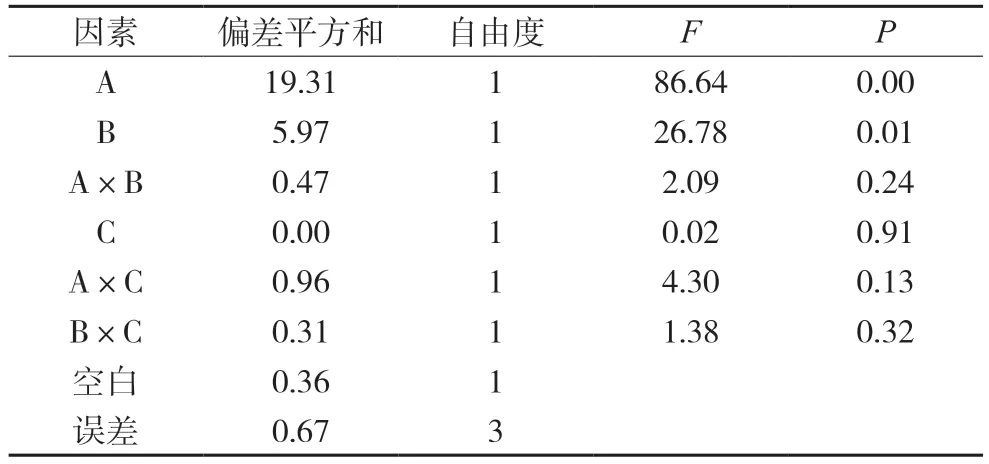
表9 汉黄芩苷的方差分析表
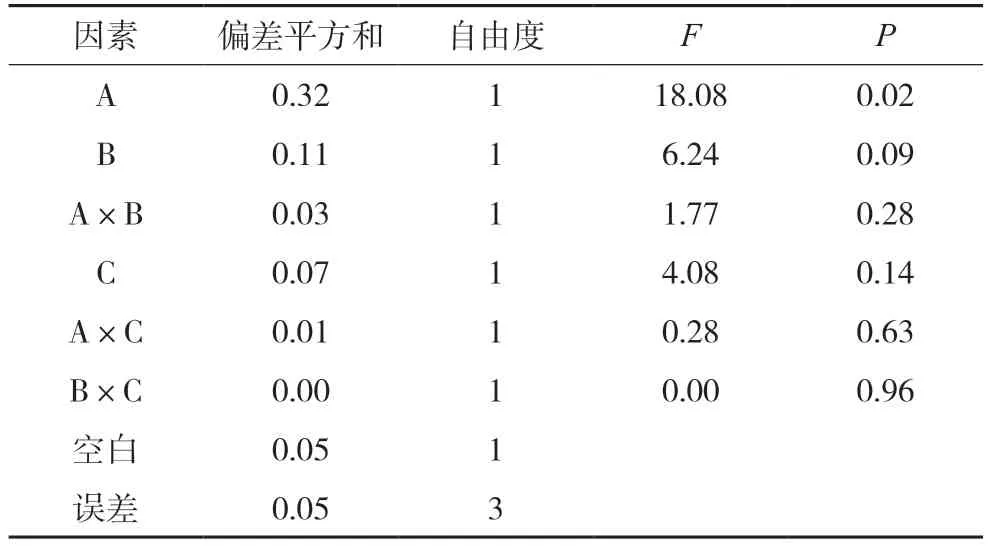
表10 黄芩素的方差分析表
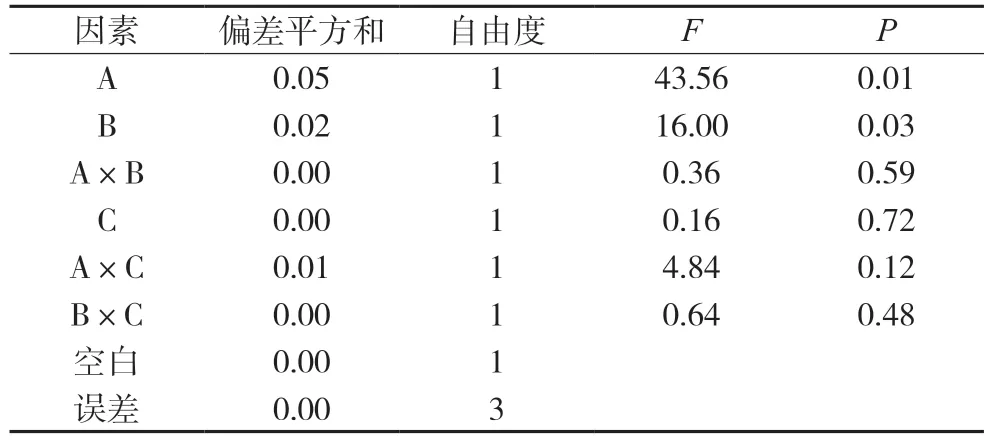
表11 汉黄芩素的方差分析表
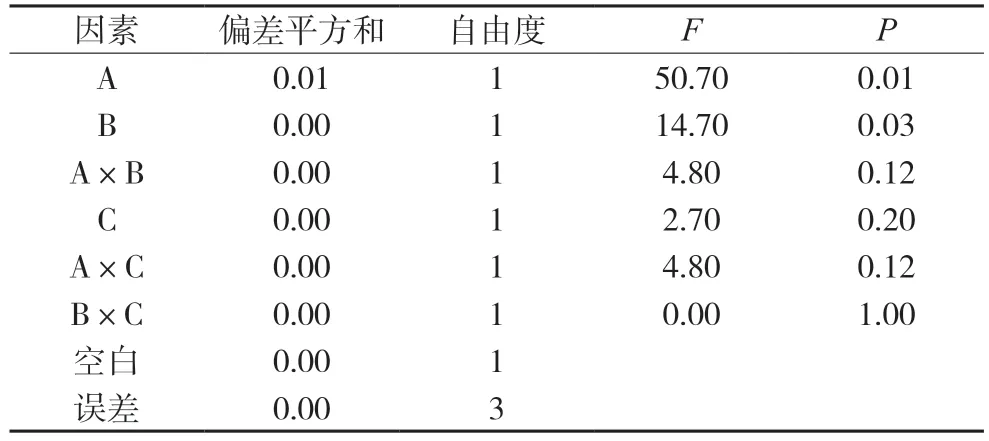
表12 千层纸素A的方差分析表
2.4 黄芩汤配伍前后抗皮肤癣菌作用研究
2.4.1 供试药液的配制 取“2.2”项下8 种冻干样品,以黄芩生药量计,用RPMI 1640 配制成200 mg/mL,储存在-20 ℃以备用。
2.4.2 菌种的活化及接种菌悬液的制备 毛癣菌培养基1 号:取葡萄糖40 g/L,酪蛋白水解物2.5 g/L,磷酸二氢钾1.8 g/L,无水硫酸镁0.1 g/L,琼脂粉18 g/L,用1M 氢氧化钠调节pH 5.8,于121℃蒸汽高压灭菌15 min。须癣毛癣菌在Tr1 培养基上培养传代接种两次,以纯化菌落并增强活力,然后将须癣毛癣菌接种在Tr1 培养基于28 ℃培养7~10 d。参照CLSI的《丝状真菌肉汤稀释抗真菌药敏试验的参考方法》(M61)[8]并适当修改配制须癣毛癣菌菌悬液,采用含1%吐温20 的无菌0.85%生理盐水处理以制成终浓度为(1~5)×104CFU/mL 的菌悬液,备用。
2.4.3 MIC 值的测定 取96 孔板,每个孔中都加入100 μL RPMI 1640 培养基,然后第一孔中加入100 μL 浓度为 200 mg/mL 各样品,用移液枪混匀后吸取100 μL 至第2 孔,依次进行2 倍稀释至第10 孔,以黄芩生药量计,配制的供试药液的终浓度依次为100、50、25、12.5、6.25、3.125、1.563、0.781、0.391、0.196 mg/mL。1~10 孔和12 孔中加入配制好的菌悬液100 μL,第11 孔作为阴性对照,第12 孔作为阳性对照。将配制好的药敏平板置于生化培养箱,于28 ℃培养3~5 d,肉眼观察各试验孔真菌的生长情况,以无真菌生长的最低药物质量浓度即为MIC 终点,每株菌种同时做3 排,结果以几何平均数表示,见表6。
以C、A×C 和空白列合并作为误差项进行方差分析,结果见表13,显示各组样品中以四味药合煎时MIC 值最小;白芍、甘草在用药水平时,MIC 值小于不用药水平;大枣在用药水平时,其MIC 值大于不用药水平。其对MIC 值的影响程度为:白芍>甘草>大枣,白芍的配伍作用对MIC 值的影响差异有统计学意义(P<0.05),其余药材及相互作用对MIC 值的影响均差异无统计学意义。
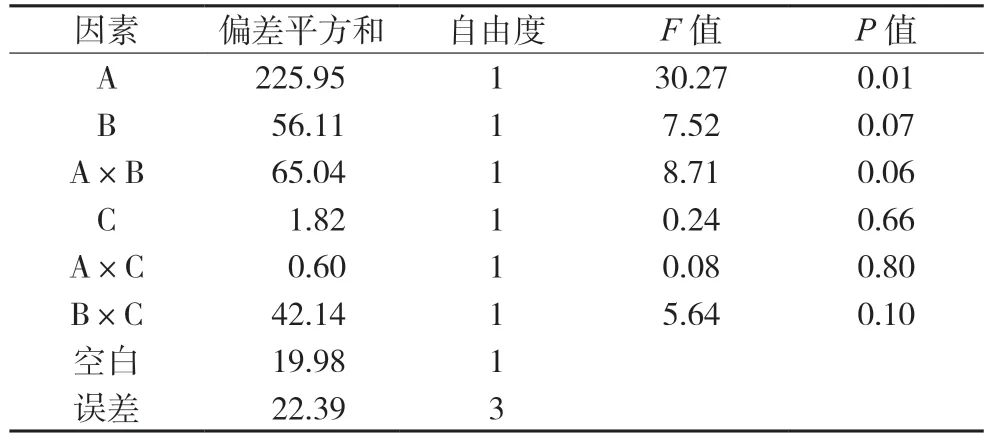
表13 MIC值的方差分析表
2.5 相关性分析
采用SPSS 21.0 软件将各组的抑菌作用与黄芩有效成分含量进行双变量相关分析,结果见表14,显示6 个成分与MIC 值均呈显著负相关(r<-0.7 且P<0.05),说明黄芩汤的抗皮肤癣菌作用强度与君药黄芩的主要成分含量具有显著相关,成分含量越高,抗真菌活性越强。
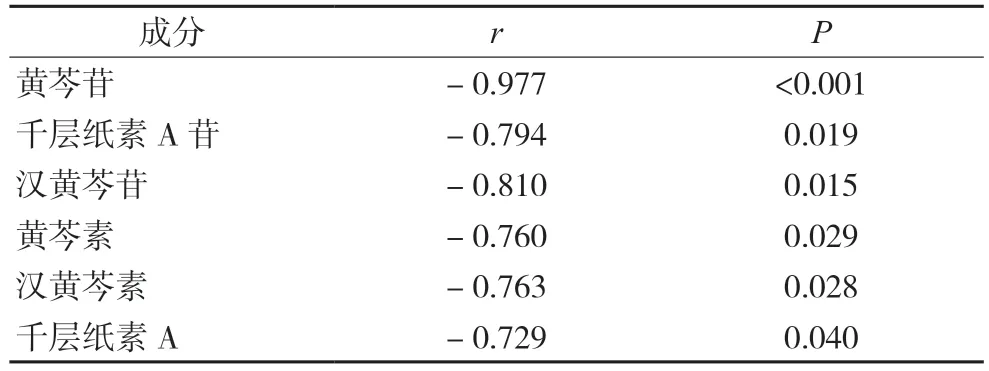
表14 Pearson相关性分析结果
3 讨论
中药复方配伍是中医用药的特色与优势所在,课题组从经典名方中筛选抗真菌药物时发现黄芩汤具有较好的抗皮肤癣菌活性,为研发抗皮肤癣菌病中药新药奠定了基础。同时,通过查阅文献发现,作为黄芩汤的君药,黄芩及其有效成分黄芩苷、黄芩素等均具有良好的抗真菌活性[9-11]。黄芩汤配伍使用是否拥有比单味药黄芩更强的抗菌活性,其潜在机制值得进一步地研究。
中药发挥功效的微观物质基础是中药化学成分,因此,本研究以黄芩有效成分黄芩苷、千层纸素A 苷、汉黄芩苷、黄芩素、汉黄芩素、千层纸素A 为考察指标之一,同时结合抗真菌活性MIC 值为指标,以用不用药物配伍为考察因素和水平,采用正交设计法组方。结果显示黄芩与白芍、甘草和大枣配伍时,黄芩主要成分煎出量有所增加,MIC 值降低;当四味药合煎时,成分的煎出量和MIC 都达到最优值;这说明了黄芩汤配伍能够促进君药黄芩活性成分在合煎液中的溶出,并且发挥了协同增效的作用,一定程度上说明了组方的科学性。
Pearson 相关分析结果显示黄芩汤的抗皮肤癣菌活性与君药黄芩的主要成分含量显著相关,成分含量越高,抗真菌活性越强。黄芩苷、黄芩素等化学成分可能是黄芩汤配伍协同增效的物质基础。由于黄芩苷、千层纸素A 苷、汉黄芩苷、黄芩素、汉黄芩素、千层纸素A 这些黄酮类成分都是水难溶性成分,配伍后水煎液中成分含量均有所增加,可能是白芍、甘草、大枣中含有的两亲性成分对其产生了“增溶、助溶、潜溶”作用以及形成超分子体有关[12-16]。

