甘草酸介导miRNAs对大鼠酒精性肝损伤的保护作用
从美丽,马依热·努尔买卖提,周 蓓,陈瑞花,王 忠,朱虎虎,赵效国
酒精性肝损伤(alcoholic liver disease,ALD)又称酒精性肝病,已成为一个全球性的健康问题[1]。酗酒是引起酒精性肝损伤的主要原因,长期大量饮酒会引起脂肪变性、脂肪性肝炎、肝硬化及终末期肝细胞癌[2]。甘草酸(glycyrrhizic acid,GL)是甘草的主要活性成分,具有保肝、抗氧化、抗炎、抗病毒、免疫调节和抗肿瘤作用,能增强肝脏的解毒功能,减轻肝脏损伤等药理作用,在预防和治疗酒精性肝病中已被应用[3]。然而,甘草酸治疗酒精性肝损伤的分子机制及作用靶点仍有待阐明,该研究利用miRNA芯片技术检测甘草酸在治疗大鼠酒精性肝损伤过程中miRNA表达变化,探讨其可能的作用机制和潜在的作用靶点。
1 材料与方法
1.1 动物和试剂健康SPF级雄性SD大鼠45只,体质量180~220 g,新疆医科大学实验动物中心提供,合格证号:SCXK(新)2018-0002。在新疆医科大学屏障环境实验室中完成,合格证号:SYXK(新)2018-0003。56°牛栏山二锅头购于北京顺鑫农业股份有限公司(批号:20160430);甘草酸购于上海麦克林生化科技有限公司。miRNeasy Mini Kit(货号:271004)购于德国QIAGEN公司。miRcute Plus miRNA First-Strand cDNA Kit(货号:KR211)购于天根生化科技(北京)有限公司;ChamQ Universal SYBR qPCR Master Mix(货号:Q712-02)购于南京诺唯赞生物技术股份有限公司。
1.2 模型制备将45只SD大鼠随机分成甘草酸组、模型组和对照组,模型组每只大鼠按10 ml/(kg·d)的剂量白酒灌胃;甘草酸组在灌胃白酒的同时,每只按11.75 mg/(kg·d)的剂量,给予甘草酸灌胃;对照组每天给予同等剂量的蒸馏水灌胃。持续灌胃8周后,所有大鼠禁食12 h,剖取肝脏,放入液氮中保存。
1.3 血清天冬氨酸氨基转移酶(aspartate aminotransferase,AST)及丙氨酸氨基转移酶(alanine aminotransferase,ALT)测定使用兽用全自动生化分析仪(型号:BS-240VET,深圳迈瑞生物医疗电子股份有限公司),测定血清AST和ALT水平。
1.4 肝脏miRNA的提取取30 mg肝脏组织使用miRNeasy Mini Kit提取miRNA,抽提所得miRNA使用NanoDrop ND-2000分光光度计进行miRNA定量,并使用Agilent Bioanalyzer 2100进行miRNA质量检测。miRNA质控标准为RIN >7且28S/18S >0.7。
1.5 芯片实验采用Agilent Rat miRNA (8×15 K) V21.0芯片(design ID: 070154)(美国安捷伦公司)检测甘草酸组和模型组大鼠肝脏中miRNA表达。对样本中的miRNA分子进行荧光标记,在滚动杂交炉中进行芯片杂交,杂交完成后在洗缸中洗片。
1.6 GO注释和KEGG通路分析利用基因本体(gene ontology,GO)数据库(https://www.geneonto logy.org)对差异miRNA靶基因进行GO分类注释,包括生物学过程、细胞组分、分子功能;利用KEGG Pathway(Kyoto Encyclopedia of genes and genomes)数据库对差异miRNA靶基因进行信号通路分析。GO注释及KEGG通路分析均以P<0.05作为显著性富集标准。
1.7 差异miRNA-mRNA-Pathway调控网络构建使用miRWalk预测软件对差异miRNA进行靶基因预测,结合能大于等于28为筛选条件,之后将靶基因导入String数据库计算蛋白质之间的互作关系,置信度≥0.4,degree大于1为筛选条件;同时联合KEGG Pathway富集结果及String计算结果导入Cytoscape软件中进行网络可视化。
1.8 Real-time PCR实验以U6为内参对挑选的差异miRNA进行实时荧光定量PCR实验,根据miRNA序列设计特异性引物,引物由生工生物工程(上海)股份有限公司合成;使用miRcute Plus miRNA First-Strand cDNA Kit试剂盒将RNA反转录成cDNA;50 μl反应体系中加入上下游引物(10 μmol/L)各2 μl,ChamQ Universal SYBR qPCR Master Mix 25 μl,cDNA 5 μl,补水至50 μl。反应条件为:95 ℃、5 min;95 ℃、15 s,60 ℃、1 min,共40个循环。采用ΔΔCt法计算基因的相对表达量。
1.9 芯片数据分析芯片结果采用Agilent Microarray Scanner进行扫描,用Feature Extraction software 11.5读取原始数据,质控合格的数据采用R包Quantile算法进行归一化处理。采用t检验分析数据,通过P值和foldchange值对结果进行差异筛选和统计,本研究将P<0.05、foldchange≥1.5设定为显著差异表达的阈值。
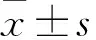
2 结果
2.1 甘草酸对大鼠酒精性肝损伤的影响大鼠连续灌胃乙醇后会导致肝脏损伤、脂肪变性,主要表现为血清AST和ALT水平升高,差异有统计学意义(t=11.366,P<0.05;t=7.784,P<0.05);甘草酸可改善乙醇引起的血清AST和ALT升高,差异有统计学意义(t=7.526,P<0.05;t=6.448,P<0.05)。见图1。HE染色后,正常组肝脏结构清晰,边界清楚;模型组有明显的肝细胞脂肪变性,部分肝细胞肿胀、变性坏死,有少量炎性细胞浸润,细胞核固缩;甘草酸组病理改变明显减少,部分损伤细胞得到修复,肝脏组织结构与正常组比较无明显差异。见图2。提示本研究造模成功,且甘草酸保护效果明显,可用于miRNA基因芯片分析。
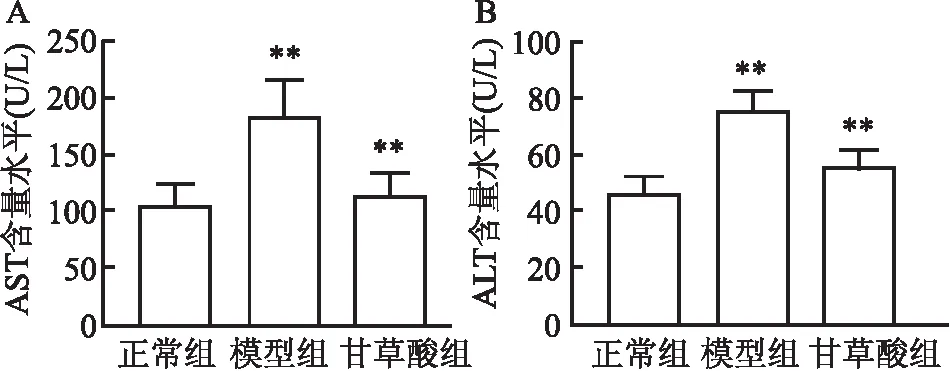
图1 甘草酸对大鼠血清AST和ALT水平的影响A:血清AST水平;B:血清ALT水平;与正常组比较:**P<0.01
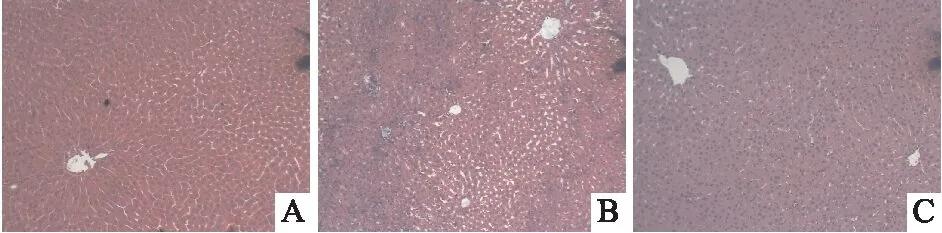
图2 各组大鼠肝脏组织形态 HE染色 ×100A:正常组;B:模型组;C:甘草酸组
2.2 差异表达miRNA分析以P<0.05,foldchange≥1.5为差异筛选标准,对甘草酸组和模型组间差异表达miRNA进行筛选,芯片分析结果显示,甘草酸组显著差异表达miRNA有13个,其中表达上调的有10个,下调的有3个,上调的miR-295-5p、miR-292-5p、miR-190b-5p和miR-291b,下调的miR-107-3p、miR-181b-1-3p差异较为显著。见表1。图3展示了甘草酸组与模型组之间差异表达miRNA聚类图。
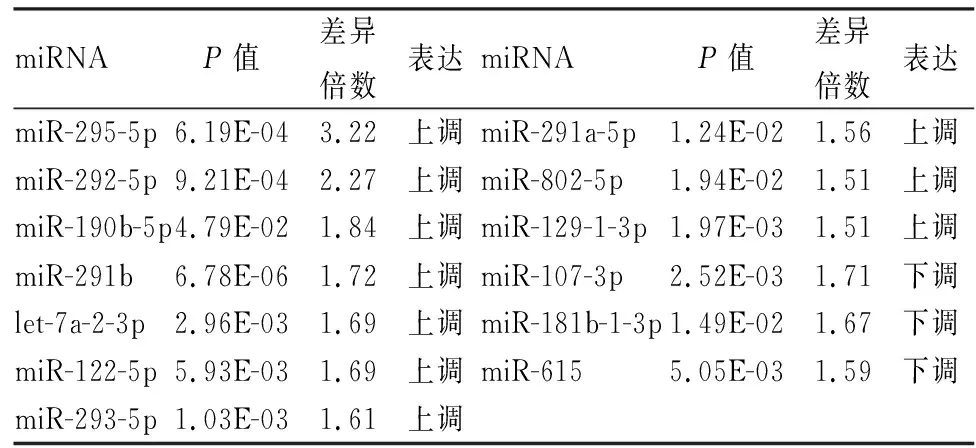
表1 差异表达miRNA信息表

图3 甘草酸组与模型组差异miRNA的聚类图M_1、M_2、M_3: 模型组;G_3、G_1、G_2: 甘草酸组
2.3 差异miRNA GO富集分析使用miRWalk对差异miRNA进行靶基因预测,结合能≥28的靶基因共有913个。为更好地了解差异miRNA可能参与的生物学功能,对这些靶基因进行GO富集分析。结果显示差异表达miRNA主要与细胞黏附、抗氧化活性、代谢过程、生物过程调控、细胞杀伤、免疫系统等功能相关。图4展示了差异miRNA靶基因参与的GO功能。
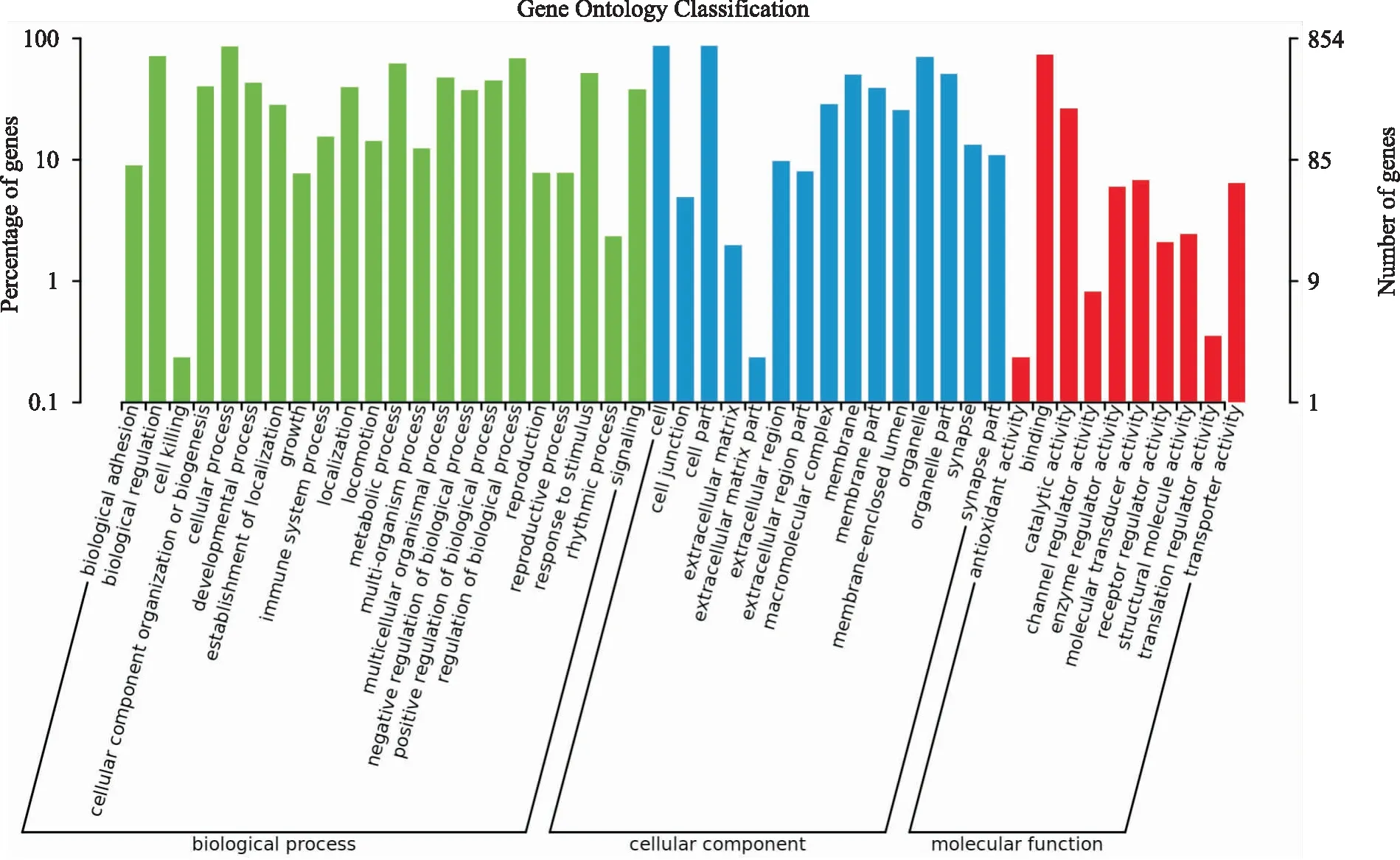
图4 差异miRNA参与的GO条目
2.4 差异miRNA Pathway富集分析为进一步探讨甘草酸在治疗酒精性肝损伤病变过程中所涉及的信号通路,对差异miRNA靶基因进行了KEGG Pathway富集分析。结果显示,以P<0.05为显著标准,共有108个信号通路被显著富集,主要涉及MAPK信号通路、mTOR信号通路、Ras信号通路、Hippo信号通路、PI3K-Akt信号通路、wnt信号通路、FoxO信号通路、细胞凋亡、癌症等信号通路。图5列出了差异miRNA靶基因参与的部分信号通路。
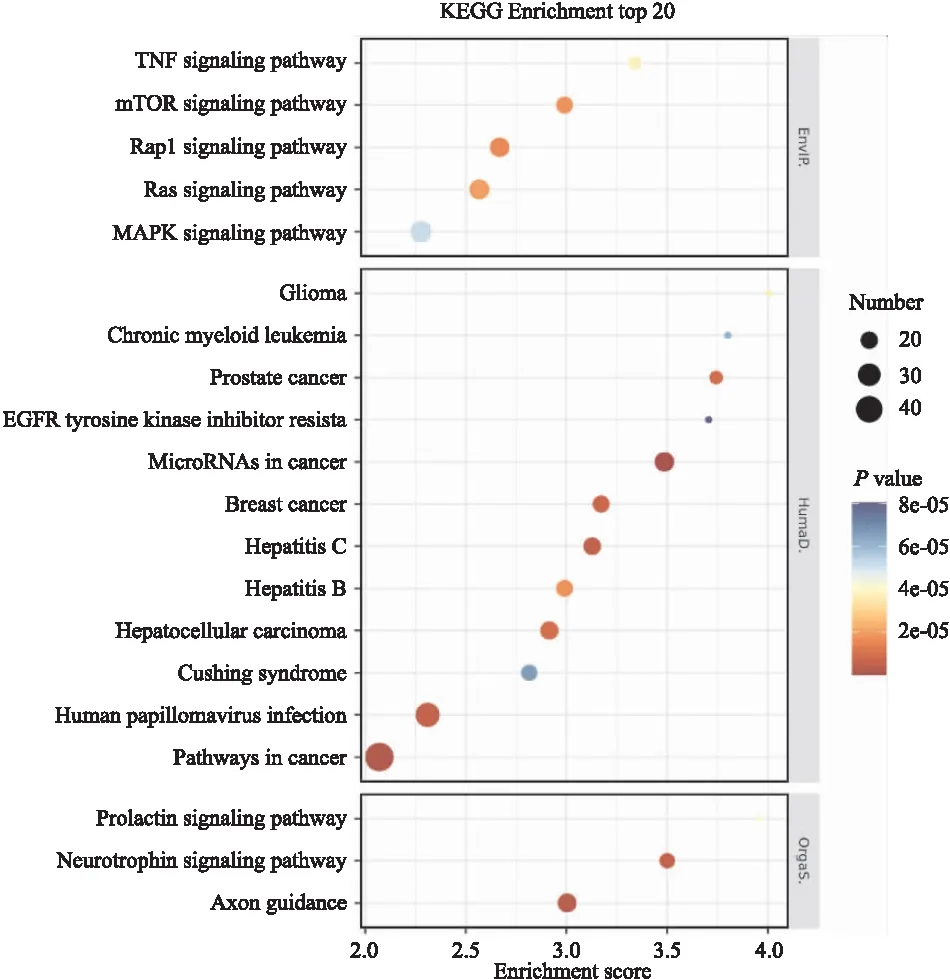
图5 差异miRNA参与的部分信号通路
2.5 差异miRNA-mRNA-Pathway网络构建通过String数据库在线分析差异miRNA靶基因编码蛋白质间的相互作用关系,同时联合KEGG Pathway富集分析结果进行关联分析,结果显示:有12个miRNA与肝损伤相关通路有关联,见图6。从图中可以看出:miR-615、miR-107-3p、miR-292-5p位于网络中心枢纽,为甘草酸治疗酒精性肝损伤的关键miRNA;同时,MAPK信号通路、mTOR信号通路、PI3K-Akt信号通路、Ras信号通路、Hippo信号通路、凋亡信号通路为关键信号通路,参与多个miRNA及相关靶基因的调控。

图6 差异miRNA-mRNA-Pathway调控网络
2.6 荧光定量PCR分析选取4个miRNA,其中上调miRNA 2个,为miR-295-5p、miR-292-5p;下调miRNA 2个,分别为miR-107-3p、miR-615,以U6为内参,对其进行荧光定量PCR验证分析。qPCR结果显示以上4个miRNA在甘草酸组与模型组间表达变化模式与miRNA芯片结果一致(图7),表明该研究利用miRNA芯片检测获得的差异miRNA结果是准确可信的。

图7 差异miRNA的qRT-PCR结果
3 讨论
ALD仍然是全球发病和死亡的主要原因,更是我国严重的健康问题。甘草酸具有抗炎、抗氧化、免疫调节、抗病毒和抗肿瘤作用,同时具有心脏包含和神经保护作用,在治疗许多疾病方面具有巨大的应用潜力[4];已被应用于肝病、皮肤炎症性疾病、淋巴样恶性肿瘤、新冠病毒等疾病治疗中[5-7]。尽管甘草酸已被作为预防和治疗ALD的替代方案,但具体的分子机制及作用靶点并不是很清楚。本研究通过检测甘草酸组和模型组肝脏miRNAs变化,探讨miRNA在甘草酸治疗酒精性肝损伤过程中发挥的作用及调控的通路,了解甘草酸作用的具体分子机制和靶点。
miRNA是一类非编码单链小RNA,可以通过促进靶基因降解或抑制翻译调控靶基因表达[8]。miRNA几乎参与了人类所有的生理和病理过程,如细胞分化和增殖、代谢、炎症、信号转导、免疫、肿瘤发生等;miRNA越来越被认为是各种疾病发病机制的关键分子,并且是疾病诊断或治疗的潜在生物标志物[9];但miRNA在甘草酸治疗大鼠酒精性肝损伤过程的作用机制并不明确。为进一步明确甘草酸在治疗大鼠酒精性肝损伤过程中miRNA的潜在作用机制及作用靶点,通过甘草酸灌胃治疗酒精性肝损伤,并使用miRNA芯片对肝组织检测分析,发现甘草酸组较模型组存在13个差异miRNA,说明miRNA在甘草酸治疗大鼠酒精性肝损伤过程中有着重要作用,是甘草酸引起的多个miRNA异常表达或失活的复杂生物学过程。
差异表达miRNA中的miR-107已证实在ALD患者肝脏中miR-107表达增加,但在健康肝脏或病毒性肝炎受试者中却没有增加[10];在甘草酸组中miR-107表达下降,提示甘草酸可使miR-107表达恢复,进而保护肝脏损伤。乙醇和LPS可以使let-7表达下调进而激活肝星状细胞,而肝星状细胞在肝纤维化发展中起着重要作用,该研究表明甘草酸可以使let-7表达上调。miR-181-3p通过调控通过TLR4-NF-κB途径的信号传导,增加脂多糖敏感性,进而调控酒精对小鼠的肝损伤[11]。miR-122也已经被证实与酒精性肝损伤、肝纤维化的进展有着密切联系[12]。miR-291b可以通过调控靶标Tollip抑制NF-κB信号通路,导致更多的肝脏炎症[13]。miR-615已被证实在肝癌、恶性胶质瘤、淋巴瘤等多种肿瘤组织找那个异常表达,与肿瘤细胞的增殖、迁移、侵袭等存在密切关系[14]。这些miRNA在甘草酸治疗酒精性肝损伤过程发生变化,说明他们在甘草酸治疗酒精性肝损伤过程中发挥着重要作用。
GO富集分析显示,差异miRNA主要与细胞黏附、抗氧化活性、代谢过程、生物过程调控、细胞杀伤、免疫系统等功能相关。乙醇可以增加活性氧的产生和脂质过氧化,同时增加肝细胞的氧化应激,并诱导细胞凋亡,在ALD发病和发展中起着重要作用[15];研究提示甘草酸和这些生物功能相关。甘草酸治疗酒精性肝损伤的过程涉及复杂的基因调控网络的改变,本研究使用了蛋白互作网络结合KEGG信号通路联合分析甘草酸在治疗肝损伤过程中miRNA调控网络的变化,更加清晰展示miRNA-靶基因-信号通路之间的调控关系及程度。从差异miRNA中筛选出了miR-615、miR-107-3p、miR-292-5p关键节点miRNA,以及MAPK信号通路、mTOR信号通路、PI3K-Akt信号通路、Ras关键信号通路,提示甘草酸可能是通过这几个关键miRNA和信号通路调控下游目标分子进而减轻肝脏损伤。
该研究探讨了甘草酸在治疗大鼠酒精性肝损伤过程中miRNA表达谱的变化,以及关键miRNA与信号通路的筛选,为ALD的靶向治疗提供重要的理论依据。研究提示miR-615、miR-107-3p、miR-292-5p可通过MAPK信号通路、mTOR信号通路、PI3K-Akt信号通路、Ras等信号通路调控下游靶标进而减轻酒精性肝损伤,但具体的调控机制仍需进一步实验验证。

