实验性血小板微粒对葡聚糖硫酸钠结肠炎小鼠肠黏膜通透性的影响
杨 彬,李会会,张路遥,刘秋圆,王迪迪,胡 静,韩 玮,刘晓昌,梅 俏
炎症性肠病(inflammatory bowel diseases, IBD)是一种病因和发病机制尚未完全明确的消化道慢性非特异炎症性疾病,遗传、环境、感染和免疫等多因素相互作用引起的肠道黏膜免疫异常是IBD发病的重要环节。一般认为,病原相关分子模式和损伤相关分子模式(damage associated molecular pattern, DAMP)是致病因素激发肠道免疫炎症损伤的重要途径[1]。血小板微粒(platelet microparticles,PMPs)能够表达多种DAMP信号分子、参与机体的炎症免疫反应。多项研究[2-4]表明,IBD患者外周血PMPs水平显著升高且与疾病活动程度正相关。IBD患者损伤的肠道组织局部可见大量中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)形成[5],而抑制NETs形成可以有效减轻结肠炎小鼠的结肠炎症病变,表明NETs在肠黏膜损伤机制中发挥重要作用[6]。IBD患者高表达的PMPs可通过诱导NETs形成参与引发高凝状态和血栓形成[7],而系统性硬化症相关研究中,血小板可通过释放含有HMGB1的PMPs途径激活中性粒细胞促进NETs的形成,进而促进疾病进展[8]。但在IBD中,PMPs是否通过诱导NETs的形成促进肠道炎症以及NETs对肠黏膜通透性的作用尚未见报道。该研究通过对DSS结肠炎小鼠腹腔注射PMPs,观察NETs的形成情况和结肠炎症及黏膜通透性的变化,以探讨PMPs作用于IBD结肠黏膜的可能机制,为IBD的病理生理机制研究提供实验依据。
1 材料与方法
1.1 实验动物选取6~8周龄、体质量20.0 g±2.0 g的雄性C57BL/6小鼠,购自安徽省动物中心,将所有动物饲养于安徽医科大学动物实验中心SPF动物房,保持恒温恒湿、12 h/12 h光暗周期环境。
1.2 主要试剂和仪器葡聚糖硫酸钠(dextran sodium sulfate,DSS)、异硫氰酸荧光素-葡聚糖(fluorescein isothiocyanate dextran,FITC-D)和Ⅰ型胶原购自美国Sigma公司;髓过氧化物酶(myeloperoxidase,MPO)、中性粒细胞弹性蛋白酶(neutrophil elastase,NE)、组蛋白H3(citH3)、白介素(interleukin,IL)-1β、IL-10和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒购自武汉新启迪生物科技有限公司;BCA法微量蛋白检测试剂盒购自南京建成生物工程研究所;枸橼酸盐缓冲液、EDTA溶液和改良型台氏液(modified Tyrode′s buffer, MTB)为实验室自行配制。MQX200酶标仪购自美国Biotek公司,透射电子显微镜购自日本日立公司。
1.3 PMPs悬液制备采集IBD患者清晨肘静脉血5 ml,枸橼酸钠管抗凝。样本立即2 000 r/min离心5 min,收集上层富血小板血浆,进一步将富血小板血浆4 000 r/min离心5 min得到血小板沉淀,经枸橼酸盐缓冲液洗涤后重悬于MTB中。调整血小板悬液浓度为3×108/ml,加入Ⅰ型胶原(20 mg/ml)激活血小板,30 min后加入EDTA(20 mmol/l)中止活化,随后2 000 r/min离心5 min(2次)。收集上清液,20 000 r/min离心90 min,得到PMPs沉淀并悬浮于MTB中。BCA法检测悬液PMPs浓度并稀释至0.2 μg/ml,-80 ℃冰箱保存备用。
1.4 动物分组、造模、给药和观察小鼠正常饮食7 d适应环境后,通过用5% DSS代替饮用水7 d(从第1天到第7天)诱导实验性结肠炎。所有小鼠随机分为4组,每组10只:① 正常对照组(normal control, NC):正常饮水,腹腔注射生理盐水;② PMPs组:正常饮水,腹腔注射PMPs;③ DSS组:DSS饮水+腹腔注射生理盐水;④ 实验组:DSS饮水+腹腔注射PMPs。PMPs每天注射1次(0.1 ml,浓度0.2 μg/ml),对照组注射同体积生理盐水。末次给药后麻醉、处死小鼠,收集肠道组织标本。每天定时对各组小鼠进行体质量称量、观察大便性状,并进行粪便隐血检测等,参照文献[9]进行疾病活动指数(disease activity index,DAI)统计。取远端结肠组织用10%甲醛固定,石蜡包埋,HE染色,参照文献[9]对小鼠结肠进行病理组织学评分(histopathological index,HI)。
1.5 结肠组织匀浆炎症因子及NETs水平检测取结肠黏膜组织在冷生理盐水中匀浆,离心后取上清液,按试剂盒说明进行MPO、NE、citH3与炎症因子IL-1β、IL-10和TNF-α含量的测定,相对荧光定量法用于检测游离DNA含量。
1.6 肠黏膜通透性检测小鼠禁食8 h后,按500 mg/kg对小鼠进行FITC-D(浓度125 mg/ml)灌胃操作,4 h后对小鼠进行水合氯醛腹腔注射麻醉,经门静脉取血100 μl,立即用1.9 ml Tris液(50 mol/L)稀释,4 000 r/min离心10 min后取上清液用酶标仪(激发波长480 nm和发射波长530 nm)测定FTIC-D含量[9]。
1.7 肠黏膜超微结构透射电镜分析将小鼠肠黏膜组织置于预冷的载玻片上,浸入2.5%戊二醛溶液后切成0.5~1 mm2小块,置于2.5%戊二醛溶液中4 ℃固定6 h。PBS冲洗,1%四氧化锇溶液固定,不同浓度乙醇梯度脱水后,置于60 ℃恒温箱环氧树脂固化48 h。超薄切片,枸橼酸铅染色,漂洗、干燥后使用透射电子显微镜观察肠黏膜组织结构。
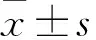
2 结果
2.1 PMPs对DSS结肠炎小鼠DAI评分和结肠病理损伤程度的影响NC组小鼠无血便和体质量下降等症状,结肠黏膜结构完整、腺体排列整齐、无炎性细胞浸润(图1B)。DSS组小鼠表现为体质量减轻,出现稀糊状大便和肉眼血便,DAI和HI评分较NC组升高(P<0.01,图2);DSS组小鼠光镜下可见结肠黏膜水肿增厚,肠黏膜上皮细胞损伤,部分腺体变形,杯状细胞减少,局部可见大量炎细胞浸润(图1B)。以上表明DSS结肠炎小鼠模型构建成功。PMPs组小鼠DAI评分与NC组接近,但HI评分升高(P<0.01,图2);结肠病理表现为肠黏膜局部水肿,腺体结构轻度变形,杯状细胞大致正常,局部可见炎细胞浸润(图1B);提示PMPs可能具有一定的致炎作用。实验组小鼠血便等症状较DSS组重,DAI和HI评分略高于DSS组,但差异无统计学意义。病理可见结肠黏膜肿胀、腺体结构受损、隐窝变形、炎性细胞广泛浸润(图1B)。上述结果提示,PMPs加重了DSS诱导的结肠炎。

图1 实验性结肠炎小鼠体质量及肠黏膜病理改变 A:PMPs对DSS结肠炎小鼠体质量的影响;B:DSS结肠炎小鼠肠黏膜病理损伤HE ×200;1:NC组;2:PMPs组;3:DSS组;4:实验组
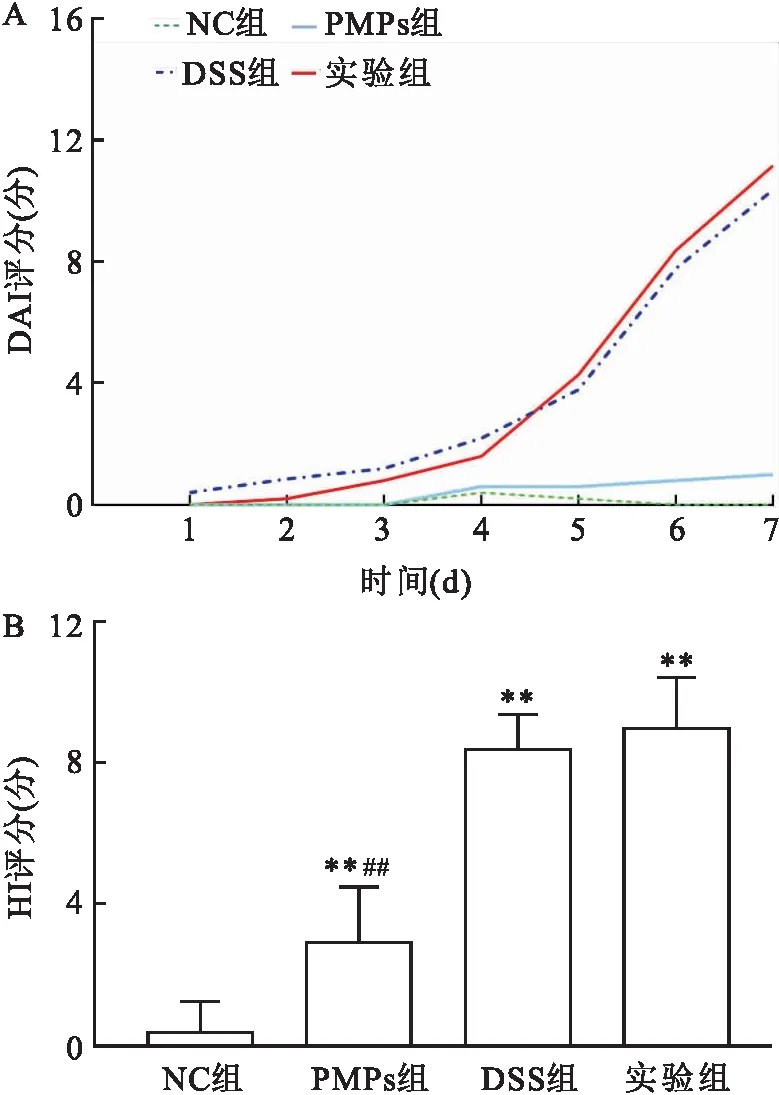
图2 PMPs对DSS结肠炎小鼠结肠DAI、HI评分的影响A:DAI评分;B:HI评分;与NC组比较:**P<0.01;与DSS组比较:##P<0.01
2.2 PMPs对DSS结肠炎小鼠结肠炎症因子水平的影响ELISA法检测小鼠结肠组织匀浆中炎症因子IL-1β、IL-10及TNF-α的表达水平,结果如图3所示。相较于NC组,PMPs组、DSS组及实验组促炎因子IL-1β、TNF-α水平均升高(F=242.226、449.459,P<0.05);其中DSS组与实验组TNF-α水平差异无统计学意义。
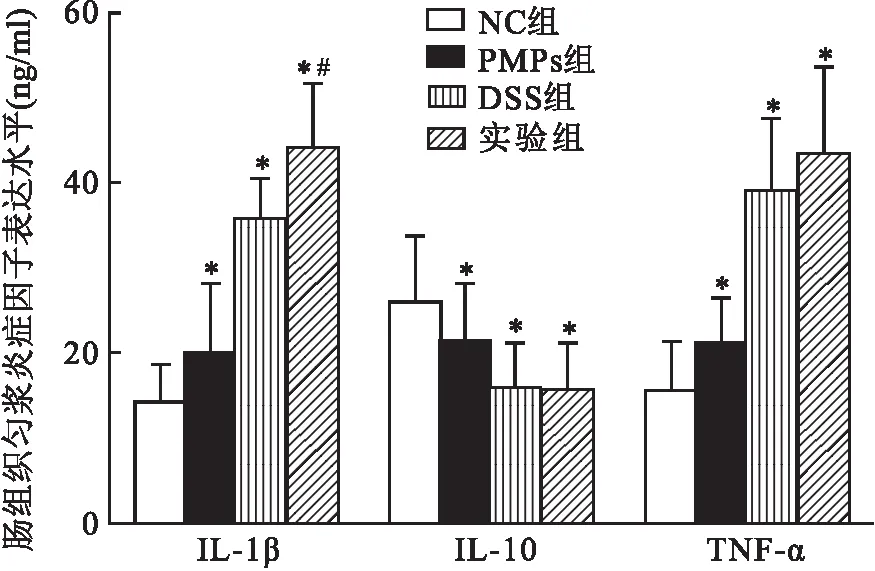
图3 PMPs对DSS结肠炎小鼠肠黏膜组织炎症因子表达水平的影响与NC组相比较:*P<0.05;与DSS组相比较:#P<0.05
与NC组相比,PMPs组、DSS模型组及实验组IL-10均降低(F=104.062,P<0.05);其中DSS组与实验组IL-10水平差异无统计学意义。DSS模型组小鼠经PMPs干预后, IL-1β、TNF-α水平升高(P<0.05),IL-10水平差异无统计学意义。
2.3 PMPs对DSS结肠炎小鼠结肠NETs水平的影响在共聚焦显微镜下无法直接观察到PMPs诱导DSS结肠炎小鼠形成NETs,故以小鼠结肠黏膜中检测NETs成分(MPO、NE和citH3)水平来反映NETs的形成。如图4所示,相较于NC组,DSS组MPO、NE和citH3水平稍增高(P<0.05),游离DNA水平降低(P<0.05);PMPs组MPO、NE 和citH3水平均升高(P<0.05)。与DSS组相比,实验组小鼠结肠组织MPO、NE和citH3表达水平增加,游离DNA表达水平降低(P<0.05)。结果提示PMPs诱导DSS结肠炎小鼠肠黏膜组织NETs形成。

图4 PMPs对DSS结肠炎小鼠肠黏膜组织NETs成分表达水平的影响与NC组比较:*P<0.05;与DSS组比较:#P<0.05
2.4 PMPs对DSS结肠炎小鼠肠黏膜通透性的影响如图5所示,与NC组比较,PMPs组、DSS组和实验组小鼠血浆FITC-D水平更高(P<0.05);与DSS组比较,实验组小鼠的血浆FITC-D水平明显增高(P<0.05)。以上结果提示PMPs可增加小鼠肠黏膜的通透性,可能进一步加重结肠炎症。
图5 PMPs对DSS结肠炎小鼠肠黏膜通透性的影响与NC组比较:*P<0.05;与DSS组比较:#P<0.05
进一步使用透射电镜对小鼠结肠黏膜超微结构进行观察,如图6所示。NC组小鼠肠黏膜微绒毛较长,排布紧密有序,细胞间连接结构完整(图6A);PMPs组可见肠微绒毛轻度萎缩,局部排列变稀疏,细胞连接结构尚清晰,紧密程度轻度降低(图6B);DSS组可见结肠微绒毛明显萎缩甚至缺失,细胞间连接复合体缩短变宽,细胞间隙扩大,部分紧密连接开放(图6C)。与DSS组相比,实验组小鼠同样出现微绒毛萎缩缺失,排列稀疏,细胞间隙增大,但细胞连接结构更加模糊(图6D)。以上结果提示PMPs可能加重DSS结肠炎小鼠肠黏膜屏障结构的损伤,增加肠黏膜通透性。
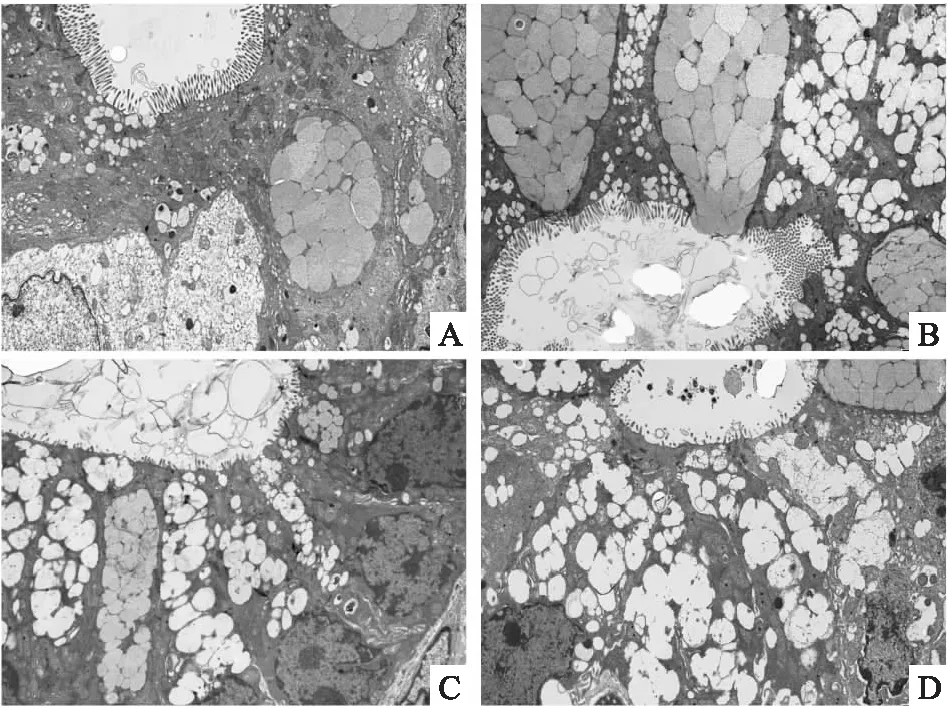
图6 小鼠肠黏膜超微结构图 ×2 000A:NC组;B:PMPS组;C:DSS组;D:实验组
3 讨论
IBD发病机制尚不十分明确,目前认为肠黏膜屏障损伤和肠道菌群紊乱具有重要作用。肠黏膜通透性增加,细菌和内毒素等致病因素通过病原相关分子模式和DAMP激发免疫反应和炎症损伤。其中,DAMP多来源于机体组织或细胞损伤释放的信号分子,通过识别细胞中的PRR受体,诱导炎症和免疫损伤的发生[10]。研究[8]表明,含有大量DAMP信号的细胞微粒与炎症免疫损伤过程密切相关。
PMPs是体内含量最高的细胞微粒,除了具有抗凝作用外,还兼具传递生物信息、参与炎症免疫反应的功能。大量研究[11-12]表明,PMPs可以参与血栓形成、触发炎症反应,在糖尿病、心血管疾病以及自身免疫性疾病中发挥重要作用。IBD发病常伴血小板增多,既往研究提示IBD患者存在PMPs表达上调[13],研究[4]结果显示IBD患者循环和肠组织中PMPs的表达水平均与疾病活动程度正相关,且PMPs能够在体外诱导中性粒细胞形成NETs,这些结果提示PMPs可能通过诱导NETs形成参与肠道炎症活动。
NETs是由活化的中性粒细胞释放的纤维网络状结构,含有NE、组蛋白H3、抗菌蛋白等高效抗菌成分,在糖尿病、动脉粥样硬化、自身免疫性疾病和癌症等疾病过程中均发挥重要作用[14]。在IBD活动期,患者体内PMPs水平升高,并通过与中性粒细胞作用形成NETs,加重结肠组织损伤,触发血栓形成[7, 15]。本研究在构建DSS结肠炎小鼠的基础上,通过PMPs腹腔注射,发现PMPs可以加重小鼠的结肠炎症。通过电镜和FITC-D检测,发现PMPs干预后小鼠肠上皮细胞损伤加重,表现为炎细胞广泛浸润、腺体破坏、细胞间连接疏松,肠黏膜通透性增加。本研究未能在结肠免疫荧光实验中直接观察到NETs形成,推测可能是由于NETs具有不稳定性和易分解性,肠道蠕动导致NETs清除速度较快,以及DSS结肠炎模型中结肠隐窝脓肿数量不足等原因。但实验组在注射PMPs后结肠黏膜组织匀浆MPO、NE及citH3等NETs成分含量的明显增加,间接反映小鼠结肠黏膜中NETs的形成,表明PMPs能够诱导NETs形成,增加DSS结肠炎小鼠的肠黏膜通透性。
该研究表明,PMPs可在小鼠体内诱导NETs形成,增加DSS结肠炎小鼠的肠黏膜通透性。但有关NETs对肠屏障功能的影响机制研究尚不深入,可能与其对肠上皮细胞的直接毒性作用和抑制炎症因子释放有关;PMPs如何与中性粒细胞相互作用诱导NETs形成、进而影响肠道黏膜免疫,仍需进一步研究。

