KCTD7基因在肝细胞癌中的表达和作用机制
赵 雅,赵 楠,赵 薇,喻文颖,房 晓
肝癌是中国常见的肿瘤之一,侵袭性强、预后较差,是病死率仅次于胃癌的恶性肿瘤[1-2]。肝癌的诱因较多,主要由过量饮酒、乙型肝炎病毒感染、黄曲霉毒素摄入等导致[1]。肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝癌的95%,是最常见的肝癌类型[2]。手术切除作为非移植治疗方法效果较好,但仍有70%的患者在术后5年内复发[2]。HCC的发病机制目前尚未研究透彻,因此,进一步明确HCC发生发展的作用机制对于提高肝癌早期诊断率、寻找治疗靶点、改善预后至关重要。
钾离子通道四聚体结构域7(potassium channel tetramerization domain containing 7,KCTD7)是KCTD蛋白家族的成员之一,包含一个与电压门控钾离子通道中T1结构域类似的氨基末端结构域[3]。已有研究[3]表明KCTD7基因突变可能是通过调节谷氨酰胺转运体SAT2使神经元功能受损进而影响多种疾病发生发展,如进行性肌阵挛癫痫及神经元蜡样脂褐质沉积症等。但目前,KCTD7与肿瘤相关的研究尚未见报道。该研究运用癌症基因组图谱(the cancer genome atlas,TCGA)数据库探索KCTD7在HCC中的表达及其对预后生存的影响,为临床研究提供新线索。
1 材料与方法
1.1 数据来源从TCGA数据库(https://tcga-data.nci.nih.gov/)中获取HCC患者的mRNA表达谱及年龄、性别、生存信息及临床分期等临床数据,共有369例患者参与此次研究,样本中50例肝癌组织样本有配对的正常组织样本。
1.2 表达差异与预后分析通过Wilcoxon检验比较肝癌组织和正常组织、50例配对肝癌组织及其正常组织中KCTD7的表达情况,分析KCTD7基因与HCC患者年龄、性别及临床分期之间的关系。使用R软件包ggplot2和ggpubr进行绘图和统计学分析[4]。运用R软件包survival和survminer通过中位数分组和算法优化分组两种分组方法分析KCTD7与HCC患者总生存期(overall survival)之间的关系[4]。采用单因素和多因素Cox回归分析,研究KCTD7基因、患者年龄、性别及临床分期与患者预后间的关系,使用R软件包forestplot绘制森林图[4]。
1.3 基因富集分析及免疫浸润分析为探究KCTD7基因的潜在功能,对基因按照与KCTD7表达的相关性(Spearman方法)排序后使用R软件包clusterProfiler[5]通过分子标签数据库(Molecular Signatures Database)的基因集进行基因富集分析(GSEA)[6],并用R软件包enrichplot绘图。为探究KCTD7对免疫微环境的影响,根据之前报道的28种免疫细胞的免疫浸润特征基因表达谱,使用R软件包GSVA[7]通过单样本基因富集分析(ssGSEA)比较低表达组(表达量最低的10%样本)和高表达组(表达量最高的10%样本)的免疫浸润情况,并使用R软件包ggplot2和ggpubr绘图并进行统计分析[4]。
1.4 细胞培养和细胞系构建Lenti-X 293T、Hep3B和HepG2细胞在含有10%胎牛血清的DMEM培养基中,置于37 ℃、5%CO2培养箱中培养。使用Tet-on诱导表达系统,建立可以使用盐酸强力霉素(Doxycycline,Dox)诱导对照siRNA(siNC)和KCTD7敲低siRNA(siKCTD7)表达的Hep3B、HepG2细胞株。
1.5 细胞增殖检测将Dox诱导72 h的Hep3B、HepG2对照组和KCTD7敲低细胞均按1×104个/ml接种于12孔板中。每种细胞的对照组和敲低组每天设置3个复孔。每隔24 h分别对孔板中两组细胞的3个复孔进行台盼蓝染色计数,连续计数5 d并绘制生长曲线。
1.6 Western blot离心收集Dox诱导72 h的Hep3B、HepG2对照组和KCTD7敲低细胞,并用尿素超声裂解。SDS-PAGE胶电泳分离蛋白,并将蛋白质转移至PVDF膜上,5%脱脂牛奶封闭30 min后,室温下与TUBULIN(1 ∶80 000;诺唯赞)、CDK6(1 ∶7 500;Proteintech;14052-1-AP)、P21(1 ∶1 000;Proteintech;10355-1-AP)、Cleaved PARP1(1 ∶1 000;HUABIO;ET1608-10)抗体孵育90 min,TBST洗涤3次,用辣根过氧化物酶偶联的抗兔二抗(1 ∶50 000;HUABIO;HP0112)或抗鼠二抗(1 ∶40 000;CWBIO;CW0102S)室温孵育60 min。最后用TBST洗涤3次后,使用ECL化学发光试剂盒(诺唯赞,E412)显影。使用Image J进行灰度分析。
1.7 流式细胞术检测细胞周期将Dox诱导72 h的Hep3B、HepG2对照组和KCTD7敲低细胞离心收集在离心管中,用约5 ml 70%无水乙醇重悬并置于-20 ℃固定过夜。离心后再用PBS洗涤一次,加入1 ml含0.1% Triton X-100的PBS孵育15 min。再次离心后弃上清液,加入1 ml PI染液(含0.04 mg/ml PI,0.5 μg/ml RNase的PBS溶液)室温孵育30 min。使用流式细胞仪计数20 000个细胞并用Modfit软件分析数据。
1.8 Caspase 3酶活性检测收取1×106个Dox诱导72 h的Hep3B、HepG2对照组和KCTD7敲低细胞,使用Caspase 3活性检测试剂盒(上海碧云天公司,C1115)冰浴裂解,离心收集上清液检测蛋白浓度及Caspase 3活性。按试剂盒说明于37 ℃孵育8 h,通过测定在405 nm处的吸光度除以蛋白浓度计算Caspase 3的相对活性。
1.9 统计学处理使用SPSS 27.0和GraphPad Prism 9软件进行统计学分析并作图,所有数据均来自3次独立重复实验。单因素样本两组间比较采用双尾t检验,多样本组间均值比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1KCTD7基因在肝癌组织中表达情况根据TCGA数据库中所得到的369例HCC患者数据进行分析,肝癌组织KCTD7的表达量明显高于正常组织,差异有统计学意义(W=1 588,P<0.01,图1A)。对50例肝癌组织及其配对的正常组织进行配对差异表达分析,结果显示,相较于配对的正常组织,KCTD7在HCC患者的肿瘤组织中表达量升高(V=64,P<0.01,图1B)。
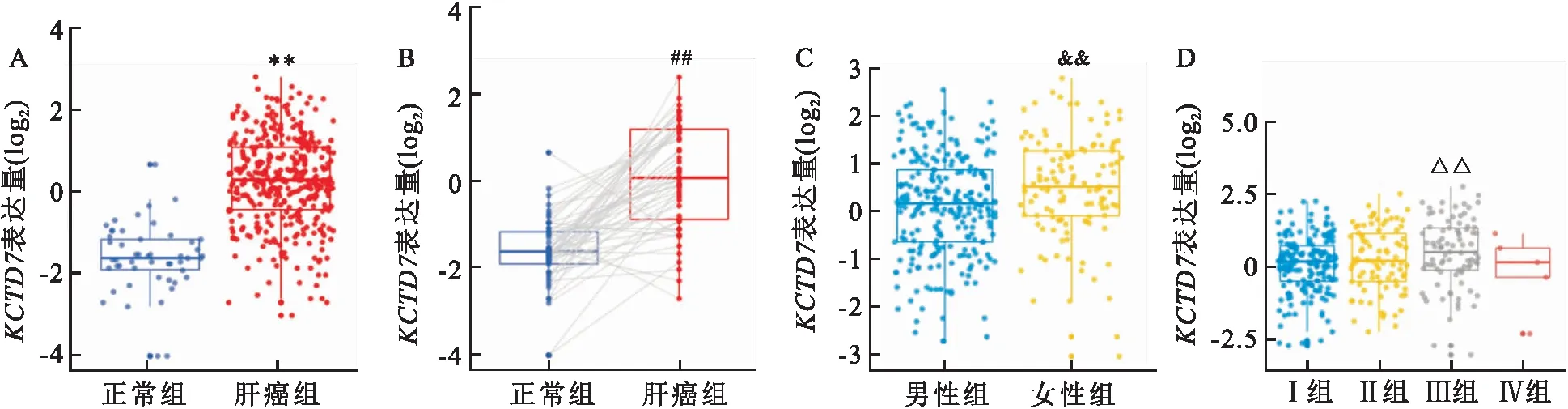
图1 KCTD7在肝癌组织和正常组织中的表达水平及其与临床数据之间的相关性A:TCGA数据库HCC患者肝癌组织与正常组织中KCTD7的差异表达;与正常组比较:**P<0.01;B:肝癌组织及其配对的正常组织中KCTD7的差异表达;与配对的正常组织比较:##P<0.01;C:不同性别的HCC患者中KCTD7的差异表达;与男性组比较:&&P<0.01;D:不同HCC临床分期患者中KCTD7的差异表达;与Ⅰ期比较:△△P<0.01
将KCTD7与患者临床信息组合分析,KCTD7的表达与HCC患者年龄无明显相关性,但女性HCC患者中KCTD7的表达量相较于男性更高,且差异有统计学意义(W=11 696,P<0.01,图1C)。在临床分期上,Ⅲ期样本中KCTD7的表达量较Ⅰ期更高(W=5 586.5,P=0.004,图1D)。上述结果提示KCTD7在肝癌组织中高表达,且KCTD7的表达与性别及临床分期相关。
2.2KCTD7高表达的HCC患者预后比较对TCGA数据库中获取的HCC患者KCTD7表达水平和总体生存期进行生存概率分析,结果表明,与KCTD7低表达组相比,高表达组的生存时间减少(χ2=5.071,P=0.024,图2A)。通过软件按算法优化分组计算结果也表明KCTD7高表达组预后较差(χ2=12.425,P<0.01,图2B)。单因素Cox回归模型表明KCTD7高表达组患者的总体生存期显著缩短(HR=1.26,95%CI为1.04~1.52,P=0.016,表1)。多因素Cox回归分析也同时证实了KCTD7的高表达对患者预后的不良影响(HR=1.22,95%CI为1.01~1.48,P=0.041,表2)。上述分析结果提示KCTD7的表达对HCC患者的预后具有潜在的指示价值。
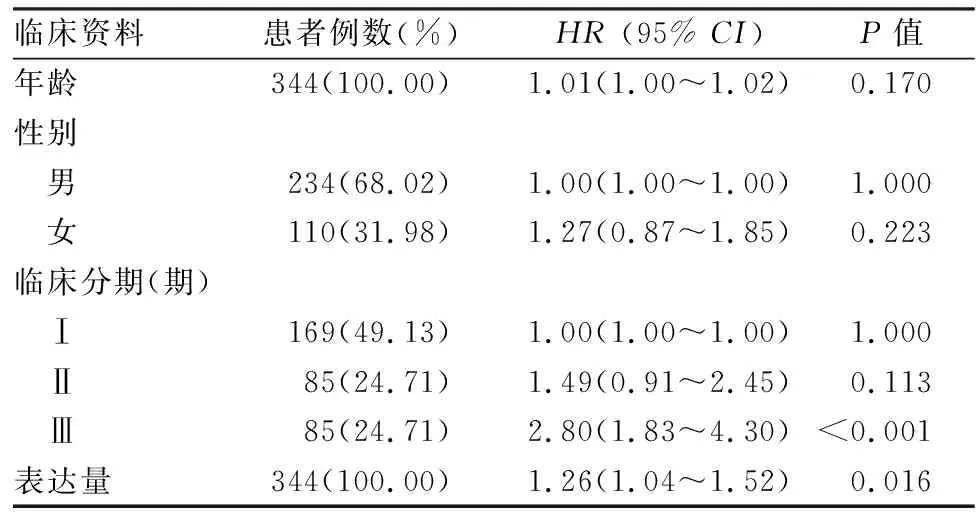
表1 单因素Cox回归分析
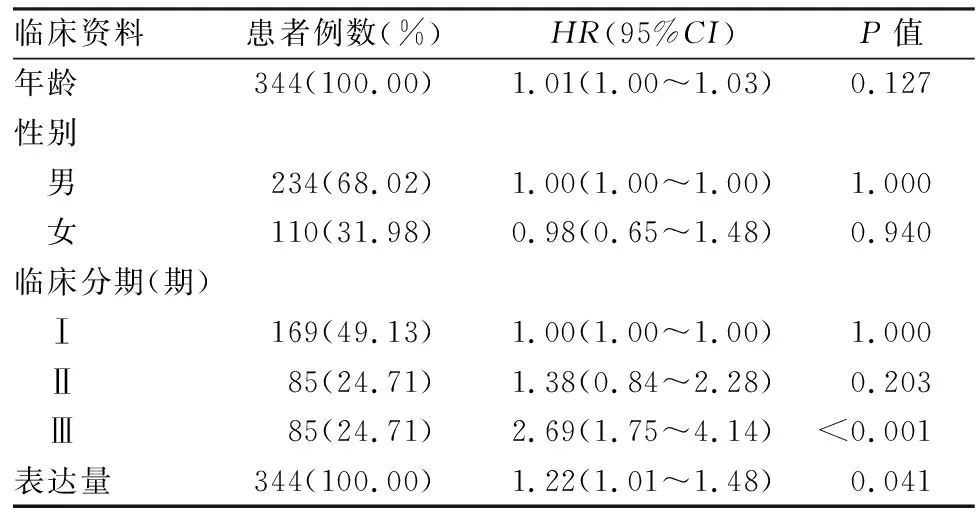
表2 多因素Cox回归分析
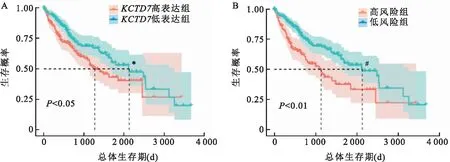
图2 KCTD7与HCC患者预后分析A:运用中位数分组分析KCTD7表达高低与HCC患者预后生存的关系;与KCTD7高表达组比较:*P<0.05;B:运用算法优化分组分析KCTD7表达高低与HCC患者预后生存的关系;与高风险组比较:#P<0.01
2.3KCTD7对HCC细胞增殖的影响为探究KCTD7基因对HCC的作用,在HCC细胞Hep3B和HepG2中敲低KCTD7。运用活细胞计数法连续计数5 d并绘制生长曲线,结果显示,与siNC组比较,敲低了内源KCTD7表达的Hep3B细胞和HepG2细胞的siKCTD7组的增殖速度均下降,差异有统计学意义(P<0.01)。见图3。结果表明KCTD7能够促进HCC细胞增殖。
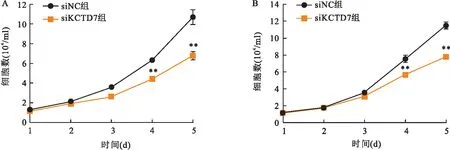
图3 敲低KCTD7对HCC细胞增殖的影响A:活细胞计数法分析KCTD7敲低对Hep3B细胞增殖的影响;B:活细胞计数法分析KCTD7敲低对HepG2细胞增殖的影响;与siNC组比较:**P<0.01
2.4KCTD7对HCC细胞周期分布的影响为研究KCTD7基因影响HCC增殖的潜在机制,运用GSEA分析KCTD7基因的潜在调控信号通路。结果显示,KCTD7高表达与多条细胞增殖信号通路正相关:如G2M检查点调控通路、有丝分裂纺锤体调控通路等。这些结果提示,KCTD7可能是通过上述通路影响HCC细胞增殖从而发挥促进HCC生长的作用。为验证上述可能性,分别构建了对照组和KCTD7敲低组的Hep3B和HepG2细胞系,运用流式细胞术检测了它们的细胞周期分布情况,结果显示,敲低KCTD7后,两株HCC细胞系的细胞周期分布均发生了改变(tHep3B-G0/G1=26.78,P=0.001 4;tHepG2-G0/G1=11.81,P=0.007 1,图4A~D)。进一步运用Western blot方法检测了细胞周期蛋白的表达情况,在两株HCC细胞系中,敲低KCTD7基因均能导致细胞周期相关蛋白CDK6表达量下降(t=13.07,P<0.01,图4E)、P21表达量上升(t=6.635,P=0.005,图4F)。
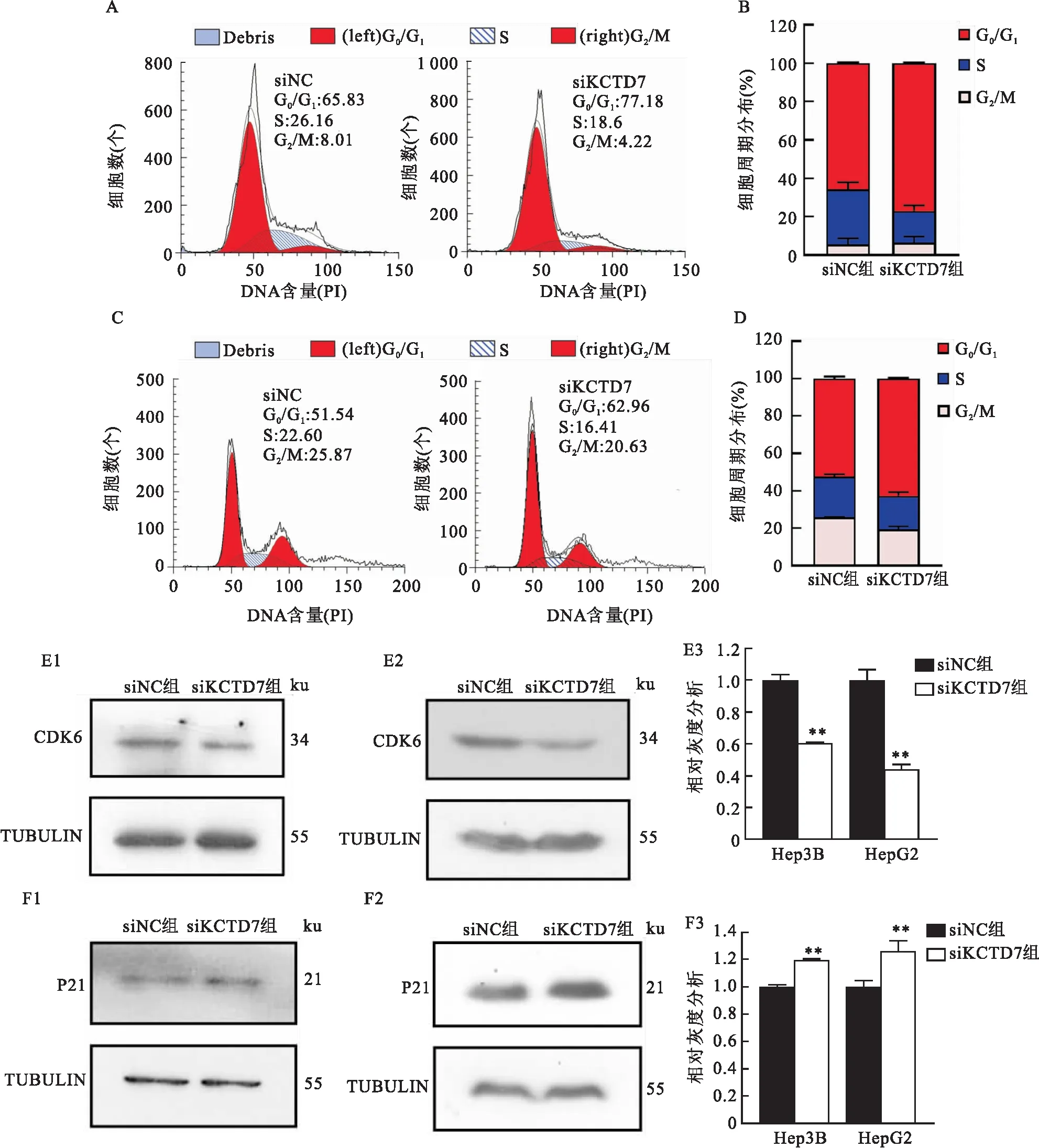
图4 敲低KCTD7对HCC细胞周期的影响A:流式细胞术分析Hep3B细胞的细胞周期(G0/G1、G2/M);B:Hep3B细胞中细胞周期分布情况;C:流式细胞术分析HepG2细胞的细胞周期(G0/G1、G2/M);D:HepG2细胞中细胞周期分布情况;E:Western blot检测Hep3B和HepG2细胞中CDK6蛋白表达情况;1:Hep3B;2:HepG2;3:直方图比较;F:Western blot检测Hep3B和HepG2细胞中P21蛋白表达情况;与siNC组比较:**P<0.01
2.5KCTD7对HCC细胞凋亡的影响分析CCLE数据库中癌症细胞系的基因表达情况,Hep3B内源的KCTD7表达量较HepG2高,推测敲低Hep3B中的KCTD7后,其肿瘤细胞生物学效应可能更明显,因此,以Hep3B细胞为代表,进一步进行了凋亡相关指标的检测。对对照组和KCTD7敲低的Hep3B细胞中的Caspase 3酶活进行检测,发现敲低KCTD7基因后,细胞中Caspase 3活性升高(t=87.67,P<0.01,图5A)。又运用Western blot检测了上述细胞中的Cleaved PARP1蛋白的表达情况,发现敲低KCTD7后,Cleaved PARP1的蛋白条带由对照组中不可见转变为显著可见(图5B)。综上,两项实验均提示在Hep3B细胞中敲低KCTD7能够促进细胞凋亡。
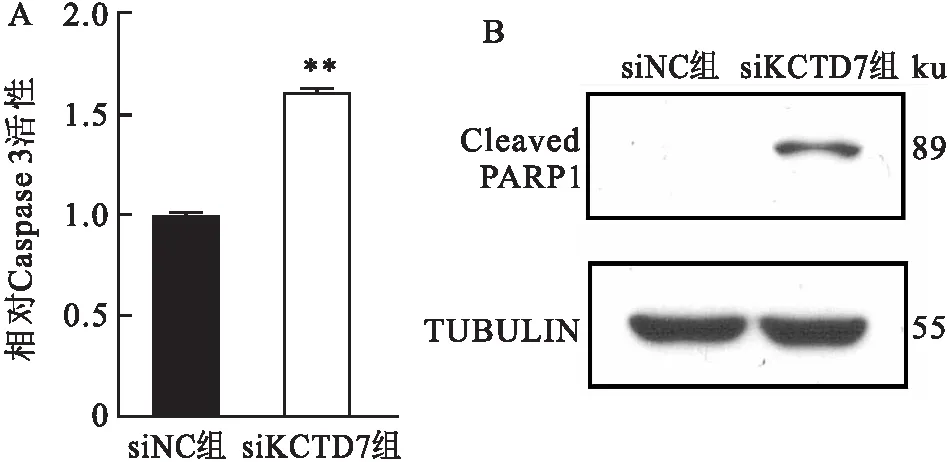
图5 敲低KCTD7对Hep3B细胞凋亡的影响A:Caspase 3活性分析检测Hep3B细胞中Caspase 3的酶活力;B:Western blot检测Hep3B细胞中Cleaved PARP1蛋白表达情况;与siNC组比较:**P<0.01
2.6KCTD7在肝癌中的免疫浸润情况为探究KCTD7对免疫微环境的影响,通过28种免疫细胞的免疫基因表达图谱,对KCTD7高表达组和低表达组进行ssGSEA方法分析。结果显示,与KCTD7低表达组相比,高表达组免疫浸润情况出现明显变化,如激活的CD4+T细胞(W=1 085,P<0.01)、中枢记忆CD4+T细胞(W=1 156,P<0.01)、自然杀伤细胞(NK细胞)(W=971,P=0.009)及2型辅助T细胞(Th2)(W=1 101,P<0.01)的丰度上调,而激活的CD8+T细胞(W=378,P<0.01)、CD56自然杀伤细胞(W=429,P=0.002)、嗜酸粒细胞(W=246,P<0.01)、中性粒细胞(W=413,P=0.001)、1型辅助T细胞(Th1)(W=465,P=0.007)及17型辅助T细胞(Th17)(W=427,P=0.002)的丰度下调(图6)。这些免疫细胞的变化表明,KCTD7对免疫微环境产生干扰可能是导致HCC患者预后较差的一个原因。
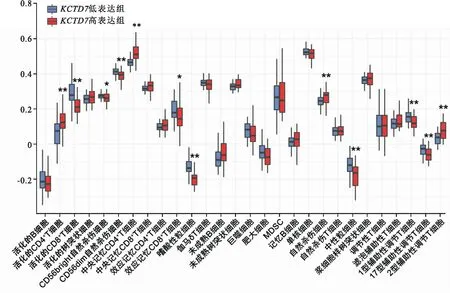
图6 KCTD7低表达组和高表达组中HCC肿瘤的免疫浸润情况与KCTD7低表达组比较:*P<0.05,**P<0.01
3 讨论
本研究通过生物信息学方法初步探索了KCTD7基因在肝癌组织中的表达水平及其预后生存情况。结果显示,KCTD7在肝癌组织中高表达,且KCTD7表达水平是影响HCC患者总生存期的独立危险因素。GSEA提示KCTD7可能与细胞周期通路相关,于是本研究构建了两种稳定敲低KCTD7的HCC细胞系,结合活细胞计数、流式细胞分析、Western blot等多种技术手段,在体外验证了KCTD7主要通过影响细胞周期分布而调控HCC细胞的增殖。
肿瘤免疫微环境是指由肿瘤细胞周围的一些免疫细胞、血管、细胞外基质等组成的微环境。在免疫细胞中,CD8+T细胞是抗肿瘤免疫反应中强大的效应细胞。CD8+T细胞可以通过其T细胞受体(T cell receptor,TCR)与癌细胞表达的MHC肽复合物结合来特异性识别癌细胞[8]。TCR参与后,CD8+T细胞通过颗粒酶和穿孔素介导的细胞凋亡或通过FASL-FAS介导的细胞死亡来破坏靶细胞[8]。CD4+T细胞的Th1亚型通过帮助抗肿瘤细胞毒性CD8+细胞和B细胞以及通过产生干扰素-γ(IFN-γ)和TNF-α直接杀死癌细胞来发挥抗肿瘤发生功能[8]。另一方面,Th2亚型可分泌具有促肿瘤功能的抗炎介质[8]。嗜酸粒细胞具有通过释放细胞毒性分子直接杀死肿瘤细胞的能力,但嗜酸性粒细胞还可以调节肿瘤脉管系统并调节TME的免疫成分,因此,它们可以同时具有促肿瘤和抗肿瘤发生的功能,具体取决于他们收到的激活信号[8]。NK细胞是具有细胞毒性的先天性淋巴样细胞。它们识别并杀死缺乏MHC I类表达的应激细胞,具有强大的抗癌能力[8]。ssGSEA结果提示,KCTD7能够对肿瘤免疫微环境产生干扰进而影响HCC细胞生长及患者的预后。
既往研究表明,部分KCTD家族成员与神经性及心血管疾病有一定关联,如KCTD8和KCTD12通过促进胆碱能神经元中GABAB受体的轴突表达和突触前兴奋影响大脑功能[9]、KCTD10可能通过改变汉族血浆HDL-C水平导致冠心病易感性[10]。但目前KCTD家族与肿瘤相关的研究甚少,如在肺癌中KCTD11通过与β-catenin结合,调节Wnt和Hippo通路的活性,从而抑制肿瘤的进展[11]、在黑色素瘤中通过抑制KCTD12的表达增强细胞的干性进而促进黑色素瘤细胞的生长[12]。而KCTD7与癌症相关的研究未见报道。本研究探讨了KCTD7对HCC发生发展的作用,研究中发现KCTD7基因的表达在GSEA中富集到了Wnt/β-Catenin信号通路,这与KCTD11调控肺癌的信号通路一致,提示KCTD家族各成员对肿瘤的影响可能具有相关性。此外,GSEA结果表明KCTD7参与了多种生长调控通路,如G2/M检查点调控通路、有丝分裂调控通路等,这提示KCTD7对HCC的影响可能是通过影响其细胞生长及细胞周期导致。
综上所述,该研究运用TCGA数据库通过生物信息学分析,发现KCTD7基因高表达对HCC的预后较差,并通过实验验证敲低KCTD7基因后能够影响细胞周期,进一步抑制HCC细胞的增殖,促进细胞凋亡。研究为后续HCC的临床治疗提供了可能的新思路。

